名校
解题方法
1 . “天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。75号元素铼Re,熔点仅次于钨,是稀有金属之一、回答:
(1)镍基态原子有___________ 种不同空间运动状态的电子,第四周期与基态镍原子单电子数相同的元素有___________ 种(不含镍元素)。
(2)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。0.2mol二丁二酮肟合镍分子内含有σ键___________ mol,碳碳键是由___________ 轨道重叠形成的。

a.sp3和sp2 b.sp2和 sp2 c.sp2和p d.sp3和p
(3) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键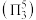 。
。 键角
键角___________  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因___________ 。
(4)人类合成的第一个稀有气体化合物是XeF+PtF ,PtF
,PtF 中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
(5)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子填在氧原子围成的___________ (填“四面体”“立方体"或“八面体”)空隙中,该晶胞的空间利用率为___________ (铼的原子半径为rRepm,氧原子半径为rOpm,列出计算式)。
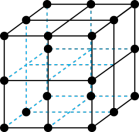
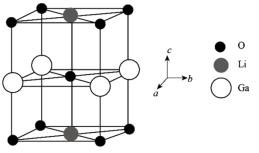
(6)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
①上述晶胞沿着a轴的投影图为___________ (填字母)。
A. B.
B.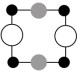 C.
C.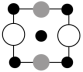
②用 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为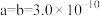 m,
m,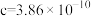 m,则其密度为
m,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
(1)镍基态原子有
(2)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。0.2mol二丁二酮肟合镍分子内含有σ键

a.sp3和sp2 b.sp2和 sp2 c.sp2和p d.sp3和p
(3)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键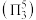 。
。 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(4)人类合成的第一个稀有气体化合物是XeF+PtF
 ,PtF
,PtF 中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。| A.熔化状态下不能导电 |
| B.XeF+中所有原子都满足8电子稳定结构 |
| C.用两个Cl替换F后,所得PtF4Cl2有两种结构 |
| D.含有离子键、极性键、非极性键和配位键 |
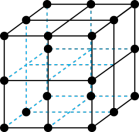
(6)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B. C.
C.
②用
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为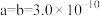 m,
m,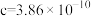 m,则其密度为
m,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)NH3在水中的溶解度是常见气体中最大的。
①下列因素与NH3的水溶性没有关系的是___________ (填字母)。
a.NH3和H2O都是极性分子
b.NH3在水中易形成氢键
c.NH3溶于水建立了以下平衡: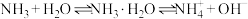
d.NH3是一种易液化的气体
②NH3溶于水时,大部分NH3与H2O通过氢键结合形成 。根据氨水的性质推知
。根据氨水的性质推知 的结构式为
的结构式为___________ 。(填字母)
a. b.
b.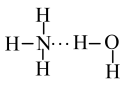 b. c.
b. c. d.
d.
(2)第ⅤA族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示。则Y轴可表示的氢化物(RH3)性质可能是___________。(填字母)

(3)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是___________
(4)氮、磷、砷为同主族元素,As4O6的分子结构如图所示,其中As原子的杂化方式为___________ ,1 mol As4O6含有σ键的物质的量为___________ 。

(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是___________ (填“极性”或“非极性”)分子。
(6)NH 中的H-N-H的键角比 NH3中的H-N-H的键角大, 原因是
中的H-N-H的键角比 NH3中的H-N-H的键角大, 原因是___________ 。
(1)NH3在水中的溶解度是常见气体中最大的。
①下列因素与NH3的水溶性没有关系的是
a.NH3和H2O都是极性分子
b.NH3在水中易形成氢键
c.NH3溶于水建立了以下平衡:
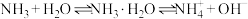
d.NH3是一种易液化的气体
②NH3溶于水时,大部分NH3与H2O通过氢键结合形成
 。根据氨水的性质推知
。根据氨水的性质推知 的结构式为
的结构式为a.
 b.
b.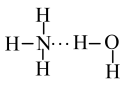 b. c.
b. c. d.
d.
(2)第ⅤA族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示。则Y轴可表示的氢化物(RH3)性质可能是___________。(填字母)

| A.稳定性 | B.沸点 | C.R-H键能 | D.分子间作用力 |
(4)氮、磷、砷为同主族元素,As4O6的分子结构如图所示,其中As原子的杂化方式为

(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是
(6)NH
 中的H-N-H的键角比 NH3中的H-N-H的键角大, 原因是
中的H-N-H的键角比 NH3中的H-N-H的键角大, 原因是
您最近一年使用:0次
名校
解题方法
3 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)氢化钠( )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为___________ 。
(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(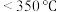 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是___________ ,键角:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
(4)咔唑(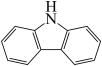 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比(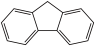 )的高,其主要原因是
)的高,其主要原因是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
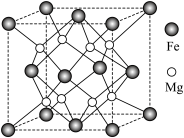
①距离 原子最近的
原子最近的 原子个数是
原子个数是___________ 。
②铁镁合金的化学式为___________ 。
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为___________  。
。
④若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(
 )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是
 (填“
(填“ ”或“
”或“ ”)。
”)。(4)咔唑(
 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离
 原子最近的
原子最近的 原子个数是
原子个数是②铁镁合金的化学式为
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为
 。
。④若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-05-25更新
|
345次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题
名校
4 . Ⅰ.图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水。向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝。

(1)反应后将试管C中的液体冷却,取出少量,加入到新制的Cu(OH)2悬浊液中,加热到沸腾可观察到现象是_______ 。
Ⅱ.硫酸铜可应用于电镀、颜料、医药、农药等方面。如图是探究铜与浓硫酸反应生成硫酸铜的实验装置图:
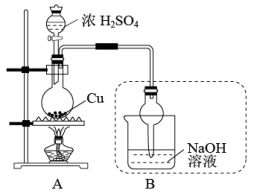
完成下列填空:
(2)图中盛放浓H2SO4的玻璃仪器名称是_______ 。写出图中装置B的作用: _______ 。
Ⅲ.[Cu(NH3)4]SO4·H2O晶体制备:
(3)制备过程:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;再加入适量乙醇,将析出[Cu(NH3)4]SO4·H2O晶体。请解释加入乙醇后析出晶体的原因_______ 。
(4)写出沉淀溶解得透明溶液的离子方程式_______ 。
(5)1mol[Cu(NH3)4]SO4含有_______ molσ键。
(6)从结构的角度分析NH3比NF3的键角大的原因:_______ 。

(1)反应后将试管C中的液体冷却,取出少量,加入到新制的Cu(OH)2悬浊液中,加热到沸腾可观察到现象是
Ⅱ.硫酸铜可应用于电镀、颜料、医药、农药等方面。如图是探究铜与浓硫酸反应生成硫酸铜的实验装置图:

完成下列填空:
(2)图中盛放浓H2SO4的玻璃仪器名称是
Ⅲ.[Cu(NH3)4]SO4·H2O晶体制备:
(3)制备过程:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;再加入适量乙醇,将析出[Cu(NH3)4]SO4·H2O晶体。请解释加入乙醇后析出晶体的原因
(4)写出沉淀溶解得透明溶液的离子方程式
(5)1mol[Cu(NH3)4]SO4含有
(6)从结构的角度分析NH3比NF3的键角大的原因:
您最近一年使用:0次
名校
解题方法
5 . [化学-选修3:物质结构与性质]
(1)丙酮(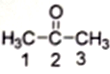 )分子中2号碳原子的杂化方式为
)分子中2号碳原子的杂化方式为__________ ;
(2)写出镍原子的电子排布式_____________ ;
(3)H2O分子的键角比NH3分子的键角小,原因是_____________________________________ ;
(4)N、P、As属于同族元素,它们的简单氢化物沸点由大到小的顺序为_________________ (用化学式表示),其原因是 ____________________________________ ;
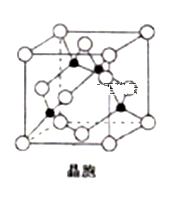
(5)由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。
①将晶胞内的4个黑点相互连接所形成的立体构型是______________ ;
②晶体中与一个氯原子距离最近的氯原子有___________ 个;
③已知该晶体的密度为ρg.cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为____________ pm(列出计算式即可);
(1)丙酮(
 )分子中2号碳原子的杂化方式为
)分子中2号碳原子的杂化方式为(2)写出镍原子的电子排布式
(3)H2O分子的键角比NH3分子的键角小,原因是
(4)N、P、As属于同族元素,它们的简单氢化物沸点由大到小的顺序为

(5)由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。
①将晶胞内的4个黑点相互连接所形成的立体构型是
②晶体中与一个氯原子距离最近的氯原子有
③已知该晶体的密度为ρg.cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
您最近一年使用:0次
2018-12-17更新
|
193次组卷
|
2卷引用:宁夏回族自治区银川市长庆高级中学2019届高三上学期第四次月考理科综合化学试题



