名校
1 . M、N、R、X、Y五种元素在元素周期表中的位置如下图所示。元素M和R的原子序数之和等于N的原子序数,元素R和X的原子序数之和等于Y的原子序数。
(1)N的元素名称为_______ 。
(2)在同周期元素中,比元素M的第一电离能小的元素有______ 种。
(3)元素M与元素X、Y形可成化合物MX3、MY3,MY3分子中元素Y的化合价为+1价。
①化合物MX3分子构型为_______ 。
②比较MX3、MY3键角大小∠XMX_____ ∠YMY(填“>”、“<”或“=”)
(4)基团的诱导效应对有机酸的酸性有较大的影响。有机酸的酸性强弱可用电离常数的负对数pKa的大小来衡量,则pKa(CH2XCOOH)____ pKa(CH3COOH)(填“>”、“<”或“=”)
(5)元素X的简单氢化物HX极易溶于水,其重要原因是HX分子可以跟水分子形成氢键,那么在HX的水溶液中可能存在的氢键类型有_____ 种。
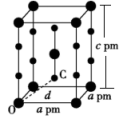
(6)化合物XeX2的晶体属四方晶系,晶胞参数如图所示(晶胞棱边夹角均为90°)。已知Xe-X键长为rpm,晶胞中O、C间距离d=___ pm。
| M | R | X |
| N | Y |
(2)在同周期元素中,比元素M的第一电离能小的元素有
(3)元素M与元素X、Y形可成化合物MX3、MY3,MY3分子中元素Y的化合价为+1价。
①化合物MX3分子构型为
②比较MX3、MY3键角大小∠XMX
(4)基团的诱导效应对有机酸的酸性有较大的影响。有机酸的酸性强弱可用电离常数的负对数pKa的大小来衡量,则pKa(CH2XCOOH)
(5)元素X的简单氢化物HX极易溶于水,其重要原因是HX分子可以跟水分子形成氢键,那么在HX的水溶液中可能存在的氢键类型有
(6)化合物XeX2的晶体属四方晶系,晶胞参数如图所示(晶胞棱边夹角均为90°)。已知Xe-X键长为rpm,晶胞中O、C间距离d=

您最近一年使用:0次
名校
2 . 2020年11月24日4时30分,长征五号遥五运载火箭在中国文昌航天发射场点火升空,将嫦娥五号月球探测器运送至地月转移轨道,开启我国首次地外天体采样返回之旅。月球的沙土中含有丰富的钛铁矿,土壤中还含有硅、铝、钾、钡、钴、铷、汞、铜和稀土元素等。
(1)钛在元素周期表中的位置是___________ ,与Ti处于同周期、未成对电子数与Ti相同的元素还有___________ 种。
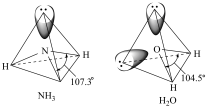
(2)[Cu(NH3)4]SO4·H2O是一种蓝色晶体,其中的NH3、H2O的空间结构和相应的键角如图所示,H2O的键角比NH3小的原因是___________ 。
(3)基态铁原子的价层电子排布图为___________ 。相同条件下,Fe3+和Fe2+相比,___________ 更稳定,原因是___________ 。
(4)某钙钛矿的晶体结构属于立方结构,具有高度的对称性,其晶胞结构如图所示。
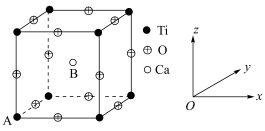
①在该晶体中每个钛离子周围与它最近且距离相等的钛离子有___________ 个。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A的原子分数坐标为(0,0,0),则B(Ca)的原子分数坐标为___________ 。
(1)钛在元素周期表中的位置是
(2)[Cu(NH3)4]SO4·H2O是一种蓝色晶体,其中的NH3、H2O的空间结构和相应的键角如图所示,H2O的键角比NH3小的原因是

(3)基态铁原子的价层电子排布图为
(4)某钙钛矿的晶体结构属于立方结构,具有高度的对称性,其晶胞结构如图所示。

①在该晶体中每个钛离子周围与它最近且距离相等的钛离子有
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A的原子分数坐标为(0,0,0),则B(Ca)的原子分数坐标为
您最近一年使用:0次
名校
解题方法
3 . 碳族元素中的碳、硅、锗及其化合物在诸多领域具有重要用途。回答下列问题:
(1)锗元素位于周期表___________ 区,基态硅原子核外电子排布式为___________ ,基态碳原子核外有___________ 种不同运动状态的电子。
(2)草酸(分子式:H2C2O4,结构简式:HOOC-COOH)与NiSO4溶液反应,可制备NiC2O4∙2H2O。
①组成H2C2O4的元素中第一电离能最大的为___________ (填元素符号),该分子中σ键与π键的个数比为___________ 。
② 中的键角为
中的键角为___________ ,该离子的空间构型为___________ 。
(3)金刚石的结构及某碳硅化合物的晶胞结构如图所示,晶胞参数为anm。___________ (NA为阿伏加德罗常数的值,下同)。
②该碳硅化合物的化学式为___________ ,其晶体的密度为___________ g∙cm-3。
(1)锗元素位于周期表
(2)草酸(分子式:H2C2O4,结构简式:HOOC-COOH)与NiSO4溶液反应,可制备NiC2O4∙2H2O。
①组成H2C2O4的元素中第一电离能最大的为
②
 中的键角为
中的键角为(3)金刚石的结构及某碳硅化合物的晶胞结构如图所示,晶胞参数为anm。

②该碳硅化合物的化学式为
您最近一年使用:0次
2023-12-26更新
|
157次组卷
|
3卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高二下学期开学化学试题
名校
4 . 根据所学化学知识填空。
Ⅰ.铁及其化合物在生活中用途广泛,绿矾(FeSO4·7H2O)是一种常见的中草药成分,失水后可转为FeSO4·H2O,FeSO4·H2O结构如图所示:

(1)从结构的角度看,Fe2+不如Fe3+稳定,原因是_____ 。
(2)SO 和H2O分子比较,
和H2O分子比较,_____ 的键角更大。
(3)S原子核外有_____ 种能量不同的电子。
Ⅱ.物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识,回答问题:
(4)一定温度下,向1L0.1mol/LCH3COOH溶液中加入少量CH3COONa固体,则溶液中 的值
的值_____ (填“增大”、“减小”或“不变”)。
(5)25℃下,有浓度均为0.1mol/L的三种溶液:a.Na2CO3;b.NaClO;c.CH3COONa(已知25℃时电离常数:H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8;CH3COOH:Ka=1.8×10-5)往等浓度的Na2CO3、NaClO的混合溶液中加入少量醋酸,请写出发生反应的离子方程式_____ 。
(6)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银固体分别放入:a.100mL蒸馏水中b.100mL0.2mol/LAgNO3溶液中;c.100mL0.1mol/L氯化铝溶液中;d.100mL0.1mol/L盐酸溶液中;充分搅拌后,相同温度下银离子浓度由大到小的顺序是_____ (填序号)。
(7)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O 。为了使废水的排放达标,进行如图处理:
。为了使废水的排放达标,进行如图处理:

常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_____ 。备注:Ksp[Cr(OH)3]=6.0×10-31 Kw=1×10-14
Ⅰ.铁及其化合物在生活中用途广泛,绿矾(FeSO4·7H2O)是一种常见的中草药成分,失水后可转为FeSO4·H2O,FeSO4·H2O结构如图所示:

(1)从结构的角度看,Fe2+不如Fe3+稳定,原因是
(2)SO
 和H2O分子比较,
和H2O分子比较,(3)S原子核外有
Ⅱ.物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识,回答问题:
(4)一定温度下,向1L0.1mol/LCH3COOH溶液中加入少量CH3COONa固体,则溶液中
 的值
的值(5)25℃下,有浓度均为0.1mol/L的三种溶液:a.Na2CO3;b.NaClO;c.CH3COONa(已知25℃时电离常数:H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8;CH3COOH:Ka=1.8×10-5)往等浓度的Na2CO3、NaClO的混合溶液中加入少量醋酸,请写出发生反应的离子方程式
(6)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银固体分别放入:a.100mL蒸馏水中b.100mL0.2mol/LAgNO3溶液中;c.100mL0.1mol/L氯化铝溶液中;d.100mL0.1mol/L盐酸溶液中;充分搅拌后,相同温度下银离子浓度由大到小的顺序是
(7)含Cr2O
 的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O 。为了使废水的排放达标,进行如图处理:
。为了使废水的排放达标,进行如图处理:
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=
您最近一年使用:0次
名校
解题方法
5 . 碳族元素及其化合物在国家工业领域有非常重要用途。回答下列问题:
(1)基态锗原子价层电子排布式为_______ 。
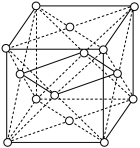
(2)干冰晶胞如图,顶点和面心是 分子。在干冰晶体中每个
分子。在干冰晶体中每个  分子周围有
分子周围有_______ 个  分子相邻。
分子相邻。
(3)关于C、Si及其化合物的结构和性质, 下列叙述正确的是_______
(4)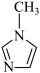 中碳原子的杂化轨道类型有
中碳原子的杂化轨道类型有_______ 。
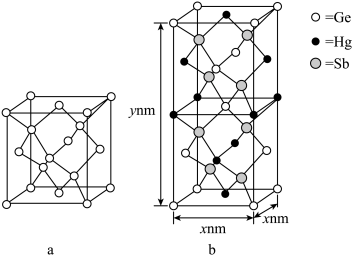
(5)理论计算预测, 由汞(Hg) 、锗 (Ge) 、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图 a 所示)中部分Ge原子被Hg和Sb取代后形成,设X的最简式的式量Mr, 则X晶体的密度为_______  (列出计算式)。
(列出计算式)。
(1)基态锗原子价层电子排布式为
(2)干冰晶胞如图,顶点和面心是
 分子。在干冰晶体中每个
分子。在干冰晶体中每个  分子周围有
分子周围有 分子相邻。
分子相邻。
(3)关于C、Si及其化合物的结构和性质, 下列叙述正确的是_______
| A.分子稳定性: C2H6<Si2H6 |
B. 是原子晶体, 硬度:SiC>C(金刚石) 是原子晶体, 硬度:SiC>C(金刚石) |
| C.还原性: SiH4<CH4 |
D.Si的原子半径大于C原子半径, 难以形成 键 键 |
 中碳原子的杂化轨道类型有
中碳原子的杂化轨道类型有(5)理论计算预测, 由汞(Hg) 、锗 (Ge) 、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图 a 所示)中部分Ge原子被Hg和Sb取代后形成,设X的最简式的式量Mr, 则X晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次



