解题方法
1 . 回答下列问题。
(1)一定条件下,在 密闭容器中充入
密闭容器中充入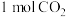 和
和 ,发生反应:
,发生反应: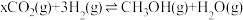 。测得
。测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
___________ ; 内
内 的平均反应速率
的平均反应速率
___________ 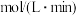 ,平衡时
,平衡时 的转化率为
的转化率为___________ 。
(2)下列措施能提高正反应速率的是___________(填正确答案的字母)。
(3)工业上常以水煤气( 和
和 )为原料合成甲醇。已知:
)为原料合成甲醇。已知: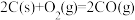
 ;
;
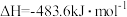 ,则
,则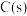 与
与 制备水煤气的热化学方程式为
制备水煤气的热化学方程式为___________ 。
(1)一定条件下,在
 密闭容器中充入
密闭容器中充入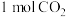 和
和 ,发生反应:
,发生反应: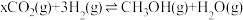 。测得
。测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。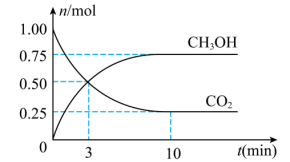

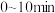 内
内 的平均反应速率
的平均反应速率
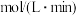 ,平衡时
,平衡时 的转化率为
的转化率为(2)下列措施能提高正反应速率的是___________(填正确答案的字母)。
| A.降低温度 | B.增加 的量 的量 | C.使用催化剂 | D.及时分离出甲醇 |
 和
和 )为原料合成甲醇。已知:
)为原料合成甲醇。已知: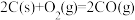
 ;
;
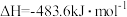 ,则
,则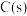 与
与 制备水煤气的热化学方程式为
制备水煤气的热化学方程式为
您最近一年使用:0次
2 . 请回答下列问题:
(1)现有常温下 的盐酸(甲)和
的盐酸(甲)和  的醋酸溶液(乙),请根据下列操作回答:
的醋酸溶液(乙),请根据下列操作回答:
①常温下 溶液加水稀释过程,下列表达式的数值一定变小的是
溶液加水稀释过程,下列表达式的数值一定变小的是___________ (填字母)。
A.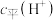 B.
B.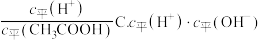 D.
D.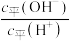
②取 的乙溶液,加入等体积的水,醋酸的电离平衡
的乙溶液,加入等体积的水,醋酸的电离平衡___________ (填“向左”“向右”或“不”)移动;另取10 的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中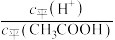 的值将
的值将___________ (填“增大”“减小”或“无法确定”)。
③相同条件下,取等体积的甲、乙两溶液,分别加水稀释100倍,所得溶液的 大小关系为
大小关系为  (甲)
(甲)___________  (乙)(填>、<”或“=”)。
(乙)(填>、<”或“=”)。
(2)联氨(又称肼, ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨是二元弱碱,在水中的电离方程式与氨相似,其一级电离方程式为
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨是二元弱碱,在水中的电离方程式与氨相似,其一级电离方程式为___________ ,其一级电离常数 
___________ 。
(已知: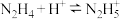 的
的 )
)
(3)已知 的
的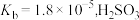 的
的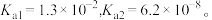 若氨水的浓度为
若氨水的浓度为 ,溶液中的c平(OH-)=
,溶液中的c平(OH-)=___________ mol/L。将  通入该氨水中,当
通入该氨水中,当  降至
降至  时,溶液中的
时,溶液中的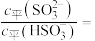
___________ 。
(1)现有常温下
 的盐酸(甲)和
的盐酸(甲)和  的醋酸溶液(乙),请根据下列操作回答:
的醋酸溶液(乙),请根据下列操作回答:①常温下
 溶液加水稀释过程,下列表达式的数值一定变小的是
溶液加水稀释过程,下列表达式的数值一定变小的是A.
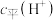 B.
B.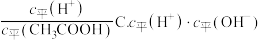 D.
D.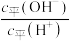
②取
 的乙溶液,加入等体积的水,醋酸的电离平衡
的乙溶液,加入等体积的水,醋酸的电离平衡 的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中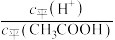 的值将
的值将③相同条件下,取等体积的甲、乙两溶液,分别加水稀释100倍,所得溶液的
 大小关系为
大小关系为  (甲)
(甲) (乙)(填>、<”或“=”)。
(乙)(填>、<”或“=”)。(2)联氨(又称肼,
 ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨是二元弱碱,在水中的电离方程式与氨相似,其一级电离方程式为
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨是二元弱碱,在水中的电离方程式与氨相似,其一级电离方程式为
(已知:
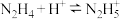 的
的 )
)(3)已知
 的
的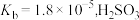 的
的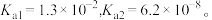 若氨水的浓度为
若氨水的浓度为 ,溶液中的c平(OH-)=
,溶液中的c平(OH-)= 通入该氨水中,当
通入该氨水中,当  降至
降至  时,溶液中的
时,溶液中的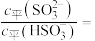
您最近一年使用:0次
2024-04-08更新
|
47次组卷
|
2卷引用:宁夏回族自治区石嘴山市平罗县平罗中学2023-2024学年高二下学期5月期中化学试题
名校
解题方法
3 . 铋(Bi)的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为 ,含FeS、CuO、
,含FeS、CuO、 等杂质)制备
等杂质)制备 的工艺流程如下图:
的工艺流程如下图:
ⅰ. 易水解;
易水解; 难溶于冷水
难溶于冷水
ⅱ.“氧化浸取”时,铋元素转化为 ,硫元素转化为硫单质
,硫元素转化为硫单质
ⅲ.

ⅳ.该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
(1)“氧化浸取”前将辉铋矿粉碎的目的是______ 。
(2)“滤渣1”的主要成分为S和______ (填化学式)。
(3)“氧化浸取”步骤中温度升高可以增大反应速率,但高于50℃时浸取速率反而会下降,其可能的原因是______ 、______ 。
(4)“除铁”时,调节溶液pH的范围是______ 。
(5)“除铜”时发生反应: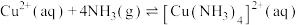
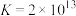 ,则
,则
______ 。
(6)“转化”时,生成 的离子方程式为
的离子方程式为______ ;“转化”后应冷却至室温再过滤,原因是______ 。
 ,含FeS、CuO、
,含FeS、CuO、 等杂质)制备
等杂质)制备 的工艺流程如下图:
的工艺流程如下图: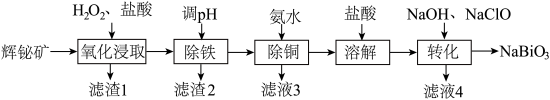
ⅰ.
 易水解;
易水解; 难溶于冷水
难溶于冷水ⅱ.“氧化浸取”时,铋元素转化为
 ,硫元素转化为硫单质
,硫元素转化为硫单质ⅲ.


ⅳ.该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
金属离子 |
|
|
|
|
开始沉淀的pH | 7.6 | 2.7 | 4.8 | 4.5 |
沉淀完全的pH | 9.6 | 3.7 | 6.4 | 5.5 |
(1)“氧化浸取”前将辉铋矿粉碎的目的是
(2)“滤渣1”的主要成分为S和
(3)“氧化浸取”步骤中温度升高可以增大反应速率,但高于50℃时浸取速率反而会下降,其可能的原因是
(4)“除铁”时,调节溶液pH的范围是
(5)“除铜”时发生反应:
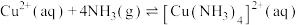
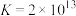 ,则
,则
(6)“转化”时,生成
 的离子方程式为
的离子方程式为
您最近一年使用:0次
2024-04-07更新
|
263次组卷
|
3卷引用:宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题
名校
解题方法
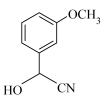
4 . Tapentadol是一种新型止痛药物,合成其中间体ⅷ的路线如下:
(1)化合物ⅰ的分子式为______ ,含有的官能团名称为______ 。
(2)根据化合物iii的结构特征,分析预测其可能的化学性质,完成下表。
(3)反应⑤的方程式可表示为ⅲ+ⅳ→ⅶ+y,化合物y的化学式为______ 。
(4)关于反应⑥的说法中,正确的有______。
(5)化合物x是ⅱ的同分异构体,满足下列条件的同分异构体有______ 种。
a.含有苯环,且苯环上有两个侧链
b.与 溶液反应显紫色
溶液反应显紫色
c.1 mol x与足量Na反应,生成1 mol
(6)以 和NaCN为含碳原料,合成化合物
和NaCN为含碳原料,合成化合物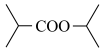 。
。
基于你设计的合成路线,回答下列问题:
①相关步骤涉及到卤代烃制醇反应,其化学方程式为____________ 。
②最后一步反应中,能与 反应产生
反应产生 的有机反应物为
的有机反应物为______ (写结构简式)。
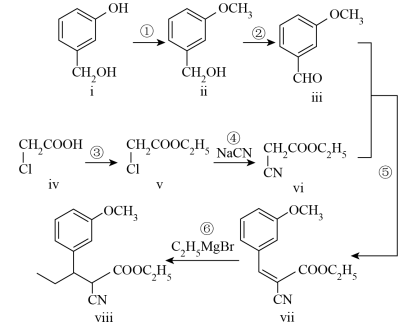
(1)化合物ⅰ的分子式为
(2)根据化合物iii的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂、条件 | 反应形成的新物质 | 反应类型 |
| a | 新制 、加热 、加热 | ||
| b |
|
(3)反应⑤的方程式可表示为ⅲ+ⅳ→ⅶ+y,化合物y的化学式为
(4)关于反应⑥的说法中,正确的有______。
| A.反应过程中,有π键发生断裂 | B.化合物ⅶ的 杂化的原子只有C 杂化的原子只有C |
| C.化合物ⅶ所有碳原子一定处于同一平面上 | D.化合物ⅷ只有1个手性碳原子 |
(5)化合物x是ⅱ的同分异构体,满足下列条件的同分异构体有
a.含有苯环,且苯环上有两个侧链
b.与
 溶液反应显紫色
溶液反应显紫色c.1 mol x与足量Na反应,生成1 mol

(6)以
 和NaCN为含碳原料,合成化合物
和NaCN为含碳原料,合成化合物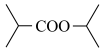 。
。基于你设计的合成路线,回答下列问题:
①相关步骤涉及到卤代烃制醇反应,其化学方程式为
②最后一步反应中,能与
 反应产生
反应产生 的有机反应物为
的有机反应物为
您最近一年使用:0次
2024-03-22更新
|
1349次组卷
|
4卷引用:2024届宁夏银川市唐徕中学高三下学期四模理科综合试题-高中化学
2024届宁夏银川市唐徕中学高三下学期四模理科综合试题-高中化学广东省佛山市2024届高三教学质量检测(一)化学试题(已下线)题型12 有机推断题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)压轴题14?有机合成与推断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)-2024年高考化学压轴题专项训练(新高考通用)
5 . Ⅰ.Deacon直接氧化法可按下列催化过程进行:





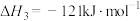
(1)则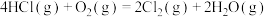 的
的
_______  。
。
Ⅱ.利用如图所示装置测定中和热的实验步骤如下:
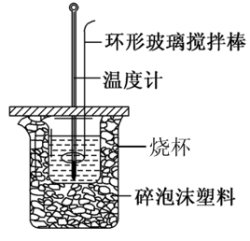
①用量筒量取50mL 盐酸倒入小烧杯中,测出盐酸温度;
盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL NaOH溶液,并用同一温度计测出其温度;
NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(2)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式:_______ 。
(3)倒入NaOH溶液的正确操作是_______ (填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)使盐酸与NaOH溶液混合均匀的正确操作是_______(填序号)。
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 的稀盐酸恰好完全反应,其反应热分别为
的稀盐酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为_______ 。
(6)假设盐酸和氢氧化钠溶液的密度都是 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容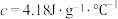 。为了计算中和热,某学生实验记录数据如下:
。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热
_______ (结果保留一位小数)。
(7)该同学通过实验测出的中和热有误差,造成这一结果的原因不可能的是_______。





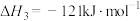
(1)则
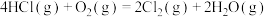 的
的
 。
。Ⅱ.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL
 盐酸倒入小烧杯中,测出盐酸温度;
盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL
 NaOH溶液,并用同一温度计测出其温度;
NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(2)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式:
(3)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)使盐酸与NaOH溶液混合均匀的正确操作是_______(填序号)。
| A.用温度计小心搅拌 | B.揭开硬纸片用玻璃棒搅拌 |
| C.轻轻地振荡烧杯 | D.用套在温度计上的玻璃搅拌器轻轻地搅动 |
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L
 的稀盐酸恰好完全反应,其反应热分别为
的稀盐酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为(6)假设盐酸和氢氧化钠溶液的密度都是
 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容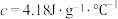 。为了计算中和热,某学生实验记录数据如下:
。为了计算中和热,某学生实验记录数据如下:| 实验序号 | 起始温度 | 终止温度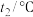 | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |

(7)该同学通过实验测出的中和热有误差,造成这一结果的原因不可能的是_______。
| A.实验装置保温、隔热效果差 | B.用量筒量取盐酸时仰视读数 |
| C.分多次将NaOH溶液倒入小烧杯中 | D.用测量盐酸的温度计直接测定NaOH溶液的温度 |
您最近一年使用:0次
解题方法
6 . Ⅰ.习近平总书记十分重视生态环境保护,多次对生态文明建设作出重要指示,其中研究 、
、 、CO等气体的无害化处理对治埋大气污染、建设生态文明具有重要意义。
、CO等气体的无害化处理对治埋大气污染、建设生态文明具有重要意义。
(1)处理含CO、 烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:
烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:
①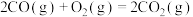
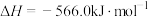
②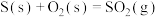

则CO与 反应生成S的热化学方程式是
反应生成S的热化学方程式是_______ 。
(2)在一绝热体系且容积固定的密闭容器中,用 催化还原
催化还原 也可以消除氮氧化物的污染,其中发生化学反应之一为:
也可以消除氮氧化物的污染,其中发生化学反应之一为: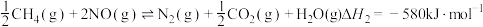 ,能说明上反应达到平衡状态的是
,能说明上反应达到平衡状态的是_______ 。
a.平均摩尔质量不变 b. 和
和 的体积比保持不变
的体积比保持不变
c.体系压强保持不变 d.每生成1mol 同时生成2molNO
同时生成2molNO
Ⅱ.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(3)生产氢气:将水蒸气通过红热的炭即产生水煤气;
 ,
,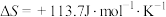 ,该反应在(填“高温”或“低温”或“任何温度”)
,该反应在(填“高温”或“低温”或“任何温度”)_______ 下,才能自发进行。
(4)合成氨工业中的主要反应是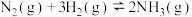
 ,从温度和压强的角度回答:要加快合成氨的反应速率应选择
,从温度和压强的角度回答:要加快合成氨的反应速率应选择_______ ;要提高氨的产率应选择_______ 。
 、
、 、CO等气体的无害化处理对治埋大气污染、建设生态文明具有重要意义。
、CO等气体的无害化处理对治埋大气污染、建设生态文明具有重要意义。(1)处理含CO、
 烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:
烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:①
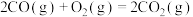
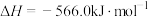
②
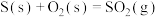

则CO与
 反应生成S的热化学方程式是
反应生成S的热化学方程式是(2)在一绝热体系且容积固定的密闭容器中,用
 催化还原
催化还原 也可以消除氮氧化物的污染,其中发生化学反应之一为:
也可以消除氮氧化物的污染,其中发生化学反应之一为: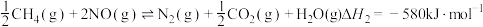 ,能说明上反应达到平衡状态的是
,能说明上反应达到平衡状态的是a.平均摩尔质量不变 b.
 和
和 的体积比保持不变
的体积比保持不变c.体系压强保持不变 d.每生成1mol
 同时生成2molNO
同时生成2molNOⅡ.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(3)生产氢气:将水蒸气通过红热的炭即产生水煤气;

 ,
,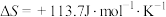 ,该反应在(填“高温”或“低温”或“任何温度”)
,该反应在(填“高温”或“低温”或“任何温度”)(4)合成氨工业中的主要反应是
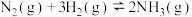
 ,从温度和压强的角度回答:要加快合成氨的反应速率应选择
,从温度和压强的角度回答:要加快合成氨的反应速率应选择
您最近一年使用:0次
名校
7 . 中国近代化学启蒙者徐寿首次把“Nitrogen”译成中文时曾写成“淡气”,意指它“冲淡”了空气中的氧气。含氮化合物种类繁多,用途广泛,根据信息回答下列问题。
(1)GaN是第三代半导体材料,基态Ga的电子排布式为_______ ,GaN晶体为共价键空间网状结构,熔点1700℃,晶体类型为_______ 。
(2)硫酸四氨合铂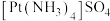 在工业上用于镀铂,Pt的配位数为
在工业上用于镀铂,Pt的配位数为_______ ,其阴离子的空间构型为_______ 。
(3)氨缩脲与胆矾溶液反应得到如下图所示的紫色离子,离子中碳原子、氮原子的杂化类型分别是_______ 、_______ 。O的第二电离能比N第二电离能更大,解释其原因是_______ 。 气体常用作天然气的警报剂。
气体常用作天然气的警报剂。 与其同分异构体
与其同分异构体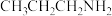 相比较,熔点较高的是
相比较,熔点较高的是_______ 。 易与
易与 形成三甲胺正离子,反应中形成的化学键属于
形成三甲胺正离子,反应中形成的化学键属于_______ 。
A.氢键 B.极性键 C.π键 D.配位键
(5)某铁氮化合物晶体的晶胞结构如图所示。_______ 。
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______  (列出计算式即可)。
(列出计算式即可)。
(1)GaN是第三代半导体材料,基态Ga的电子排布式为
(2)硫酸四氨合铂
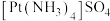 在工业上用于镀铂,Pt的配位数为
在工业上用于镀铂,Pt的配位数为(3)氨缩脲与胆矾溶液反应得到如下图所示的紫色离子,离子中碳原子、氮原子的杂化类型分别是

 气体常用作天然气的警报剂。
气体常用作天然气的警报剂。 与其同分异构体
与其同分异构体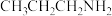 相比较,熔点较高的是
相比较,熔点较高的是 易与
易与 形成三甲胺正离子,反应中形成的化学键属于
形成三甲胺正离子,反应中形成的化学键属于A.氢键 B.极性键 C.π键 D.配位键
(5)某铁氮化合物晶体的晶胞结构如图所示。

②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为
 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2024-03-10更新
|
165次组卷
|
2卷引用:宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学
名校
解题方法
8 . 现有金属单质 、
、 、
、 和气体甲、乙、丙以及物质
和气体甲、乙、丙以及物质 、
、 、
、 、
、 、
、 ,它们之间的相互转化关系如图所示
,它们之间的相互转化关系如图所示 图中有些反应的生成物和反应的条件没有标出
图中有些反应的生成物和反应的条件没有标出 。
。

请回答下列问题:
(1)写出下列物质的化学式:B___________ ,丙___________ ,
(2)根据要求回答:
a.D溶液和 溶液在空气中混合的现象:
溶液在空气中混合的现象:___________ ;
b.反应③的离子方程式:___________ ;
c.反应⑦的离子方程式:___________ ;
d.反应⑥的化学方程式:___________ ;
e.反应I+E生成G的离子方程式:___________ 。
 、
、 、
、 和气体甲、乙、丙以及物质
和气体甲、乙、丙以及物质 、
、 、
、 、
、 、
、 ,它们之间的相互转化关系如图所示
,它们之间的相互转化关系如图所示 图中有些反应的生成物和反应的条件没有标出
图中有些反应的生成物和反应的条件没有标出 。
。
请回答下列问题:
(1)写出下列物质的化学式:B
(2)根据要求回答:
a.D溶液和
 溶液在空气中混合的现象:
溶液在空气中混合的现象:b.反应③的离子方程式:
c.反应⑦的离子方程式:
d.反应⑥的化学方程式:
e.反应I+E生成G的离子方程式:
您最近一年使用:0次
9 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)以生物材质(以 计)与水蒸气反应制取
计)与水蒸气反应制取 是一种低耗能,高效率的制
是一种低耗能,高效率的制 方法。该方法由气化炉制造
方法。该方法由气化炉制造 和燃烧炉再生
和燃烧炉再生 两步构成,气化炉中涉及到的反应如下:
两步构成,气化炉中涉及到的反应如下:
I.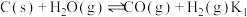
Ⅱ.
Ⅲ.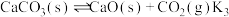
Ⅳ.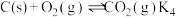
①该工艺制 总反应可表示为
总反应可表示为 ,该反应的平衡常数
,该反应的平衡常数
___________ (用 等的代数式表示)。
等的代数式表示)。
②绝热条件下,将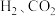 以体积比
以体积比 充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是
充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是___________ 。
A. 与
与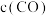 比值不变 B.容器内气体密度不变
比值不变 B.容器内气体密度不变
C.容器内气体压强不变 D.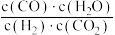 不变
不变
(2) 的速率方程为
的速率方程为 ,
,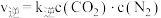 (
( 、
、 为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
净反应速率 等于正、逆反应速率之差,平衡时,
等于正、逆反应速率之差,平衡时,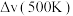
___________ (填“>”、“<”或“=”) 。
。
(3)一定条件下, 与
与 反应可合成
反应可合成 ,
, ,该反应分两步进行:
,该反应分两步进行:
ⅰ.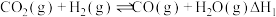
ⅱ.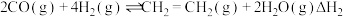
 ,压强恒定为
,压强恒定为 时,将
时,将 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
 的平衡转化率为
的平衡转化率为___________ ,反应ⅰ的平衡常数
___________ ( 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。
(4)利用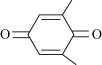 (Q)与
(Q)与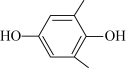 (QH2)电解转化法从烟气中分离
(QH2)电解转化法从烟气中分离 的原理如图,已知气体可选择性通过膜电极,溶液不能通过
的原理如图,已知气体可选择性通过膜电极,溶液不能通过
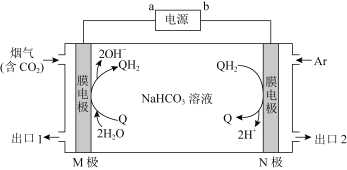
①(填“a”或“b”)___________ 为电源负极。
② 从出口
从出口___________ (填“1”或“2”)排出, 在
在 极上发生的反应为
极上发生的反应为___________ 。
(1)以生物材质(以
 计)与水蒸气反应制取
计)与水蒸气反应制取 是一种低耗能,高效率的制
是一种低耗能,高效率的制 方法。该方法由气化炉制造
方法。该方法由气化炉制造 和燃烧炉再生
和燃烧炉再生 两步构成,气化炉中涉及到的反应如下:
两步构成,气化炉中涉及到的反应如下:I.
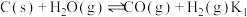
Ⅱ.

Ⅲ.
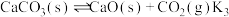
Ⅳ.
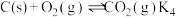
①该工艺制
 总反应可表示为
总反应可表示为 ,该反应的平衡常数
,该反应的平衡常数
 等的代数式表示)。
等的代数式表示)。②绝热条件下,将
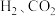 以体积比
以体积比 充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是
充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是A.
 与
与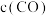 比值不变 B.容器内气体密度不变
比值不变 B.容器内气体密度不变C.容器内气体压强不变 D.
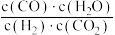 不变
不变(2)
 的速率方程为
的速率方程为 ,
,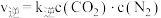 (
( 、
、 为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。净反应速率
 等于正、逆反应速率之差,平衡时,
等于正、逆反应速率之差,平衡时,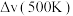
 。
。(3)一定条件下,
 与
与 反应可合成
反应可合成 ,
, ,该反应分两步进行:
,该反应分两步进行:ⅰ.
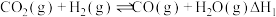
ⅱ.
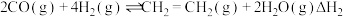
 ,压强恒定为
,压强恒定为 时,将
时,将 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:| 组分 |  |  |  |
| 物质的量分数(%) | 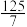 | 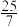 | 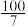 |
 的平衡转化率为
的平衡转化率为
 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。(4)利用
 (Q)与
(Q)与 (QH2)电解转化法从烟气中分离
(QH2)电解转化法从烟气中分离 的原理如图,已知气体可选择性通过膜电极,溶液不能通过
的原理如图,已知气体可选择性通过膜电极,溶液不能通过
①(填“a”或“b”)
②
 从出口
从出口 在
在 极上发生的反应为
极上发生的反应为
您最近一年使用:0次
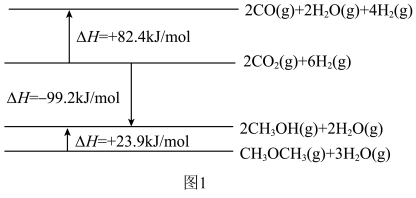
10 . 利用 催化加氢制二甲醚,可以实现
催化加氢制二甲醚,可以实现 的再利用,涉及以下主要反应:
的再利用,涉及以下主要反应:
I.

Ⅱ.

相关物质及能量变化的示意图如图1所示。
(1)反应Ⅱ的
______  ,该反应在
,该反应在______ (填“高温”、“低温”或“任何温度”)下能自发进行。
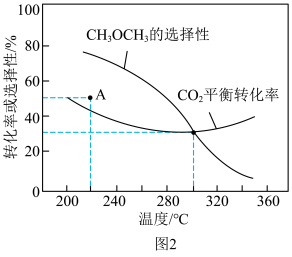
(2)恒压条件下, 、
、 起始量相等时,
起始量相等时, 的平衡转化率和
的平衡转化率和 的选择性随温度变化如图2所示。已知:
的选择性随温度变化如图2所示。已知: 的选择性
的选择性
 时,通入
时,通入 、
、 各
各 ,平衡时
,平衡时 的选择性、
的选择性、 的平衡转化率都为
的平衡转化率都为 ,平衡时生成
,平衡时生成 的物质的量为
的物质的量为______  ,此温度下反应I的平衡常数
,此温度下反应I的平衡常数
______ (保留2位有效数字。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
② 区间,
区间, 平衡转化率随温度变化的曲线如图2所示,分析曲线变化的原因:
平衡转化率随温度变化的曲线如图2所示,分析曲线变化的原因:______ 。
(3)如图所示是绿色电源“二甲醚( )燃料电池”的工作原理示意图(a、b均为多孔性
)燃料电池”的工作原理示意图(a、b均为多孔性 电极)。负极是
电极)。负极是______ (填写“a”或“b”),该电极的电极反应式是______ ,若有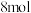 氢离子通过质子交换膜,则b电极在标准状况下吸收
氢离子通过质子交换膜,则b电极在标准状况下吸收______  氧气。
氧气。
 催化加氢制二甲醚,可以实现
催化加氢制二甲醚,可以实现 的再利用,涉及以下主要反应:
的再利用,涉及以下主要反应:I.


Ⅱ.


相关物质及能量变化的示意图如图1所示。
(1)反应Ⅱ的

 ,该反应在
,该反应在(2)恒压条件下,
 、
、 起始量相等时,
起始量相等时, 的平衡转化率和
的平衡转化率和 的选择性随温度变化如图2所示。已知:
的选择性随温度变化如图2所示。已知: 的选择性
的选择性
 时,通入
时,通入 、
、 各
各 ,平衡时
,平衡时 的选择性、
的选择性、 的平衡转化率都为
的平衡转化率都为 ,平衡时生成
,平衡时生成 的物质的量为
的物质的量为 ,此温度下反应I的平衡常数
,此温度下反应I的平衡常数
②
 区间,
区间, 平衡转化率随温度变化的曲线如图2所示,分析曲线变化的原因:
平衡转化率随温度变化的曲线如图2所示,分析曲线变化的原因:(3)如图所示是绿色电源“二甲醚(
 )燃料电池”的工作原理示意图(a、b均为多孔性
)燃料电池”的工作原理示意图(a、b均为多孔性 电极)。负极是
电极)。负极是 氢离子通过质子交换膜,则b电极在标准状况下吸收
氢离子通过质子交换膜,则b电极在标准状况下吸收 氧气。
氧气。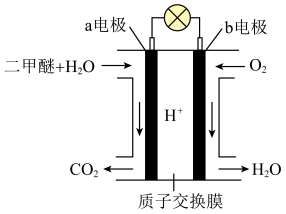
您最近一年使用:0次
2024-02-27更新
|
451次组卷
|
3卷引用:宁夏石嘴山市第三中学2024届高三第一次模拟考试理综-化学试题
宁夏石嘴山市第三中学2024届高三第一次模拟考试理综-化学试题2024届吉林省延边州高三教学质量检测(一模)化学试题(已下线)大题04 化学反应原理综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)