解题方法
1 . 过渡金属( 等)在工业生产中有重要的作用,是化学工作者研究的对象。
等)在工业生产中有重要的作用,是化学工作者研究的对象。
(1)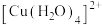 的结构示意图如图-1所示。
的结构示意图如图-1所示。

①基态 的核外电子排布式为
的核外电子排布式为___________ 。
②图中 与
与 之间形成的化学键称为
之间形成的化学键称为___________ 。
③ 能与
能与 结合成
结合成 ,
, 中的键角
中的键角_______  中的键角(填“>”、“<”或“=”)
中的键角(填“>”、“<”或“=”)
(2)锰元素能形成很多重要的化合物。
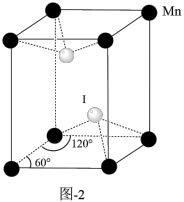
①锰与碘形成的某种化合物的晶胞结构如图-2所示,该化合物的化学式为___________ 。
② 能形成配合物
能形成配合物 ,其配离子的结构如图-3所示(配体位于顶点)。若
,其配离子的结构如图-3所示(配体位于顶点)。若 该配合物与足量
该配合物与足量 反应生成
反应生成 沉淀,则化学式中的n为
沉淀,则化学式中的n为___________ 。

③三醋酸锰由硝酸锰晶体和乙酸酐反应制得。乙酸酐[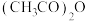 ]可由
]可由 在一定条件下脱水形成,其结构如图-4所示,
在一定条件下脱水形成,其结构如图-4所示, 乙酸酐中所含的
乙酸酐中所含的 键数目为
键数目为___________ 。已知羧酸是一大类含羧基( )的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释
)的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释 的酸性大于
的酸性大于 的原因:
的原因:___________ 。

 等)在工业生产中有重要的作用,是化学工作者研究的对象。
等)在工业生产中有重要的作用,是化学工作者研究的对象。(1)
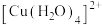 的结构示意图如图-1所示。
的结构示意图如图-1所示。
①基态
 的核外电子排布式为
的核外电子排布式为②图中
 与
与 之间形成的化学键称为
之间形成的化学键称为③
 能与
能与 结合成
结合成 ,
, 中的键角
中的键角 中的键角(填“>”、“<”或“=”)
中的键角(填“>”、“<”或“=”)(2)锰元素能形成很多重要的化合物。
①锰与碘形成的某种化合物的晶胞结构如图-2所示,该化合物的化学式为

②
 能形成配合物
能形成配合物 ,其配离子的结构如图-3所示(配体位于顶点)。若
,其配离子的结构如图-3所示(配体位于顶点)。若 该配合物与足量
该配合物与足量 反应生成
反应生成 沉淀,则化学式中的n为
沉淀,则化学式中的n为
③三醋酸锰由硝酸锰晶体和乙酸酐反应制得。乙酸酐[
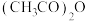 ]可由
]可由 在一定条件下脱水形成,其结构如图-4所示,
在一定条件下脱水形成,其结构如图-4所示, 乙酸酐中所含的
乙酸酐中所含的 键数目为
键数目为 )的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释
)的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释 的酸性大于
的酸性大于 的原因:
的原因:
您最近一年使用:0次
名校
解题方法
2 . 铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)Cu在周期表中位于___________ 区,Cu2+价电子排布式为___________ 。
(2)邻氨基吡啶(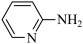 )的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为
)的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为___________ ;1mol 中σ键的数目为
中σ键的数目为___________ 。邻氨基吡啶的铜配合物结构简式如下图所示,C原子轨道杂化类型为___________ 。
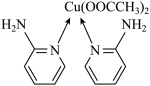
(3)向CuSO4溶液中加入过量氨水再加少许乙醇可以析出蓝色晶体[Cu(NH3)4]SO4∙H2O。
①NH3分子中H-N-H键角为107°,在[Cu(NH3)4]2+中H-N-H键角近似109.5°,键角变大的原因是___________ 。
②NF3与NH3均为三角锥形分子,NF3分子中的氮原子不易与Cu2+形成配离子,请从电负性角度分析其原因是___________ 。
(1)Cu在周期表中位于
(2)邻氨基吡啶(
 )的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为
)的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为 中σ键的数目为
中σ键的数目为
(3)向CuSO4溶液中加入过量氨水再加少许乙醇可以析出蓝色晶体[Cu(NH3)4]SO4∙H2O。
①NH3分子中H-N-H键角为107°,在[Cu(NH3)4]2+中H-N-H键角近似109.5°,键角变大的原因是
②NF3与NH3均为三角锥形分子,NF3分子中的氮原子不易与Cu2+形成配离子,请从电负性角度分析其原因是
您最近一年使用:0次
2023-07-05更新
|
192次组卷
|
2卷引用:江苏省泰州中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
3 . N、P、Sb原子的最外层电子数都是5,与卤素原子形成的化合物有广泛用途。 是液晶显示器生产过程中常用的化学清洗剂,
是液晶显示器生产过程中常用的化学清洗剂, 可用于面粉的漂白和杀菌,
可用于面粉的漂白和杀菌, 广泛应用于农药、杀虫剂的制造,
广泛应用于农药、杀虫剂的制造, 常用于有机反应催化剂。
常用于有机反应催化剂。
(1)几种化学键的键能如下表所示:
由两种单质化合形成1mol  ,焓变
,焓变
___________  。
。
(2)已知: 常温常压下为无色气体,熔点-129℃,沸点-207℃;
常温常压下为无色气体,熔点-129℃,沸点-207℃; 为黄色油状液体,熔点-40℃,沸点70℃,95℃以上易爆炸。根据物质结构知识和题中信息解释以下问题:
为黄色油状液体,熔点-40℃,沸点70℃,95℃以上易爆炸。根据物质结构知识和题中信息解释以下问题:
① 热稳定性高于
热稳定性高于 :
:___________ 。
② 熔、沸点高于
熔、沸点高于 :
:___________ 。
(3) 在水中溶解度不大,而
在水中溶解度不大,而 在水中溶解度较大,由此判断是
在水中溶解度较大,由此判断是
___________ 分子, 是
是___________ 分子。(填“极性”或“非极性”)
 是液晶显示器生产过程中常用的化学清洗剂,
是液晶显示器生产过程中常用的化学清洗剂, 可用于面粉的漂白和杀菌,
可用于面粉的漂白和杀菌, 广泛应用于农药、杀虫剂的制造,
广泛应用于农药、杀虫剂的制造, 常用于有机反应催化剂。
常用于有机反应催化剂。(1)几种化学键的键能如下表所示:
| 化学键 |  |  |  |
键能/ | 941.6 | 154.8 | 283.0 |
 ,焓变
,焓变
 。
。(2)已知:
 常温常压下为无色气体,熔点-129℃,沸点-207℃;
常温常压下为无色气体,熔点-129℃,沸点-207℃; 为黄色油状液体,熔点-40℃,沸点70℃,95℃以上易爆炸。根据物质结构知识和题中信息解释以下问题:
为黄色油状液体,熔点-40℃,沸点70℃,95℃以上易爆炸。根据物质结构知识和题中信息解释以下问题:①
 热稳定性高于
热稳定性高于 :
:②
 熔、沸点高于
熔、沸点高于 :
:(3)
 在水中溶解度不大,而
在水中溶解度不大,而 在水中溶解度较大,由此判断是
在水中溶解度较大,由此判断是
 是
是
您最近一年使用:0次
2023-06-20更新
|
226次组卷
|
3卷引用:上海交通大学附属中学2022-2023学年高一下学期期末考试(等级考)化学试题
上海交通大学附属中学2022-2023学年高一下学期期末考试(等级考)化学试题上海交通大学附属中学2022-2023学年高一下学期期末考试(等级考)化学试题(已下线)专题02 反应热的测量和计算-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)



