1 . 按下列要求填空
(1)Cr原子的核外电子排布式______ 。
(2) 外围电子的轨道表示式
外围电子的轨道表示式______ 。
(3)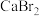 电子式
电子式______ 。 分子中所有原子均满足8电子构型,则其结构式为
分子中所有原子均满足8电子构型,则其结构式为______ 。
(4) 分子的空间结构为
分子的空间结构为______ 。
(5)如图所示为Zn的四种卤化物的熔点,据此判断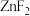 的晶体类型为
的晶体类型为______ , 微粒间的作用力为
微粒间的作用力为______ 。
(1)Cr原子的核外电子排布式
(2)
 外围电子的轨道表示式
外围电子的轨道表示式(3)
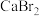 电子式
电子式 分子中所有原子均满足8电子构型,则其结构式为
分子中所有原子均满足8电子构型,则其结构式为(4)
 分子的空间结构为
分子的空间结构为(5)如图所示为Zn的四种卤化物的熔点,据此判断
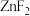 的晶体类型为
的晶体类型为 微粒间的作用力为
微粒间的作用力为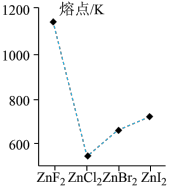
您最近一年使用:0次
解题方法
2 . 非金属元素及其化合物广泛应用于生产、生活、国防等多个领域。请回答下列问题:
(1) 的VSEPR模型名称为
的VSEPR模型名称为___________ ,分子的空间结构名称为___________ ,中心原子有___________ 个杂化轨道;
(2)氮可形成多种氧化物, 和
和 (直线形分子)的中心原子均为N原子,但二者中心原子的杂化方式不同,二者均存在大
(直线形分子)的中心原子均为N原子,但二者中心原子的杂化方式不同,二者均存在大 键(
键( 中,3为形成大
中,3为形成大 键的原子数,4为大
键的原子数,4为大 键中的共用电子个数),
键中的共用电子个数), 中中心氮原子的轨道杂化方式为:
中中心氮原子的轨道杂化方式为:___________ ; 中的
中的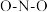 键角
键角___________ (填“ ”“
”“ ”或“
”或“ ”)
”) 中的
中的 键角。
键角。
(3) 的简单平面结构如图。
的简单平面结构如图。___________ 。
②在该晶体中存在的化学键类型有___________ (填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.氢键 e.配位键
③水分子①中的键角___________ (填“ ”“
”“ ”或“
”或“ ”)
”) ,原因是
,原因是___________ 。
(1)
 的VSEPR模型名称为
的VSEPR模型名称为(2)氮可形成多种氧化物,
 和
和 (直线形分子)的中心原子均为N原子,但二者中心原子的杂化方式不同,二者均存在大
(直线形分子)的中心原子均为N原子,但二者中心原子的杂化方式不同,二者均存在大 键(
键( 中,3为形成大
中,3为形成大 键的原子数,4为大
键的原子数,4为大 键中的共用电子个数),
键中的共用电子个数), 中中心氮原子的轨道杂化方式为:
中中心氮原子的轨道杂化方式为: 中的
中的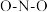 键角
键角 ”“
”“ ”或“
”或“ ”)
”) 中的
中的 键角。
键角。(3)
 的简单平面结构如图。
的简单平面结构如图。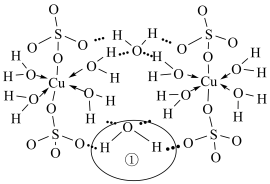
②在该晶体中存在的化学键类型有
a.离子键 b.极性共价键 c.非极性共价键 d.氢键 e.配位键
③水分子①中的键角
 ”“
”“ ”或“
”或“ ”)
”) ,原因是
,原因是
您最近一年使用:0次
名校
解题方法
3 . 按要求回答下列问题:
(1)A.乙烷 B.乙烯 C.乙炔 D.苯是有机化学中的代表物质,其中:
①既有 键又有
键又有 键的是
键的是_______ (填序号,下同)。
②碳碳键的键长由大到小排序是:_______ 。
③上述分子中所有原子均在同一平面是:_______ 。
(2)含硫元素的微粒有很多,例如 、
、 、
、 、
、 、
、 ,其中
,其中 的分子结构如下图所示,像一顶皇冠,请回答下列问题:
的分子结构如下图所示,像一顶皇冠,请回答下列问题: 中含有的
中含有的 键数目是
键数目是_______ 。
② 中S原子的杂化轨道类型是
中S原子的杂化轨道类型是_______ , 的空间结构是
的空间结构是_______ 。
③ 分子的VSEPR模型是
分子的VSEPR模型是_______ , 是
是_______ (填“极性”或“非极性”)分子。
④沸点:
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是_______ 。
(1)A.乙烷 B.乙烯 C.乙炔 D.苯是有机化学中的代表物质,其中:
①既有
 键又有
键又有 键的是
键的是②碳碳键的键长由大到小排序是:
③上述分子中所有原子均在同一平面是:
(2)含硫元素的微粒有很多,例如
 、
、 、
、 、
、 、
、 ,其中
,其中 的分子结构如下图所示,像一顶皇冠,请回答下列问题:
的分子结构如下图所示,像一顶皇冠,请回答下列问题: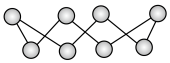
 中含有的
中含有的 键数目是
键数目是②
 中S原子的杂化轨道类型是
中S原子的杂化轨道类型是 的空间结构是
的空间结构是③
 分子的VSEPR模型是
分子的VSEPR模型是 是
是④沸点:

 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是
您最近一年使用:0次
名校
4 . 甲乙酮肟(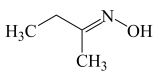 )中同周期三种元素电负性由大到小的顺序为
)中同周期三种元素电负性由大到小的顺序为
您最近一年使用:0次
名校
解题方法
5 .  与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为_______ ,其空间构型为_______ 。
 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为
您最近一年使用:0次
名校
解题方法
6 . 常温常压下,1体积水只能溶解约1体积 ,却能溶解约40体积
,却能溶解约40体积 ,请从价层电子对的角度入手进行解释
,请从价层电子对的角度入手进行解释___________ 。
 ,却能溶解约40体积
,却能溶解约40体积 ,请从价层电子对的角度入手进行解释
,请从价层电子对的角度入手进行解释
您最近一年使用:0次
解题方法
7 . 完成下列问题
(1)水分子中的共价键,依据原子轨道重叠的方式判断,属于___________ 键,水分子的VSEPR模型名称是___________ 。
(2)由铁原子形成的四种微粒,价层电子轨道表示式分别为①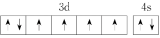 、②
、②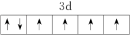 、③
、③ 、④
、④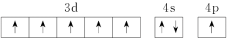 ,有关这些微粒的叙述不正确的是
,有关这些微粒的叙述不正确的是___________ (填字母)。
A.微粒半径:④>①>②
B.电离一个电子所需最低能量:②>①>④
C.微粒③价层电子在简并轨道中单独分占且自旋相同,故不能再继续失电子
(3)用“>”或“<”填空:
①沸点:邻羟基苯甲酸___________ 对羟基苯甲酸。
②pKa:CF3COOH___________ CH3COOH。
(4)填写下列物质所含官能团的名称
①CH3C≡CCH3___________ ;___________ 。
(5)下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是___________。
(6)某烃的蒸气对H2的相对密度为21,该烃中碳元素的质量分数为85.7%,则该烃的分子式为___________ ,可能的结构简式为___________ 、___________ 。
(1)水分子中的共价键,依据原子轨道重叠的方式判断,属于
(2)由铁原子形成的四种微粒,价层电子轨道表示式分别为①
 、②
、② 、③
、③ 、④
、④ ,有关这些微粒的叙述不正确的是
,有关这些微粒的叙述不正确的是A.微粒半径:④>①>②
B.电离一个电子所需最低能量:②>①>④
C.微粒③价层电子在简并轨道中单独分占且自旋相同,故不能再继续失电子
(3)用“>”或“<”填空:
①沸点:邻羟基苯甲酸
②pKa:CF3COOH
(4)填写下列物质所含官能团的名称
①CH3C≡CCH3
②
(5)下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是___________。
| A.(CH3)2CHCH(CH3)2 | B.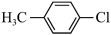 |
C.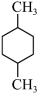 | D.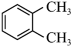 |
您最近一年使用:0次
名校
解题方法
8 . 按要求回答下列问题:
(1)基态 原子中,核外电子排布式为
原子中,核外电子排布式为________ ,核外电子占据的最高能层电子的电子云轮廓图形状为_______ ,它在周期表中的位置为_______ ,与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有____ 种。
(2) 与
与 形成
形成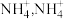 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是______ , 中
中 键角
键角__  中
中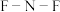 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。
(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为_______ (填序号);比较① ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为________ (填序号);比较①晶体硅 ②晶体锗 ③ ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为_______ (填序号)。
(4)在周期表中,与 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是______ ,该元素的最高正价氧化物对应的水化物与氢氧化钠反应的离子方程式为______ 。
(5) 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而 失去
失去 可得
可得 。
。
① 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是______ 。
② 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是_______ 。
(1)基态
 原子中,核外电子排布式为
原子中,核外电子排布式为(2)
 与
与 形成
形成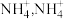 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是 中
中 键角
键角 中
中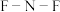 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为
 ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为 ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为(4)在周期表中,与
 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是(5)
 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而 失去
失去 可得
可得 。
。①
 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是②
 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是
您最近一年使用:0次
名校
解题方法
9 . 物质的结构影响物质的性质。请回答下列问题。
(1)P4S3可用于制造火柴,其分子结构如图所示。电负性:硫___________ 磷(填“>”“<”或“=”),P4S3分子中硫原子的杂化轨道类型为___________ 。1molP4S3分子中孤电子对的数目为___________ ,∠S—P—S___________ 109°28'(填“>”“<”或“=”)。

(2)化合物Cl2O的空间结构为___________ ,中心原子的价层电子对数为___________ 。
(3) 、
、 分子的空间结构和相应的键角如图甲所示。
分子的空间结构和相应的键角如图甲所示。___________ ,原因是___________ 。H2O的键角小于NH3的,分析原因:___________ 。
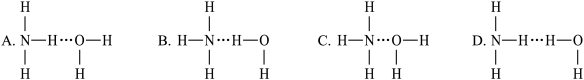
(4)氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为___________ 。(填序号)
(1)P4S3可用于制造火柴,其分子结构如图所示。电负性:硫

(2)化合物Cl2O的空间结构为
(3)
 、
、 分子的空间结构和相应的键角如图甲所示。
分子的空间结构和相应的键角如图甲所示。
(4)氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为
您最近一年使用:0次
2024-04-29更新
|
106次组卷
|
2卷引用:黑龙江省哈尔滨市第三十二中学校2023-2024学年高二下学期4月期中考试化学试题
名校
10 . 卤素单质及其化合物在工农业生产中有着广泛的应用。回答下列问题:
(1)类卤素 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):
①硫氰酸和异硫氰酸分子中 键和
键和 键个数之比
键个数之比___________ (填“相等”或“不相等”)。
②异硫氰酸中N的杂化轨道类型是___________ 。
③硫氰酸的电子式为___________ 。
(2) 的VSEPR模型是
的VSEPR模型是___________ , 的中心原子的价层电子对数是
的中心原子的价层电子对数是___________ 。
(3)键角:
___________ (填“>”“<”或“=”) ,判断的理由为
,判断的理由为___________ 。
(4)酸性:三氟乙酸( )
)___________ (填“>”或“<”) ,判断的理由为
,判断的理由为___________ 。
(5) 与水反应的化学方程式为
与水反应的化学方程式为___________ (该反应为非氧化还原反应)。
(1)类卤素
 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):①硫氰酸和异硫氰酸分子中
 键和
键和 键个数之比
键个数之比②异硫氰酸中N的杂化轨道类型是
③硫氰酸的电子式为
(2)
 的VSEPR模型是
的VSEPR模型是 的中心原子的价层电子对数是
的中心原子的价层电子对数是(3)键角:

 ,判断的理由为
,判断的理由为(4)酸性:三氟乙酸(
 )
) ,判断的理由为
,判断的理由为(5)
 与水反应的化学方程式为
与水反应的化学方程式为
您最近一年使用:0次
2024-04-26更新
|
188次组卷
|
2卷引用:广西壮族自治区桂林市联考2023-2024学年高二下学期3月月考化学试题



