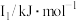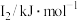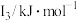解题方法
1 . 完成下列问题
(1)水分子中的共价键,依据原子轨道重叠的方式判断,属于___________ 键,水分子的VSEPR模型名称是___________ 。
(2)由铁原子形成的四种微粒,价层电子轨道表示式分别为①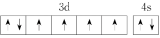 、②
、②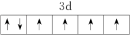 、③
、③ 、④
、④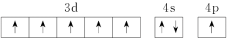 ,有关这些微粒的叙述不正确的是
,有关这些微粒的叙述不正确的是___________ (填字母)。
A.微粒半径:④>①>②
B.电离一个电子所需最低能量:②>①>④
C.微粒③价层电子在简并轨道中单独分占且自旋相同,故不能再继续失电子
(3)用“>”或“<”填空:
①沸点:邻羟基苯甲酸___________ 对羟基苯甲酸。
②pKa:CF3COOH___________ CH3COOH。
(4)填写下列物质所含官能团的名称
①CH3C≡CCH3___________ ;___________ 。
(5)下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是___________。
(6)某烃的蒸气对H2的相对密度为21,该烃中碳元素的质量分数为85.7%,则该烃的分子式为___________ ,可能的结构简式为___________ 、___________ 。
(1)水分子中的共价键,依据原子轨道重叠的方式判断,属于
(2)由铁原子形成的四种微粒,价层电子轨道表示式分别为①
 、②
、② 、③
、③ 、④
、④ ,有关这些微粒的叙述不正确的是
,有关这些微粒的叙述不正确的是A.微粒半径:④>①>②
B.电离一个电子所需最低能量:②>①>④
C.微粒③价层电子在简并轨道中单独分占且自旋相同,故不能再继续失电子
(3)用“>”或“<”填空:
①沸点:邻羟基苯甲酸
②pKa:CF3COOH
(4)填写下列物质所含官能团的名称
①CH3C≡CCH3
②
(5)下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是___________。
| A.(CH3)2CHCH(CH3)2 | B.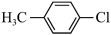 |
C.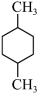 | D.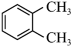 |
您最近半年使用:0次
名校
解题方法
2 . 按要求完成下列问题:
(1)写出CCl4中心原子成键时采取的杂化轨道类型及分子中共价键的键角:___________ 、___________ 。
(2)气态 分子的空间构型为
分子的空间构型为___________ , 离子的空间构型为
离子的空间构型为___________ ;
(3)写出基态铁原子的简化电子排布式和Mg2+的核外电子排布式:___________ 、___________ 。
(1)写出CCl4中心原子成键时采取的杂化轨道类型及分子中共价键的键角:
(2)气态
 分子的空间构型为
分子的空间构型为 离子的空间构型为
离子的空间构型为(3)写出基态铁原子的简化电子排布式和Mg2+的核外电子排布式:
您最近半年使用:0次
解题方法
3 . 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为原料,经过一系列反应可以得到 和
和 ,流程如图所示。请回答下列问题:
,流程如图所示。请回答下列问题: 分子为
分子为__________ (填“极性”或“非极性”)分子,该分子中F—B—F键角是______ 。
(2) 和过量NaF作用可生成
和过量NaF作用可生成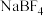 ,
, 的空间结构为
的空间结构为_________ ,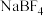 中
中______ (填“含有”或“不含”)配位键。
(3)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为_________ ,层间作用力为________ 。
 和
和 ,流程如图所示。请回答下列问题:
,流程如图所示。请回答下列问题:
 分子为
分子为(2)
 和过量NaF作用可生成
和过量NaF作用可生成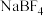 ,
, 的空间结构为
的空间结构为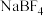 中
中(3)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
您最近半年使用:0次
名校
解题方法
4 . 按要求回答下列问题:
(1)基态 原子中,核外电子排布式为
原子中,核外电子排布式为________ ,核外电子占据的最高能层电子的电子云轮廓图形状为_______ ,它在周期表中的位置为_______ ,与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有____ 种。
(2) 与
与 形成
形成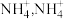 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是______ , 中
中 键角
键角__  中
中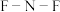 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。
(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为_______ (填序号);比较① ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为________ (填序号);比较①晶体硅 ②晶体锗 ③ ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为_______ (填序号)。
(4)在周期表中,与 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是______ ,该元素的最高正价氧化物对应的水化物与氢氧化钠反应的离子方程式为______ 。
(5) 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而 失去
失去 可得
可得 。
。
① 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是______ 。
② 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是_______ 。
(1)基态
 原子中,核外电子排布式为
原子中,核外电子排布式为(2)
 与
与 形成
形成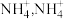 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是 中
中 键角
键角 中
中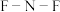 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为
 ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为 ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为(4)在周期表中,与
 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是(5)
 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而 失去
失去 可得
可得 。
。①
 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是②
 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是
您最近半年使用:0次
解题方法
5 . 回答下列问题。
(1)计算下列分子中中心原子的孤电子对数:
①H2S ___________ ;②P Cl5___________ ;③B F3___________ ;④N H3___________ 。
(2)计算下列分子中中心原子的价层电子对数:
①CCl4___________ ;②BeCl2___________ ;③BCl3___________ ;④PCl3___________ 。
(1)计算下列分子中中心原子的孤电子对数:
①H2
(2)计算下列分子中中心原子的价层电子对数:
①CCl4
您最近半年使用:0次
名校
6 . 硼的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态硼原子的电子排布式为:___________ 。
(2) 和过量NaF作用可生成
和过量NaF作用可生成 ,
, 的空间结构为
的空间结构为___________ ; 的电子式为
的电子式为___________ 。
(3)正硼酸( )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键相连(如图)。下列有关说法正确的有___________。
分子通过氢键相连(如图)。下列有关说法正确的有___________。
(4)已知硼酸为一元弱酸,写出硼酸的电离方程式___________ 。
(5)硼砂是含结晶水的四硼酸钠。硼砂中阴离子 (含B、O、H三种元素)的球棍模型如图所示,则在
(含B、O、H三种元素)的球棍模型如图所示,则在 中,2号硼原子的杂化类型为
中,2号硼原子的杂化类型为___________ ;4号硼原子参与形成的化学键有___________ (填选项)。
m=___________ (填数字)。
(1)基态硼原子的电子排布式为:
(2)
 和过量NaF作用可生成
和过量NaF作用可生成 ,
, 的空间结构为
的空间结构为 的电子式为
的电子式为(3)正硼酸(
 )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键相连(如图)。下列有关说法正确的有___________。
分子通过氢键相连(如图)。下列有关说法正确的有___________。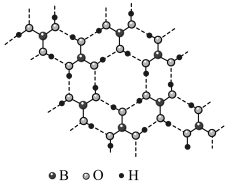
| A.正硼酸晶体属于共价晶体 | B.分子中硼原子最外层为8电子稳定结构 |
C. 分子的稳定性与氢键有关 分子的稳定性与氢键有关 | D.1mol  晶体中平均含3mol氢键 晶体中平均含3mol氢键 |
(4)已知硼酸为一元弱酸,写出硼酸的电离方程式
(5)硼砂是含结晶水的四硼酸钠。硼砂中阴离子
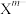 (含B、O、H三种元素)的球棍模型如图所示,则在
(含B、O、H三种元素)的球棍模型如图所示,则在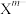 中,2号硼原子的杂化类型为
中,2号硼原子的杂化类型为 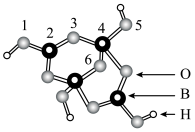
m=
您最近半年使用:0次
解题方法
7 . I.铁(26Fe)、镍(28Ni)的单质及其化合物在医药、材料等领域有广泛的应用。回答下列问题:
(1)基态Fe原子价电子排布图为_______ ,Ni位于元素周期表的_______ 区。
(2)乳酸亚铁口服液是缺铁人群补铁保健品,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度分析,Fe2+易被氧化成Fe3+的原因是_______ 。
II.回答下列问题:
(3)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_______ ,中心原子的杂化方式为_______ ,COCl2中心原子的VSEPR模型为_______ ,COCl2分子的空间构型为_______ 。
(4)AlH 中,Al原子的轨道杂化方式为
中,Al原子的轨道杂化方式为_______ ;列举与AlH 空间构型相同的一种离子和一种分子:
空间构型相同的一种离子和一种分子:_______ 、_______ (填化学式)。
(5)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为_______ ,SnBr2分子中Br-Sn-Br的键角_______ 120°(填“>”“<”或“=”)。
(1)基态Fe原子价电子排布图为
(2)乳酸亚铁口服液是缺铁人群补铁保健品,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度分析,Fe2+易被氧化成Fe3+的原因是
II.回答下列问题:
(3)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(4)AlH
 中,Al原子的轨道杂化方式为
中,Al原子的轨道杂化方式为 空间构型相同的一种离子和一种分子:
空间构型相同的一种离子和一种分子:(5)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为
您最近半年使用:0次
解题方法
8 . 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根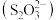 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物。
原子取代的产物。
(1)基态 原子价层电子排布式是
原子价层电子排布式是___________ 。
(2)比较 原子和O原子的第一电离能大小,从原子结构的角度说明理由:
原子和O原子的第一电离能大小,从原子结构的角度说明理由:___________ 。
(3) 的空间结构是
的空间结构是___________ 。
(4)同位素示踪实验可证实 中两个
中两个 原子的化学环境不同,实验过程为
原子的化学环境不同,实验过程为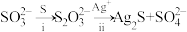 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
断裂的只有硫硫键,若过程ⅰ所用试剂是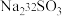 和
和 ,过程ⅱ含硫产物是
,过程ⅱ含硫产物是___________ 。
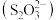 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物。
原子取代的产物。(1)基态
 原子价层电子排布式是
原子价层电子排布式是(2)比较
 原子和O原子的第一电离能大小,从原子结构的角度说明理由:
原子和O原子的第一电离能大小,从原子结构的角度说明理由:(3)
 的空间结构是
的空间结构是(4)同位素示踪实验可证实
 中两个
中两个 原子的化学环境不同,实验过程为
原子的化学环境不同,实验过程为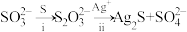 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
断裂的只有硫硫键,若过程ⅰ所用试剂是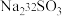 和
和 ,过程ⅱ含硫产物是
,过程ⅱ含硫产物是
您最近半年使用:0次
9 . 按要求回答下列问题:
(1)酸溶于水可形成 ,
, 的电子式为
的电子式为________ 。判断 和
和 的键角大小:
的键角大小:
________  (填“>”或“<”)。
(填“>”或“<”)。
(2)氨硼烷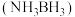 是一种特殊的化合物,分子中与N原子相连的H呈正电性
是一种特殊的化合物,分子中与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。则氨硼烷分子中元素电负性由小到大的顺序为
。则氨硼烷分子中元素电负性由小到大的顺序为________ (填元素符号)
(3)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是________ 。
(4)丁二酮肟(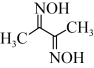 )可与
)可与 反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定
反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定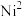 的存在。
的存在。
①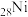 的价电子轨道表示式为
的价电子轨道表示式为________ 。
②丁二酮肟分子中 键和
键和 键数目的比例为
键数目的比例为________ 。
(5)在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是________ 。
(1)酸溶于水可形成
 ,
, 的电子式为
的电子式为 和
和 的键角大小:
的键角大小:
 (填“>”或“<”)。
(填“>”或“<”)。(2)氨硼烷
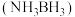 是一种特殊的化合物,分子中与N原子相连的H呈正电性
是一种特殊的化合物,分子中与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。则氨硼烷分子中元素电负性由小到大的顺序为
。则氨硼烷分子中元素电负性由小到大的顺序为(3)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是
元素 |
|
|
|
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
(4)丁二酮肟(
 )可与
)可与 反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定
反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定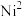 的存在。
的存在。①
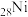 的价电子轨道表示式为
的价电子轨道表示式为②丁二酮肟分子中
 键和
键和 键数目的比例为
键数目的比例为(5)在空气中FeO稳定性小于
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是
您最近半年使用:0次
名校
解题方法
10 . 物质的结构影响物质的性质。请回答下列问题。
(1)P4S3可用于制造火柴,其分子结构如图所示。电负性:硫___________ 磷(填“>”“<”或“=”),P4S3分子中硫原子的杂化轨道类型为___________ 。1molP4S3分子中孤电子对的数目为___________ ,∠S—P—S___________ 109°28'(填“>”“<”或“=”)。

(2)化合物Cl2O的空间结构为___________ ,中心原子的价层电子对数为___________ 。
(3) 、
、 分子的空间结构和相应的键角如图甲所示。
分子的空间结构和相应的键角如图甲所示。___________ ,原因是___________ 。H2O的键角小于NH3的,分析原因:___________ 。
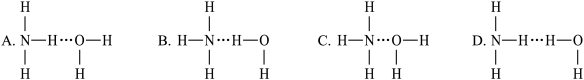
(4)氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为___________ 。(填序号)
(1)P4S3可用于制造火柴,其分子结构如图所示。电负性:硫

(2)化合物Cl2O的空间结构为
(3)
 、
、 分子的空间结构和相应的键角如图甲所示。
分子的空间结构和相应的键角如图甲所示。
(4)氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为
您最近半年使用:0次
2024-04-29更新
|
92次组卷
|
2卷引用:黑龙江省哈尔滨市第三十二中学校2023-2024学年高二下学期4月期中考试化学试题