名校
解题方法
1 . 现有下列分子或离子:①CS2②H2S③PH3④HCHO⑤H3O+⑥NH ⑦BF3⑧SO2
⑦BF3⑧SO2
(1)粒子的几何构型为直线形的有____ (填序号,下同)。
(2)粒子的几何构型为V形的有____ 。
(3)粒子的几何构型为平面三角形的有____ 。
(4)粒子的几何构型为三角锥型的有____ 。
(5)粒子的几何构型为正四面体型的有___ 。
 ⑦BF3⑧SO2
⑦BF3⑧SO2(1)粒子的几何构型为直线形的有
(2)粒子的几何构型为V形的有
(3)粒子的几何构型为平面三角形的有
(4)粒子的几何构型为三角锥型的有
(5)粒子的几何构型为正四面体型的有
您最近一年使用:0次
名校
2 . X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色试验呈黄色,Q的最外层电子数与其电子总数之比为3∶8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1). Q元素在周期表中的位置为_______ 。
(2). 将这五种元素的原子半径从大到小排列,排在第三的元素是_______ (填元素符号)。
(3). 元素的非金属性Z_______ (填“>”或“<”)Q。下列各项中,不能说明这一结论的事实有_______ (填字母)。
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4). X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出阳离子B的空间构型为_______ ,该离子的中心原子的杂化方式为_______ ;X与Q在一定条件下可以形成极不稳定的原子个数比为1∶1的化合物,该化合物分子中既有极性键又有非极性键,写出该分子的结构式:_______ 。
(5). M和N均为上述五种元素中的三种组成的化合物,且M和N都为强电解质,M和N溶液反应既有沉淀出现又有气体产生,写出M和N反应的化学方程式:_______ 。
(1). Q元素在周期表中的位置为
(2). 将这五种元素的原子半径从大到小排列,排在第三的元素是
(3). 元素的非金属性Z
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4). X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出阳离子B的空间构型为
(5). M和N均为上述五种元素中的三种组成的化合物,且M和N都为强电解质,M和N溶液反应既有沉淀出现又有气体产生,写出M和N反应的化学方程式:
您最近一年使用:0次
解题方法
3 . (1) CH3COO[Cu(NH3)2]中C原子轨道的杂化类型是____ 。与NH3分子互为等电子体的阴离子为____ 。
(2) 乳酸分子(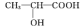 )中C原子的杂化类型为
)中C原子的杂化类型为____ 。与 互为等电子体的一种分子化学式为
互为等电子体的一种分子化学式为_____ 。
(3) 的空间构型为
的空间构型为________ (用文字描述);NaNT可由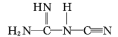 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________ 。
(4)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是____ ;与SiF4互为等电子体的阴离子的化学式为_______ 。
(5) 中N原子轨道的杂化类型是
中N原子轨道的杂化类型是___ 。与 互为等电子体的一种分子为
互为等电子体的一种分子为__ (填化学式)。
(6)苯甲醇(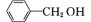 )中碳原子的杂化轨道类型为
)中碳原子的杂化轨道类型为______ 。与 互为等电子体的阳离子为
互为等电子体的阳离子为______ (填化学式), 离子的空间构型为(用文字描述)
离子的空间构型为(用文字描述)________ 。
(2) 乳酸分子(
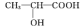 )中C原子的杂化类型为
)中C原子的杂化类型为 互为等电子体的一种分子化学式为
互为等电子体的一种分子化学式为(3)
 的空间构型为
的空间构型为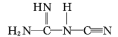 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为(4)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是
(5)
 中N原子轨道的杂化类型是
中N原子轨道的杂化类型是 互为等电子体的一种分子为
互为等电子体的一种分子为(6)苯甲醇(
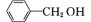 )中碳原子的杂化轨道类型为
)中碳原子的杂化轨道类型为 互为等电子体的阳离子为
互为等电子体的阳离子为 离子的空间构型为(用文字描述)
离子的空间构型为(用文字描述)
您最近一年使用:0次
名校
解题方法
4 . 现有下列分子或离子:
①CS2 ②H2S ③PCl3 ④CH2O ⑤H3O+ ⑥NH ⑦BF3 ⑧SO2
⑦BF3 ⑧SO2
(1)粒子的几何构型为直线形的有___ (填序号,下同)。
(2)粒子的几何构型为V形的有___ 。
(3)粒子的几何构型为平面三角形的有___ 。
(4)粒子的几何构型为三角锥型的有___ 。
(5)粒子的几何构型为正四面体型的有__ 。
①CS2 ②H2S ③PCl3 ④CH2O ⑤H3O+ ⑥NH
 ⑦BF3 ⑧SO2
⑦BF3 ⑧SO2(1)粒子的几何构型为直线形的有
(2)粒子的几何构型为V形的有
(3)粒子的几何构型为平面三角形的有
(4)粒子的几何构型为三角锥型的有
(5)粒子的几何构型为正四面体型的有
您最近一年使用:0次
解题方法
5 . (1)钒是人体必需的微量元素,对治疗糖尿病和癌症及保护心血管等具有潜在的药理学作用。工业上用含三价钒(V2O3)为主的某石煤(含有Al2O3、CaO等杂质)为原料,用钙化法焙烧制备V2O5,其流程如图:

已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
①焙烧:向石煤中加石灰石焙烧,将V2O3转化为Ca(VO3)2的化学方程式是:_______ 。酸浸:Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是_______ 。
②基态钒原子的核外电子排布式为[Ar]_______ 。
(2)镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
①硒常用作光敏材料,SeO3的空间构型是_______ 。
②根据元素周期律,原子半径Ga_______ As,第一电离能Ga_______ As。(填“大于”或“小于”)
③硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4、SiBr4,上述四种物质沸点由高到低顺序为_______ ,丁硅烯(Si4H8)中σ键与π键个数之比为_______ 。

已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO | VO | VO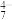 | VO |
①焙烧:向石煤中加石灰石焙烧,将V2O3转化为Ca(VO3)2的化学方程式是:
②基态钒原子的核外电子排布式为[Ar]
(2)镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
①硒常用作光敏材料,SeO3的空间构型是
②根据元素周期律,原子半径Ga
③硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4、SiBr4,上述四种物质沸点由高到低顺序为
您最近一年使用:0次
名校
6 . 二氧化氯(ClO2)是一种常用的饮用水消毒剂。
(1)ClO2分子中的键角约为120°。ClO2易溶于水的原因是___ 。ClO2得到一个电子后形成 ,
, 的空间构型是
的空间构型是___ 。
(2)某ClO2泡腾片的有效成分为NaClO2、NaHSO4、NaHCO3,其溶于水时反应可得到ClO2溶液,并逸出大量气体。NaClO2和NaHSO4反应生成ClO2和Cl-的离子方程式为___ ,逸出气体的主要成分是___ (填化学式)。
(3)ClO2消毒时会产生少量的ClO ,可利用FeSO4将ClO
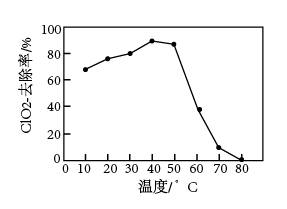
,可利用FeSO4将ClO 转化为Cl-除去。控制其他条件相同,
转化为Cl-除去。控制其他条件相同, 去除率随温度变化如图所示。温度高于50℃时,
去除率随温度变化如图所示。温度高于50℃时, 去除率降低的可能原因是
去除率降低的可能原因是___ 。
(4)测定某水样中 浓度的方法如下:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
浓度的方法如下:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:ClO +I-+H+—H2O+I2+Cl-(未配平)
+I-+H+—H2O+I2+Cl-(未配平)
I2+S2O —I-+S4O
—I-+S4O (未配平)
(未配平)
计算水样中ClO 的浓度(写出计算过程)
的浓度(写出计算过程)___ 。
(1)ClO2分子中的键角约为120°。ClO2易溶于水的原因是
 ,
, 的空间构型是
的空间构型是(2)某ClO2泡腾片的有效成分为NaClO2、NaHSO4、NaHCO3,其溶于水时反应可得到ClO2溶液,并逸出大量气体。NaClO2和NaHSO4反应生成ClO2和Cl-的离子方程式为
(3)ClO2消毒时会产生少量的ClO
 ,可利用FeSO4将ClO
,可利用FeSO4将ClO 转化为Cl-除去。控制其他条件相同,
转化为Cl-除去。控制其他条件相同, 去除率随温度变化如图所示。温度高于50℃时,
去除率随温度变化如图所示。温度高于50℃时, 去除率降低的可能原因是
去除率降低的可能原因是
(4)测定某水样中
 浓度的方法如下:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
浓度的方法如下:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:ClO
 +I-+H+—H2O+I2+Cl-(未配平)
+I-+H+—H2O+I2+Cl-(未配平)I2+S2O
 —I-+S4O
—I-+S4O (未配平)
(未配平)计算水样中ClO
 的浓度(写出计算过程)
的浓度(写出计算过程)
您最近一年使用:0次
2021-01-07更新
|
241次组卷
|
3卷引用:江苏扬州市2021届高三1月调研考试化学试题
名校
解题方法
7 . 臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为SO42-和NO3-,NOx也可在其他条件下被还原为N2。
(1)SO42-中心原子轨道的杂化类型为______ ;NO3-的空间构型为_____ (用文字描述)。
(2)Fe2+基态核外电子排布式为_______ 。
(3)与O3分子互为等电子体的一种阴离子为________ (填化学式)。
(4)(CN)2分子中σ键与π键的数目比n(σ)∶n(π)=________ 。
(1)SO42-中心原子轨道的杂化类型为
(2)Fe2+基态核外电子排布式为
(3)与O3分子互为等电子体的一种阴离子为
(4)(CN)2分子中σ键与π键的数目比n(σ)∶n(π)=
您最近一年使用:0次
8 . Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu₂O。
(1)Cu2+基态核外电子排布式为________ 。
(2)SO42-的空间构型为_______ (用文字描述)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为______ ;推测抗坏血酸在水中的溶解性:_______ (填“难溶于水”或“易溶于水”)。

(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为_________ 。
(1)Cu2+基态核外电子排布式为
(2)SO42-的空间构型为
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为

(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为
您最近一年使用:0次
9 . (1)关于下列分子的说法不正确的是________ 。

A.既有σ键又有π键
B.O—H键的极性强于C—H键的极性
C.是非极性分子
D.该物质的分子之间不能形成氢键,但它可以与水分子形成氢键
(2)下列说法正确的是________ 。
A.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
B.NH 和CH4的空间构型相似
和CH4的空间构型相似
C.BF3与 都是平面形分子
都是平面形分子
D.CO2和H2O都是直线形分子

A.既有σ键又有π键
B.O—H键的极性强于C—H键的极性
C.是非极性分子
D.该物质的分子之间不能形成氢键,但它可以与水分子形成氢键
(2)下列说法正确的是
A.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
B.NH
 和CH4的空间构型相似
和CH4的空间构型相似C.BF3与
 都是平面形分子
都是平面形分子D.CO2和H2O都是直线形分子
您最近一年使用:0次
10 . X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子的价电子排布式为ns1,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子。
③Z元素的电离能(用符号I表示)数据见表(kJ·mol-1)
请回答:
(1)Z2Y2中含有的化学键类型有__________ 和________ 。
(2)X2Y分子的空间构型为________ ,XWY的电子式________ ,XWY属于________ (填“极性”或“非极性”)分子。
(3)写出W原子的电子排布式________________ 。
①X元素原子的价电子排布式为ns1,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子。
③Z元素的电离能(用符号I表示)数据见表(kJ·mol-1)
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
请回答:
(1)Z2Y2中含有的化学键类型有
(2)X2Y分子的空间构型为
(3)写出W原子的电子排布式
您最近一年使用:0次



