解题方法
1 . 完成下列问题。
(1)已知氯与硫均有多种含氧微粒,S有:SO2、 、SO3、
、SO3、 ;Cl有:HClO、
;Cl有:HClO、 、
、 、
、 ,其中立体构型为V形的微粒有
,其中立体构型为V形的微粒有_______ ;为三角锥形的有_______ ;为平面正三角形的有_______ ;为正四面体形的有_______ 。
(2)①SiH4、PH3、H2S分子中H-Si-H、H-P-H、H-S-H的键角大小顺序为:_______ 。
②SnBr2分子中Br—Sn—Br的键角_______ 120°;
③PCl3分子中,Cl—P—Cl的键角_______ 109.5°。
④俗称光气的氯代甲酰氯分子(COCl2)形状为:_______ ,其分子中有两种键角:124.3°、111.4°,其中Cl—C—Cl的键角为_______ 。
(1)已知氯与硫均有多种含氧微粒,S有:SO2、
 、SO3、
、SO3、 ;Cl有:HClO、
;Cl有:HClO、 、
、 、
、 ,其中立体构型为V形的微粒有
,其中立体构型为V形的微粒有(2)①SiH4、PH3、H2S分子中H-Si-H、H-P-H、H-S-H的键角大小顺序为:
②SnBr2分子中Br—Sn—Br的键角
③PCl3分子中,Cl—P—Cl的键角
④俗称光气的氯代甲酰氯分子(COCl2)形状为:
您最近一年使用:0次
2023-11-22更新
|
421次组卷
|
2卷引用:江西省赣州市厚德外国语学校2023-2024学年高三上学期11月月考化学试卷
2 . 磷酸铁锂( )电极材料主要用于各种锂离子电池。回答下列问题。
)电极材料主要用于各种锂离子电池。回答下列问题。
(1)基态Fe原子的价层电子排布式为___________ ;
(2)下列Li原子轨道表示式表示的状态中,能量最高的为___________(填字母);
(3)基态P原子核外电子占据的最高能级的电子云轮廓图为___________ 形, 中P的杂化方式为
中P的杂化方式为___________ ;
(4) 中H-P-H键角
中H-P-H键角___________  中H-N-H键角(填“>”“<”或“=”),原因是
中H-N-H键角(填“>”“<”或“=”),原因是___________ 。
 )电极材料主要用于各种锂离子电池。回答下列问题。
)电极材料主要用于各种锂离子电池。回答下列问题。(1)基态Fe原子的价层电子排布式为
(2)下列Li原子轨道表示式表示的状态中,能量最高的为___________(填字母);
A. | B. |
C. | D.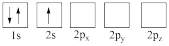 |
 中P的杂化方式为
中P的杂化方式为(4)
 中H-P-H键角
中H-P-H键角 中H-N-H键角(填“>”“<”或“=”),原因是
中H-N-H键角(填“>”“<”或“=”),原因是
您最近一年使用:0次
名校
3 . 磷、氮和硫的相关化合物在药物化学及农业化学领域应用广泛。回答下列问题:
(1) 分子空间结构为
分子空间结构为___________ , 与
与 反应生成
反应生成 ,
, 结构为
结构为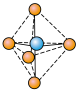 ,
, 是
是___________ (填“极性”或“非极性”)分子。
(2)氯吡苯脲是一种常用的膨大剂,其结构简式为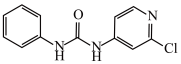 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。
①氯吡苯脲分子___________ (填“是”或“不是”)手性分子。
②氯吡苯脲分子中存在的作用力包括___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D. 键 E.配位键
键 E.配位键
(3)胆矾 可写成
可写成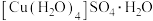 ,其结构示意图如下:
,其结构示意图如下:___________ 。
②已知 与
与 的空间结构相同,但
的空间结构相同,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是___________ 。
(1)
 分子空间结构为
分子空间结构为 与
与 反应生成
反应生成 ,
, 结构为
结构为 ,
, 是
是(2)氯吡苯脲是一种常用的膨大剂,其结构简式为
 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。①氯吡苯脲分子
②氯吡苯脲分子中存在的作用力包括
A.离子键 B.极性键 C.非极性键 D.
 键 E.配位键
键 E.配位键(3)胆矾
 可写成
可写成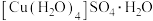 ,其结构示意图如下:
,其结构示意图如下: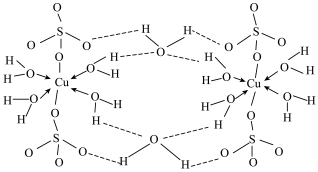
②已知
 与
与 的空间结构相同,但
的空间结构相同,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是
您最近一年使用:0次
2023-03-20更新
|
331次组卷
|
2卷引用:江西省南昌市第十九中学2022-2023学年高二下学期期中考试化学试卷
名校
4 . 硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)已知硼既能与酸又能与碱反应,化学性质类似于铝,请写出硼与氢氧化钠反应的化学方程式___ ;
(2)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构____________ (填“相同”或“不相同”)。
②B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为_______ L。
(3)已知H3BO3是一种白色片状晶体,微溶于水,它的的电离类似于Al(OH)3,可用于制备储氢材料NaBH4涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①H3BO3为____ (填“一元”、“二元”或“三元”)酸
②B(OCH3)3属于_____ (填序号)类。
A.烃 B.醇 C.酯 D.羧酸
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为__ 。
(1)已知硼既能与酸又能与碱反应,化学性质类似于铝,请写出硼与氢氧化钠反应的化学方程式
(2)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构
②B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为
(3)已知H3BO3是一种白色片状晶体,微溶于水,它的的电离类似于Al(OH)3,可用于制备储氢材料NaBH4涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①H3BO3为
②B(OCH3)3属于
A.烃 B.醇 C.酯 D.羧酸
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为
您最近一年使用:0次
5 . 2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家。有两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂为正极的磷酸铁锂电池。请回答下列问题:
(1)基态钴原子的价电子排布式为____ ,Mn位于元素周期表的____ 区(填“s”或“p”或“d”或“ds”或“f”)。
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是___ 。PO43-的空间构型是 ___ ,中心原子的杂化方式是 ____ 。
(3)CoO、MnO两种氧化物的熔点由高到低的顺序是___ ,原因是 ___ 。
(4)PH3是____ 分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是 _____
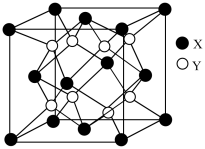
(5)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag.cm-3,则距离最近的两个S2-的距离是___ nm。(用含a、M、NA的计算式表示)
(1)基态钴原子的价电子排布式为
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是
(3)CoO、MnO两种氧化物的熔点由高到低的顺序是
(4)PH3是
(5)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag.cm-3,则距离最近的两个S2-的距离是

您最近一年使用:0次
2020-04-04更新
|
1922次组卷
|
5卷引用:江西省井冈山中学2020届高三四月检测理综化学试题
6 . 蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为________________ (用元素符号表示);
(2)N3-的立体构型是___________ 形:与N3-互为等电子体的一种分子是___________ (填分子式)。
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为___________ ;SO42-中的硫原子杂化方式为___________ ;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________ 。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成____ 体图形;与Te原子距离最近的Te原子有___ 个;若Zn与距离最近的Te原子间距为apm,则晶体密度为____ g/cm3。
(已知相对原子质量:Zn-65、Te-128)
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为
(2)N3-的立体构型是
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成
(已知相对原子质量:Zn-65、Te-128)

您最近一年使用:0次
2019-02-21更新
|
851次组卷
|
2卷引用:【校级联考】江西省临川一中,南昌二中,九江一中,新余一中等九校重点中学协作体2019届高三上学期第一次联考理科综合化学试题
7 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______ (填元素符号),其中C原子的核外电子排布式为__________ 。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式),原因是_______ ;A和B的氢化物所属的晶体类型分别为______ 和______ 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为______ ,中心原子的杂化轨道类型为______ 。
(4)化合物D2A的立体构型为___ ,中心原子的价层电子对数为______ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_________ 。
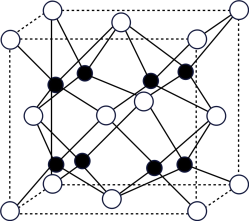
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为______ :晶胞中A原子的配位数为_________ ;列式计算晶体F的密度(g.cm-3)_____ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(4)化合物D2A的立体构型为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为

您最近一年使用:0次
2019-01-30更新
|
7091次组卷
|
32卷引用:2017届江西省九江市十校高三第二次联考理科综合化学试卷
2017届江西省九江市十校高三第二次联考理科综合化学试卷2015年全国普通高等学校招生统一考试化学(新课标II卷)2016届广东省仲元中学高三11月月考理科综合化学试卷2016届重庆市第一中学高三上12月月考理综化学试卷2016届宁夏六盘山中学高三上第一次模拟理综化学试卷新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题宁夏六盘山高级中学2017届高三第五次模拟考试理科综合化学试题宁夏石嘴山市第三中学2018届高三9月月考化学试题河北省正定中学2017届高三上学期第三次月考化学试题四川省南充高级中学2018届高三上学期第四次检测理综化学试题山西省临猗县临晋中学2017-2018学年高二下学期期末考试化学试题西藏自治区日喀则市南木林高级中学2019届高三第一次月考理综化学试题河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷山西省应县第一中学校2018-2019学年高二下学期期中考试化学试题云南省玉溪一中2020届高三上学期期中考试理综化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题四川省成都市双流棠湖中学2019-2020学年高二下学期第二次月考化学试题2020届浙江省杭州学军中学高三教学质量监测卷化学试题湖南省长沙市礼雅中学2020届高三下学期三月份网络教学质量监测理科综合化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广东省广州市华南师范大学附属中学2020届高三教学质量监测卷理科综合化学试题广东省深圳外国语学校2021届高三上学期11月月考化学试题四川省成都市北大成都附属实验学校2021届高三上学期12月月考理科综合化学试题广东省2021届高三“六校联盟”第三次联考化学试题四川省成都龙泉中学2021届高三下学期4月月考理科综合化学试题吉林省松原市实验高级中学2021届高三5月月考化学试题(已下线)2020年海南卷化学高考真题变式题15-19山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷
10-11高二下·江西南昌·期末
8 . 下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
(1)请写出上述元素d3+的核外电子排布式____________________ ;
(2)请写出e元素的原子价电子轨道表示式___________________________ ;
(3)ya3分子的电子式是_______ ,其分子的空间构型是_______ ;
(4)b、e两种元素中,金属性较强的是_______ ,第一电离能大的是_______ ;(填元素符号)
(5)h的i形成hi2分子杂化类型是________ ,fh32-的空间构型为_______________ 。
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||
(1)请写出上述元素d3+的核外电子排布式
(2)请写出e元素的原子价电子轨道表示式
(3)ya3分子的电子式是
(4)b、e两种元素中,金属性较强的是
(5)h的i形成hi2分子杂化类型是
您最近一年使用:0次



