名校
解题方法
1 . 按要求回答下列问题:
(1)A.乙烷 B.乙烯 C.乙炔 D.苯是有机化学中的代表物质,其中:
①既有 键又有
键又有 键的是
键的是_______ (填序号,下同)。
②碳碳键的键长由大到小排序是:_______ 。
③上述分子中所有原子均在同一平面是:_______ 。
(2)含硫元素的微粒有很多,例如 、
、 、
、 、
、 、
、 ,其中
,其中 的分子结构如下图所示,像一顶皇冠,请回答下列问题:
的分子结构如下图所示,像一顶皇冠,请回答下列问题: 中含有的
中含有的 键数目是
键数目是_______ 。
② 中S原子的杂化轨道类型是
中S原子的杂化轨道类型是_______ , 的空间结构是
的空间结构是_______ 。
③ 分子的VSEPR模型是
分子的VSEPR模型是_______ , 是
是_______ (填“极性”或“非极性”)分子。
④沸点:
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是_______ 。
(1)A.乙烷 B.乙烯 C.乙炔 D.苯是有机化学中的代表物质,其中:
①既有
 键又有
键又有 键的是
键的是②碳碳键的键长由大到小排序是:
③上述分子中所有原子均在同一平面是:
(2)含硫元素的微粒有很多,例如
 、
、 、
、 、
、 、
、 ,其中
,其中 的分子结构如下图所示,像一顶皇冠,请回答下列问题:
的分子结构如下图所示,像一顶皇冠,请回答下列问题: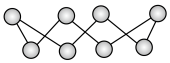
 中含有的
中含有的 键数目是
键数目是②
 中S原子的杂化轨道类型是
中S原子的杂化轨道类型是 的空间结构是
的空间结构是③
 分子的VSEPR模型是
分子的VSEPR模型是 是
是④沸点:

 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是
您最近一年使用:0次
名校
解题方法
2 . 请根据所学知识点,完成以下填空。
(1)基态P原子的价电子轨道表示式_______ 。
(2)基态K原子的简化电子排布式为_______ ,其能量最高的电子所在的能级是_______ ,该能级的原子轨道呈_______ 形。
(3)基态Ni原子核外电子的运动状态有_______ 种,基态 中未成对的电子数与成对电子数之比为
中未成对的电子数与成对电子数之比为_______ 。
(4) 的VSEPR模型和空间构型分别为
的VSEPR模型和空间构型分别为_______ 、_______ 。
(5)一氯乙烷( )和四氟乙烯(
)和四氟乙烯( )分子中C的杂化轨道类型分别为
)分子中C的杂化轨道类型分别为_______ 和_______ 。
(6) 分子中各原子都满足最外层8电子结构,分子中σ键与π键数目之比为
分子中各原子都满足最外层8电子结构,分子中σ键与π键数目之比为_______ , 分子为
分子为_______ (填“极性分子”或“非极性分子”)。
(1)基态P原子的价电子轨道表示式
(2)基态K原子的简化电子排布式为
(3)基态Ni原子核外电子的运动状态有
 中未成对的电子数与成对电子数之比为
中未成对的电子数与成对电子数之比为(4)
 的VSEPR模型和空间构型分别为
的VSEPR模型和空间构型分别为(5)一氯乙烷(
 )和四氟乙烯(
)和四氟乙烯( )分子中C的杂化轨道类型分别为
)分子中C的杂化轨道类型分别为(6)
 分子中各原子都满足最外层8电子结构,分子中σ键与π键数目之比为
分子中各原子都满足最外层8电子结构,分子中σ键与π键数目之比为 分子为
分子为
您最近一年使用:0次
2022-12-15更新
|
396次组卷
|
2卷引用:重庆市第八中学校2022-2023学年高二上学期第二次月考化学试题
名校
解题方法
3 . A~H元素在周期表中的位置如图所示,回答下列问题:

(1)G是地壳中含量第5的元素,在地壳中全部以化合态存在,其化合物的焰色反应为砖红色,这与G原子核外电子发生跃迁______ (填“吸收”或“释放”)能量有关。
(2)第一电离能介于C、D之间的第二周期元素有_______ 种。
(3)H被称为“人类的第三金属”,与H同周期且其基态原子的未成对电子数与H原子相同的元素另有_______ 种。
(4)D的某种氢化物(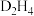 )可用作火箭燃料,燃烧时发生的反应是:
)可用作火箭燃料,燃烧时发生的反应是: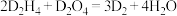 ,若该反应中有
,若该反应中有 电子转移,则形成的
电子转移,则形成的 键有
键有_______  。
。
(5) 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,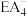 中E元素基态原子的价层电子轨道表示式为
中E元素基态原子的价层电子轨道表示式为______ ;离子半径:
______  (填“
(填“ ”或“
”或“ ”);
”); 中不存在
中不存在______ (填字母)。
A.离子键 B.共价键 C. 键 D.
键 D. 键 E.氢键
键 E.氢键
(6)F元素能形成多种含氧酸及盐,其中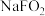 是常用的消毒剂,其酸根离子
是常用的消毒剂,其酸根离子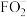 的价层电子对数为
的价层电子对数为______ ,空间构型为______ 。

(1)G是地壳中含量第5的元素,在地壳中全部以化合态存在,其化合物的焰色反应为砖红色,这与G原子核外电子发生跃迁
(2)第一电离能介于C、D之间的第二周期元素有
(3)H被称为“人类的第三金属”,与H同周期且其基态原子的未成对电子数与H原子相同的元素另有
(4)D的某种氢化物(
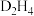 )可用作火箭燃料,燃烧时发生的反应是:
)可用作火箭燃料,燃烧时发生的反应是: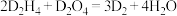 ,若该反应中有
,若该反应中有 电子转移,则形成的
电子转移,则形成的 键有
键有 。
。(5)
 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,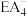 中E元素基态原子的价层电子轨道表示式为
中E元素基态原子的价层电子轨道表示式为
 (填“
(填“ ”或“
”或“ ”);
”); 中不存在
中不存在A.离子键 B.共价键 C.
 键 D.
键 D. 键 E.氢键
键 E.氢键(6)F元素能形成多种含氧酸及盐,其中
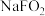 是常用的消毒剂,其酸根离子
是常用的消毒剂,其酸根离子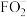 的价层电子对数为
的价层电子对数为
您最近一年使用:0次
名校
解题方法
4 . 下表是元素周期表的一部分。表中所列的字母分别代表一种元素。
回答下列问题:
(1)D的简单气态氢化物分子的立体构型为___________ 。
(2)第一电离能H___________ X(填“>”、“<”或“=”)。
(3)DA3的沸点比D2E的沸点高,其原因是___________ 。
(4)YE 的立体构型为
的立体构型为___________ ,YE 的键角比YE
的键角比YE 的键角小的原因是
的键角小的原因是___________ 。
| A | R | ||||||||||||||||
| B | D | E | M | T | |||||||||||||
| G | H | X | J | Y | L | ||||||||||||
| N |
(1)D的简单气态氢化物分子的立体构型为
(2)第一电离能H
(3)DA3的沸点比D2E的沸点高,其原因是
(4)YE
 的立体构型为
的立体构型为 的键角比YE
的键角比YE 的键角小的原因是
的键角小的原因是
您最近一年使用:0次
2022-05-05更新
|
101次组卷
|
2卷引用:重庆市万州纯阳中学校2021-2022学年高二下学期5月月考化学试题
5 . 回答下列问题:
(1)氨气通入盐酸中发生反应: 。
。
①NH3分子的VSEPR模型名称为_______ ,略去N原子上的_______ 个孤电子对,使得NH3分子的空间结构名称为_______ 。转化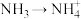 中,氮原子的杂化类型是否改变?
中,氮原子的杂化类型是否改变?_______ (填“改变”或“未变”)。
②转化H3O+→H2O涉及的两种微粒中,H2O、H3O+的空间结构名称分别为_______ 、_______ ,中心原子的杂化类型分别为_______ 、_______ 。
(2)分子的结构往往决定了物质的有关性质,特别是物质的溶解性、熔沸点等物理性质。
①基团间的相互影响可决定物质的结构与性质,如乙烷为_______ 分子(填“极性”或“非极性”,下同),而乙烷中一个氢原子被羟基(—OH)取代后所得的乙醇分子为_______ 分子,这决定了乙烷_______ 溶于水,而乙醇_______ 溶于水。
②氧、硫、硒(Se)元素同为第VIA族元素,三者的简单氢化物结构相似,但H2S的沸点低于H2O,原因是_______ ,H2S的沸点低于H2Se的原因是_______ 。
(1)氨气通入盐酸中发生反应:
 。
。①NH3分子的VSEPR模型名称为
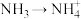 中,氮原子的杂化类型是否改变?
中,氮原子的杂化类型是否改变?②转化H3O+→H2O涉及的两种微粒中,H2O、H3O+的空间结构名称分别为
(2)分子的结构往往决定了物质的有关性质,特别是物质的溶解性、熔沸点等物理性质。
①基团间的相互影响可决定物质的结构与性质,如乙烷为
②氧、硫、硒(Se)元素同为第VIA族元素,三者的简单氢化物结构相似,但H2S的沸点低于H2O,原因是
您最近一年使用:0次
2022-04-21更新
|
228次组卷
|
2卷引用:重庆市名校联盟2021-2022学年高二下学期第一次联合考试化学试题
名校
6 . 1962年,青年化学家Bartlett发表了制成氟铂酸氙(XePtF6)的简报,震惊了化学界。
(1)Bartlett制备该稀有气体化合物的反应为Xe+PtF6=Xe+[PtF6]-,产物中阳离子的价电子排布式是__ ,阴离子中Pt和F之间的作用力为__ 。
(2)后来人们又合成了诸多氙的化合物,XeF4就是一种稳定的化合物。推测Xe和F的电负性大小:x(Xe)___ x(F)(填“<”或“>”)。XeF4能将全氟丙烯氟化为全氟丙烷:XeF4+2CF3CF=CF2→2CF3CF2CF3+Xe。在该反应中,部分碳原子的杂化方式由__ 变为__ 。
(3)XeF4可与水反应生成XeO3。判断XeO3的VSEPR模型名称为__ ,XeO3是__ (填“极性”或“非极性”)分子。任写一种与XeO3互为等电子体的离子:__ 。
(4)XeF2为直线型分子,固态时XeF2晶体结构如图所示。该晶体的理论密度为4.30g/cm3,则Xe-F键长为___ pm。
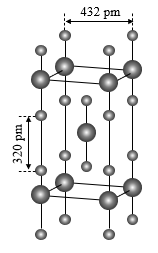
(5)氙还能形成一些含氧酸盐,如高氙酸锂(Li4XeO6)、高氙酸钠(Na4XeO6)等,前者在约300℃分解为Li2O、Xe和O2,后者在360℃左右分解得类似产物。请解释它们分解温度高低差别的原因:__ 。
(6)研究者多用Xe来研究稀有气体化合物而少用Kr等其他稀有气体,是因为:__ 。
(1)Bartlett制备该稀有气体化合物的反应为Xe+PtF6=Xe+[PtF6]-,产物中阳离子的价电子排布式是
(2)后来人们又合成了诸多氙的化合物,XeF4就是一种稳定的化合物。推测Xe和F的电负性大小:x(Xe)
(3)XeF4可与水反应生成XeO3。判断XeO3的VSEPR模型名称为
(4)XeF2为直线型分子,固态时XeF2晶体结构如图所示。该晶体的理论密度为4.30g/cm3,则Xe-F键长为

(5)氙还能形成一些含氧酸盐,如高氙酸锂(Li4XeO6)、高氙酸钠(Na4XeO6)等,前者在约300℃分解为Li2O、Xe和O2,后者在360℃左右分解得类似产物。请解释它们分解温度高低差别的原因:
(6)研究者多用Xe来研究稀有气体化合物而少用Kr等其他稀有气体,是因为:
您最近一年使用:0次
7 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______ (填元素符号),其中C原子的核外电子排布式为__________ 。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式),原因是_______ ;A和B的氢化物所属的晶体类型分别为______ 和______ 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为______ ,中心原子的杂化轨道类型为______ 。
(4)化合物D2A的立体构型为___ ,中心原子的价层电子对数为______ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_________ 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为______ :晶胞中A原子的配位数为_________ ;列式计算晶体F的密度(g.cm-3)_____ 。
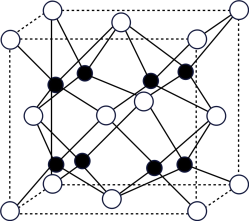
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(4)化合物D2A的立体构型为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为

您最近一年使用:0次
2019-01-30更新
|
7091次组卷
|
32卷引用:2016届重庆市第一中学高三上12月月考理综化学试卷
2016届重庆市第一中学高三上12月月考理综化学试卷2015年全国普通高等学校招生统一考试化学(新课标II卷)2016届广东省仲元中学高三11月月考理科综合化学试卷2016届宁夏六盘山中学高三上第一次模拟理综化学试卷2017届江西省九江市十校高三第二次联考理科综合化学试卷新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题宁夏六盘山高级中学2017届高三第五次模拟考试理科综合化学试题宁夏石嘴山市第三中学2018届高三9月月考化学试题河北省正定中学2017届高三上学期第三次月考化学试题四川省南充高级中学2018届高三上学期第四次检测理综化学试题山西省临猗县临晋中学2017-2018学年高二下学期期末考试化学试题西藏自治区日喀则市南木林高级中学2019届高三第一次月考理综化学试题河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷山西省应县第一中学校2018-2019学年高二下学期期中考试化学试题云南省玉溪一中2020届高三上学期期中考试理综化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题四川省成都市双流棠湖中学2019-2020学年高二下学期第二次月考化学试题2020届浙江省杭州学军中学高三教学质量监测卷化学试题湖南省长沙市礼雅中学2020届高三下学期三月份网络教学质量监测理科综合化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广东省广州市华南师范大学附属中学2020届高三教学质量监测卷理科综合化学试题广东省深圳外国语学校2021届高三上学期11月月考化学试题四川省成都市北大成都附属实验学校2021届高三上学期12月月考理科综合化学试题广东省2021届高三“六校联盟”第三次联考化学试题四川省成都龙泉中学2021届高三下学期4月月考理科综合化学试题吉林省松原市实验高级中学2021届高三5月月考化学试题(已下线)2020年海南卷化学高考真题变式题15-19山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷



