名校
解题方法
1 . “可燃冰”的主要气体成分是甲烷,又称甲烷水合物,外形像冰,存在于海底和大陆冰川或永久冻土底部,是巨大的潜在能源。
(1)研究甲烷分子的结构
①碳原子价层电子轨道表示式是___________ 。
②能说明或解释甲烷分子是正四体形空间结构的是___________ (填序号)。
a.二氯甲烷没有同分异构体
b.4个CH的键长相同,H—C—H的键角均为109°28'
c.碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H 键
键
(2)研究水分子的结构
①H2O的VESPR模型为___________ 。
②H2O的H—O—H键角小于CH4的H—C—H键角,原因是___________ 。
(1)研究甲烷分子的结构
①碳原子价层电子轨道表示式是
②能说明或解释甲烷分子是正四体形空间结构的是
a.二氯甲烷没有同分异构体
b.4个CH的键长相同,H—C—H的键角均为109°28'
c.碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H
 键
键(2)研究水分子的结构
①H2O的VESPR模型为
②H2O的H—O—H键角小于CH4的H—C—H键角,原因是
您最近一年使用:0次
名校
2 . 结合VSEPR理论和杂化轨道理论,判断下列分子的中心原子杂化方式、空间构型。
| 分子 | 中心原子,写元素符号 | 价层电子对数 | 杂化轨道数 | 轨道杂化方式 | 孤电子对数 | 分子的空间构型 |
 | C | 4 | 4 |  | 0 | 正四面体 |
 | ||||||
 | ||||||
 |
您最近一年使用:0次
2024-03-31更新
|
321次组卷
|
2卷引用:北京市十一学校2023-2024学年高一下学期开学考化学试题
解题方法
3 . 黄铁矿是制取硫酸的主要原料,其主要成分为FeS2,其中铁元素显+2价,FeS2晶体的晶胞形状为立方体,晶胞结构如图所示。

(1)基态Fe2+的价电子排布式是___________ 。
(2)制取硫酸过程中会产生SO3,SO3分子的空间构型为___________ 。
(3)晶胞中与每个S 距离最近且相等的Fe2+有
距离最近且相等的Fe2+有___________ 个。
(4)FeS2晶体的晶胞边长为anm,FeS2的摩尔质量为120g·mol-1,阿伏加德罗常数的值为NA,该FeS2晶体的密度ρ=___________ g·cm-3(1nm=10-7cm,用含a、NA的代数式表示)

(1)基态Fe2+的价电子排布式是
(2)制取硫酸过程中会产生SO3,SO3分子的空间构型为
(3)晶胞中与每个S
 距离最近且相等的Fe2+有
距离最近且相等的Fe2+有(4)FeS2晶体的晶胞边长为anm,FeS2的摩尔质量为120g·mol-1,阿伏加德罗常数的值为NA,该FeS2晶体的密度ρ=
您最近一年使用:0次
2022·浙江·模拟预测
解题方法
4 . 硼化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态B原子核外电子有_______ 种不同的空间运动状态。
(2) 主要用作有机合成中的催化剂,也用于制作火箭的高能燃料。
主要用作有机合成中的催化剂,也用于制作火箭的高能燃料。 的空间构型为
的空间构型为_______ 。形成 时,基态B原子价层电子先进行激发,再进行杂化,激发时B原子的价层电子轨道表示式可能为
时,基态B原子价层电子先进行激发,再进行杂化,激发时B原子的价层电子轨道表示式可能为_______ 。(填序号)。
A.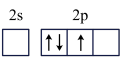 B.
B.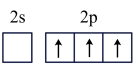 C.
C.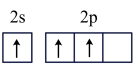 D.
D.
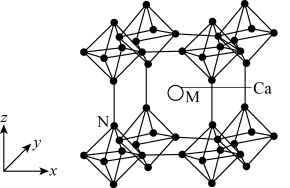
(3)Ca与B组成的金属硼化物结构如图所示,硼原子通过B—B键互相连接成三维骨架形成 正八面体,该结构具有立方晶系的对称性。
正八面体,该结构具有立方晶系的对称性。
①该晶体的化学式为_______ ,晶体中Ca原子的配位数为_______ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如M点原子的分数坐标为 ,已知
,已知 八面体中B—B键的键长为rpm,晶胞参数为apm,则N点原子的分数坐标为
八面体中B—B键的键长为rpm,晶胞参数为apm,则N点原子的分数坐标为_______ ,Ca与B原子间的距离d为_______ pm(列出表达式即可)。
(1)基态B原子核外电子有
(2)
 主要用作有机合成中的催化剂,也用于制作火箭的高能燃料。
主要用作有机合成中的催化剂,也用于制作火箭的高能燃料。 的空间构型为
的空间构型为 时,基态B原子价层电子先进行激发,再进行杂化,激发时B原子的价层电子轨道表示式可能为
时,基态B原子价层电子先进行激发,再进行杂化,激发时B原子的价层电子轨道表示式可能为A.
 B.
B. C.
C. D.
D.
(3)Ca与B组成的金属硼化物结构如图所示,硼原子通过B—B键互相连接成三维骨架形成
 正八面体,该结构具有立方晶系的对称性。
正八面体,该结构具有立方晶系的对称性。①该晶体的化学式为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如M点原子的分数坐标为
 ,已知
,已知 八面体中B—B键的键长为rpm,晶胞参数为apm,则N点原子的分数坐标为
八面体中B—B键的键长为rpm,晶胞参数为apm,则N点原子的分数坐标为
您最近一年使用:0次
5 . 螯合树脂吸附法处理废水具有吸附容量大、速度快以及选择性好等特点,已成为近年来的研究热点。螯合树脂M与Cu2+形成新的螯合物Q,从而达到去除Cu2+的效果,吸附机理如图所示。
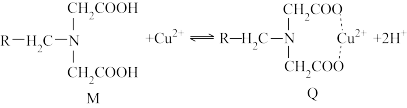
资料:
①吸附原理
螯合树脂M中的—COOH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)M中四种元素电负性由大到小的顺序为(用元素符号表示)____ 。
(2)M中N原子的杂化轨道类型为____ 。
(3)Q中存在配位键,其中提供空轨道的是____ 。
(4)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量有影响,实验结果如图所示。

①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为____ 时吸附效果最好。
②解释体系碱性过强时,吸附能力下降的原因____ 。
③从结构角度解释:体系酸性较强时,吸附能力下降的原因____ 。
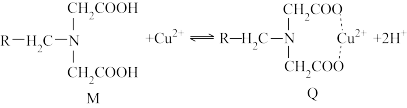
资料:
①吸附原理
螯合树脂M中的—COOH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)M中四种元素电负性由大到小的顺序为(用元素符号表示)
(2)M中N原子的杂化轨道类型为
(3)Q中存在配位键,其中提供空轨道的是
(4)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量有影响,实验结果如图所示。

①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为
②解释体系碱性过强时,吸附能力下降的原因
③从结构角度解释:体系酸性较强时,吸附能力下降的原因
您最近一年使用:0次
解题方法
6 . 根据物质结构的基本理论,原子之间通过原子轨道的重叠方式,以不同类型的化学键结合,形成具有不同空间结构的分子或离子,按照已学的物质结构知识填写下列空白。
(1)在 分子中,硼原子的杂化轨道类型为
分子中,硼原子的杂化轨道类型为_______ ,F-B-F的键角是_______ , 为
为_______ 分子(极性分子或非极性分子)。
(2) 可与
可与 形成
形成 ,
, 中氧原子采用
中氧原子采用_______ 杂化。 的立体构型为
的立体构型为_______ 。
(3) 中H-O-H键角比
中H-O-H键角比 中H-O-H键角大,原因为
中H-O-H键角大,原因为_______ 。
(1)在
 分子中,硼原子的杂化轨道类型为
分子中,硼原子的杂化轨道类型为 为
为(2)
 可与
可与 形成
形成 ,
, 中氧原子采用
中氧原子采用 的立体构型为
的立体构型为(3)
 中H-O-H键角比
中H-O-H键角比 中H-O-H键角大,原因为
中H-O-H键角大,原因为
您最近一年使用:0次
解题方法
7 . 甲醇(CH3OH)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为2CH3OH+O2 2
2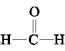 +2H2O
+2H2O
(1)C、H、O 三种元素的电负性由大到小的顺序为_______ 。
(2)H2O的中心原子上的孤电子对数为_______ 。
(3)HCHO分子内σ键与π键个数之比为_______ ,HCHO的空间结构为_______ 。
(4)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为_______ 和_______ 。
(5)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:_______ 。
 2
2 +2H2O
+2H2O(1)C、H、O 三种元素的电负性由大到小的顺序为
(2)H2O的中心原子上的孤电子对数为
(3)HCHO分子内σ键与π键个数之比为
(4)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为
(5)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:
您最近一年使用:0次
8 . 考查下列三种分子:BF3、NF3、IF3,分别回答下列问题:
(1)写出各分子的路易斯电子结构式(用点和线标示原子的价电子结构):_______
(2)预言它们的几何构型,包括所有的键角:_______
(3)说明它们是否是极性分子,简述你的理由:_______
(4)讨论它们可能的路易斯酸碱性_______ 。
(1)写出各分子的路易斯电子结构式(用点和线标示原子的价电子结构):
(2)预言它们的几何构型,包括所有的键角:
(3)说明它们是否是极性分子,简述你的理由:
(4)讨论它们可能的路易斯酸碱性
您最近一年使用:0次



