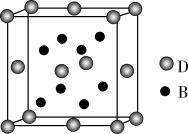
1 . 已知A,B,C,D,E是元素周期表中1~36号元素,其原子序数依次增大,且A,B,C,D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图。
请回答下列问题:
(1)C-的电子排布式为___ ;E元素原子的价电子排布式为___ 。
(2)元素B与氮元素可以形成化合物NB3,其中N﹣B键的化学键类型为___ ,根据价层电子对互斥理论可以判断NB3的空间构型为___ ,NB3分子中N原子的杂化方式为杂化___ 。
(3)A,B形成的化合物AB的相对分子质量比A,C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是___ 。
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为___ 。
(5)含有D元素的化合物焰色反应为___ 色。

请回答下列问题:
(1)C-的电子排布式为
(2)元素B与氮元素可以形成化合物NB3,其中N﹣B键的化学键类型为
(3)A,B形成的化合物AB的相对分子质量比A,C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为
(5)含有D元素的化合物焰色反应为
您最近一年使用:0次
解题方法
2 . 空气明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载,锌是生命体必需的微量元素,被称为“生命之花”。(已知阿伏加 德罗常数的值为NA)
(1)基态 原子核外的最高能层符号是
原子核外的最高能层符号是________ ,基态 最外层电子排布式为
最外层电子排布式为________ 。
(2)乳酸锌[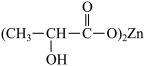 ]是一种很好的食品锌强化剂,其中存在的作用力有
]是一种很好的食品锌强化剂,其中存在的作用力有________ (填编号)。 乳酸锌中含有
乳酸锌中含有________ 个σ键。
A.离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
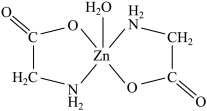
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是________ , 分子的空间构型为
分子的空间构型为________ 形, 的配位数为
的配位数为________ 。甘氨酸(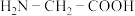 )中N原子的杂化轨道类型为
)中N原子的杂化轨道类型为________ ;甘氨酸易溶于水,试从结构角度解释________ 。
(4)Zn与S形成某种化合物的晶胞如图所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为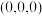 ,则原子2的坐标为
,则原子2的坐标为________ 。
②已知晶体密度为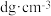 ,
, 半径为
半径为 ,若要使
,若要使 、
、 相切,则
相切,则 半径为
半径为________  (写计算表达式)。
(写计算表达式)。
(1)基态
 原子核外的最高能层符号是
原子核外的最高能层符号是 最外层电子排布式为
最外层电子排布式为(2)乳酸锌[
 ]是一种很好的食品锌强化剂,其中存在的作用力有
]是一种很好的食品锌强化剂,其中存在的作用力有 乳酸锌中含有
乳酸锌中含有A.离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是
 分子的空间构型为
分子的空间构型为 的配位数为
的配位数为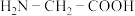 )中N原子的杂化轨道类型为
)中N原子的杂化轨道类型为
(4)Zn与S形成某种化合物的晶胞如图所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为
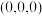 ,则原子2的坐标为
,则原子2的坐标为②已知晶体密度为
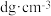 ,
, 半径为
半径为 ,若要使
,若要使 、
、 相切,则
相切,则 半径为
半径为 (写计算表达式)。
(写计算表达式)。
您最近一年使用:0次
2020-07-10更新
|
191次组卷
|
2卷引用:西藏拉萨市2020届高三第二次模拟考试理科综合化学试题
2019高三下·全国·专题练习
名校
解题方法
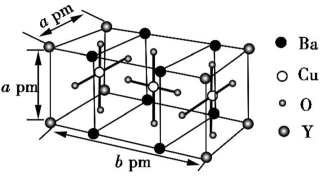
3 . 钇钡铜氧(YBa2Cu3O7-x)是一种高温超导材料(其中Y显+3价,Cu显+2、+3价),最早是将BaCO3、Y2(CO3)3和CuCO3混合在高温下反应制备的。
请回答下列问题:
(1)Y(钇)是一种重要的稀土金属,与Sc(钪)同族相邻。则Y原子核外有___________ 个价电子。Y位于元素周期表的___________ 区。
(2)在BaCO3中,CO32-的空间构型为___________ ,C原子采取___________ 杂化;BaCO3、CaCO3受热分解分别生成BaO、CaO,BaO、CaO熔点较高的是___________ (填化学式)。
(3)基态Cu3+的核外电子排布式为___________ 。
(4)若YBa2Cu3O7-x(0≤x≤0.5)材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=___________ 。
(5)铜有两种氧化物:CuO和Cu2O,后者比前者的热稳定性强,原因是___________ 。
(6)如图是某种超导材料A的晶胞结构示意图,其化学式为___________ 。若A的摩尔质量为M g·mol-1,阿伏伽德罗常数的值为NA,晶胞参数为apm、apm、bpm,则晶体的密度为___________ g·cm-3。
请回答下列问题:
(1)Y(钇)是一种重要的稀土金属,与Sc(钪)同族相邻。则Y原子核外有
(2)在BaCO3中,CO32-的空间构型为
(3)基态Cu3+的核外电子排布式为
(4)若YBa2Cu3O7-x(0≤x≤0.5)材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=
(5)铜有两种氧化物:CuO和Cu2O,后者比前者的热稳定性强,原因是
(6)如图是某种超导材料A的晶胞结构示意图,其化学式为

您最近一年使用:0次
解题方法
4 . 氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________ ,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________ 。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________ 。
(3)N2F2分子中N原子的杂化方式是__________ ,l mol N2F2含有__________ molσ键.
(4)NF3的键角__________ NH3的键角(填“<”“>”或“=”),原因是__________ .
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________ mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________ .
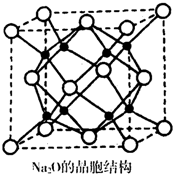
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为__________ ,Na2O晶体的密度为__________ g•cm-3(只要求列算式,不必计算出结果)。
(1)基态N原子中电子在2p轨道上的排布遵循的原则是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)N2F2分子中N原子的杂化方式是
(4)NF3的键角
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4
(6)安全气囊的设计原理为6NaN3+FeIO3
 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为

您最近一年使用:0次



