钇钡铜氧(YBa2Cu3O7-x)是一种高温超导材料(其中Y显+3价,Cu显+2、+3价),最早是将BaCO3、Y2(CO3)3和CuCO3混合在高温下反应制备的。
请回答下列问题:
(1)Y(钇)是一种重要的稀土金属,与Sc(钪)同族相邻。则Y原子核外有___________ 个价电子。Y位于元素周期表的___________ 区。
(2)在BaCO3中,CO32-的空间构型为___________ ,C原子采取___________ 杂化;BaCO3、CaCO3受热分解分别生成BaO、CaO,BaO、CaO熔点较高的是___________ (填化学式)。
(3)基态Cu3+的核外电子排布式为___________ 。
(4)若YBa2Cu3O7-x(0≤x≤0.5)材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=___________ 。
(5)铜有两种氧化物:CuO和Cu2O,后者比前者的热稳定性强,原因是___________ 。
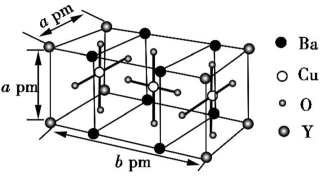
(6)如图是某种超导材料A的晶胞结构示意图,其化学式为___________ 。若A的摩尔质量为M g·mol-1,阿伏伽德罗常数的值为NA,晶胞参数为apm、apm、bpm,则晶体的密度为___________ g·cm-3。
请回答下列问题:
(1)Y(钇)是一种重要的稀土金属,与Sc(钪)同族相邻。则Y原子核外有
(2)在BaCO3中,CO32-的空间构型为
(3)基态Cu3+的核外电子排布式为
(4)若YBa2Cu3O7-x(0≤x≤0.5)材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=
(5)铜有两种氧化物:CuO和Cu2O,后者比前者的热稳定性强,原因是
(6)如图是某种超导材料A的晶胞结构示意图,其化学式为

2019高三下·全国·专题练习 查看更多[2]
更新时间:2019-03-26 09:18:49
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】完成下列填空
(1)某小组同学合作探究铝铁混合物分离的工艺流程如下:

①气体A能使湿润的红色石蕊试纸变蓝。写出加热时反应1的离子方程式:_________ 。
②反应2的离子方程式为__________ 。
(2)由工业废气(NO、 )制备
)制备 的实验原理如下:
的实验原理如下:
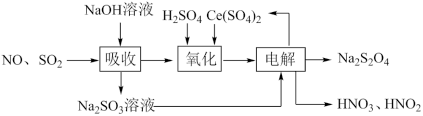
①氧化时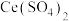 转化为
转化为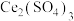 ,NO转化为
,NO转化为 (弱酸)和
(弱酸)和 ,产物中
,产物中 和
和 物质的量之比为3:1。写出该反应的离子方程式:
物质的量之比为3:1。写出该反应的离子方程式:_________ 。
②电解时 发生的电极反应为
发生的电极反应为____________ 。
(3) 甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。催化剂的选择是
甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。催化剂的选择是 甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测得
甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测得 转化率随温度变化的影响如图。
转化率随温度变化的影响如图。

①催化剂Ni原子的基态核外电子排布式为_______ ,该元素位于_______ 区。
②对比上述两种催化剂的催化性能,工业上应选择的催化剂及使用的合适温度是______ 。
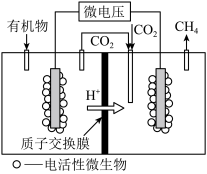
(4)近年来新兴的生物电催化技术运用微生物电解池也可实现 甲烷化,其工作原理如图。微生物电解池实现
甲烷化,其工作原理如图。微生物电解池实现 甲烷化的阴极电极反应式为
甲烷化的阴极电极反应式为_____ 。
(1)某小组同学合作探究铝铁混合物分离的工艺流程如下:

①气体A能使湿润的红色石蕊试纸变蓝。写出加热时反应1的离子方程式:
②反应2的离子方程式为
(2)由工业废气(NO、
 )制备
)制备 的实验原理如下:
的实验原理如下: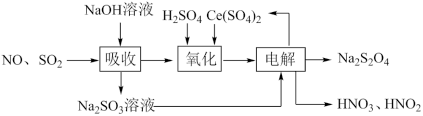
①氧化时
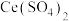 转化为
转化为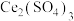 ,NO转化为
,NO转化为 (弱酸)和
(弱酸)和 ,产物中
,产物中 和
和 物质的量之比为3:1。写出该反应的离子方程式:
物质的量之比为3:1。写出该反应的离子方程式:②电解时
 发生的电极反应为
发生的电极反应为(3)
 甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。催化剂的选择是
甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。催化剂的选择是 甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测得
甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测得 转化率随温度变化的影响如图。
转化率随温度变化的影响如图。
①催化剂Ni原子的基态核外电子排布式为
②对比上述两种催化剂的催化性能,工业上应选择的催化剂及使用的合适温度是
(4)近年来新兴的生物电催化技术运用微生物电解池也可实现
 甲烷化,其工作原理如图。微生物电解池实现
甲烷化,其工作原理如图。微生物电解池实现 甲烷化的阴极电极反应式为
甲烷化的阴极电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】非金属氮化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态N原子核外电子的运动状态有________ 种。羟胺(NH2OH)的水溶液呈碱性,其碱性原理与氨水相似,同浓度的氨水和羟胺两种溶液的碱性较强的是______ (填“NH2OH"或“NH3”),原因是____________ 。
(2)氟化硝酰(NO2F)可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为_______ ;第一电离能由大到小顺序为_________ 。
(3)气态N2O5的分子结构为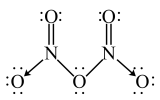 ,而固态N2O5则由
,而固态N2O5则由 与
与 构成。
构成。 的空间构型为
的空间构型为______ , 中N的杂化方式为
中N的杂化方式为________ 。
(4) 和PH3中共价键的键角比较:
和PH3中共价键的键角比较:
_______ PH3(填“>”、“<”或“=”,下同), 和
和 中共价键键角比较:
中共价键键角比较:
_____  。
。
(1)基态N原子核外电子的运动状态有
(2)氟化硝酰(NO2F)可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为
(3)气态N2O5的分子结构为
 ,而固态N2O5则由
,而固态N2O5则由 与
与 构成。
构成。 的空间构型为
的空间构型为 中N的杂化方式为
中N的杂化方式为(4)
 和PH3中共价键的键角比较:
和PH3中共价键的键角比较:
 和
和 中共价键键角比较:
中共价键键角比较:
 。
。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】下图是元素周期表(局部示意图),其中a、b、c、d、e、f为元素代号。

(1)写出a的基态原子核外电子排布式 _______ ;画出b的基态原子的轨道表示式 _______ ;
(2)b和e两元素的原子以_______ (填化学键类型)形成化合物;
(3)b、c、d三种元素中,原子半径最大的是_______ (用其原子结构示意图 表示)离子半径最大的是_______ (用离子的电子式 表示);
(4)举一实验事实来比较说明c与d的金属性强弱关系_______ ;
(5)下列有关元素周期表的叙述中,错误的是_______(填序号)

(1)写出a的基态原子
(2)b和e两元素的原子以
(3)b、c、d三种元素中,原子半径最大的是
(4)举一实验事实来比较说明c与d的金属性强弱关系
(5)下列有关元素周期表的叙述中,错误的是_______(填序号)
| A.位于金属非金属分界线附近的元素既表现金属的某些性质,又表现非金属的某些性质 |
| B.人们在金属非金属分界线附近寻找催化剂 |
| C.元素b的最高价氧化物对应的水化物的酸性是最强的 |
D.在 的七种元素中,f的金属性最强 的七种元素中,f的金属性最强 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】磷酸氯喹(结构如图所示)在细胞水平上能有效抑制新型冠状病毒的感染,我国印发的《新型冠状病毒肺炎诊疗方案(试行第七版)》中明确规定了其用量。
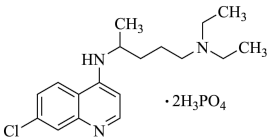
(1)碳、硅、锗为同一主族元素,则基态硅原子核外电子的空间运动状态有________ 种,基态锗原子的最外层的电子排布图为__________________ 。
(2)C、N、O三种元素第一电离能由大到小的顺序是_____________________ 。
(3)磷酸氯喹分子中氮原子的杂化方式为________ ,苯环中含有的共价键类型是________ 。
(4) 的空间构型是
的空间构型是____________ ,与 互为等电子体的分子是
互为等电子体的分子是____________ (写一种即可)。
(5)由C、H、O元素组成的H2O和C2H5OH可以任意比例互溶,其原因是________________ 。

(6)由P与B元素形成的化合物BP的晶胞(如图所示)中B采用面心立方堆积,P原子填入四面体空隙中。已知晶胞边长为a pm,晶体中B原子与P原子的最近距离是___________ ,设阿伏加 德罗常数的值为NA,则BP晶体的密度是___________ g/cm3(列出计算表达式)。

(1)碳、硅、锗为同一主族元素,则基态硅原子核外电子的空间运动状态有
(2)C、N、O三种元素第一电离能由大到小的顺序是
(3)磷酸氯喹分子中氮原子的杂化方式为
(4)
 的空间构型是
的空间构型是 互为等电子体的分子是
互为等电子体的分子是(5)由C、H、O元素组成的H2O和C2H5OH可以任意比例互溶,其原因是

(6)由P与B元素形成的化合物BP的晶胞(如图所示)中B采用面心立方堆积,P原子填入四面体空隙中。已知晶胞边长为a pm,晶体中B原子与P原子的最近距离是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】掺杂了硒(Se)、 碲(Te) 固溶物的Ag2S是一种具有良好塑性和热电性能的柔性半导体材料,该材料能用于可穿戴式、植入式电子设备的制备。
回答下列问题:
(1)Ag的核外电子排布式是[Kr] 4d105s1,则Ag在元素周期表中的位置是_______ 。下列属于基态Ag+的电子排布式的是_______ (填标号)。
A. [Kr] 4d95s2 B. [Kr] 4dl0 C. [Kr] 4d95s1
(2)S、As、Se、Br在元素周期表中的位置关系如图所示,则As、Se、Br的第一电离能由大到小的顺序为_______ , 的空间构型为
的空间构型为_______ 。
(3)金属Ge也是一种良好的半导体,利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,该离子液体的熔点只有7℃,其中EMIM+结构如图所示。
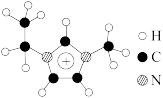
①EMIM+中C原子的杂化类型是_______ 。
②EMIM+中σ键数: π键数=_______ 。
③该离子液体的熔点比较低的原因是_______ 。
(4)ZnS的立方晶胞结构如下图所示:

①ZnS晶体中,与S2-距离最近且等距的Zn2+的个数是_______ 。
②ZnS的晶胞边长为a pm,则晶体的密度为_______ g·cm-3(用含a、NA的代数式表示,NA为阿伏加德罗常数的值)。
回答下列问题:
(1)Ag的核外电子排布式是[Kr] 4d105s1,则Ag在元素周期表中的位置是
A. [Kr] 4d95s2 B. [Kr] 4dl0 C. [Kr] 4d95s1
(2)S、As、Se、Br在元素周期表中的位置关系如图所示,则As、Se、Br的第一电离能由大到小的顺序为
 的空间构型为
的空间构型为| S | ||
| As | Se | Br |

①EMIM+中C原子的杂化类型是
②EMIM+中σ键数: π键数=
③该离子液体的熔点比较低的原因是
(4)ZnS的立方晶胞结构如下图所示:

①ZnS晶体中,与S2-距离最近且等距的Zn2+的个数是
②ZnS的晶胞边长为a pm,则晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】按照要求回答下列问题:
(1)基态 Cr 原子的价电子排布式为_______ ,占据最高能层的电子的电子云轮廓图形状为__ 。
(2)在BF3分子中,硼原子的杂化轨道类型为________ ,BF3和过量NaF作用可生成NaBF4,BF 的立体构型为
的立体构型为________ ,写出BF 的一种等电子体
的一种等电子体_______ 。
(3)Fe3+比 Fe2+更稳定的原因是_______________________________ 。
(4)金刚石晶胞中面心和顶点碳原子替换成硅原子即为金刚砂晶胞,其晶胞如图所示:
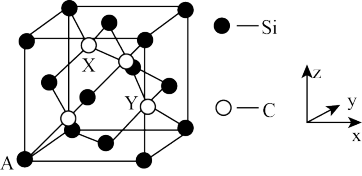
①金刚砂的化学式为_________ 。
②原子坐标参数表示晶胞内部各原子的相对位置。图中 A 原子坐标(0,0,0),则金刚砂晶胞中碳原子 X 的原子坐标为____________ 。
(1)基态 Cr 原子的价电子排布式为
(2)在BF3分子中,硼原子的杂化轨道类型为
 的立体构型为
的立体构型为 的一种等电子体
的一种等电子体(3)Fe3+比 Fe2+更稳定的原因是
(4)金刚石晶胞中面心和顶点碳原子替换成硅原子即为金刚砂晶胞,其晶胞如图所示:

①金刚砂的化学式为
②原子坐标参数表示晶胞内部各原子的相对位置。图中 A 原子坐标(0,0,0),则金刚砂晶胞中碳原子 X 的原子坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】氯吡苯脲是一种常用的膨大剂,其结构简式为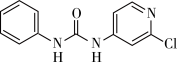 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。
(1)氯元素基态原子核外电子的未成对电子数为___________ 。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为___________ ,羰基碳原子的杂化轨道类型为___________ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如下:

反应过程中,每生成1mol氯吡苯脲,断裂___________ 个 键,断裂
键,断裂___________ 个 键。
键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有 、
、 、
、 等。
等。
①请用共价键知识解释 分子比
分子比 分子稳定的原因为
分子稳定的原因为___________ 。
② 分子的空间结构是
分子的空间结构是___________ ,中心原子的杂化类型分别是___________ 。
 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。(1)氯元素基态原子核外电子的未成对电子数为
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如下:

反应过程中,每生成1mol氯吡苯脲,断裂
 键,断裂
键,断裂 键。
键。(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有
 、
、 、
、 等。
等。①请用共价键知识解释
 分子比
分子比 分子稳定的原因为
分子稳定的原因为②
 分子的空间结构是
分子的空间结构是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1) 与
与 同族且相邻,写出基态
同族且相邻,写出基态 原子的价层电子排布式:
原子的价层电子排布式:_______ 。
(2)O和S处于同一主族,第一电离能较大的是_______ 。 和
和 分子中的键角较大的是
分子中的键角较大的是_______ ,键长较短的是_______ 。单质硫与热的 浓溶液反应的产物之一为
浓溶液反应的产物之一为 ,
,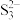 的空间构型为
的空间构型为_______ 。
(3) 能与吡咯(
能与吡咯( )的阴离子(
)的阴离子(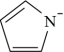 )形成双吡咯铜。已知吡咯分子中的大π键可用符号
)形成双吡咯铜。已知吡咯分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则吡咯分子中的大π键应表示为
),则吡咯分子中的大π键应表示为_______ 。吡咯分子中N原子的杂化类型为_______ , 吡咯分子中含有
吡咯分子中含有_______  键,
键, 噻吩的沸点为
噻吩的沸点为 ,吡咯(
,吡咯(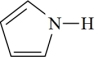 )的沸点在
)的沸点在 之间,吡咯沸点较高,其原因是
之间,吡咯沸点较高,其原因是_______ 。
(4)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度: ,则下列物质酸性由强到弱的顺序是
,则下列物质酸性由强到弱的顺序是_______ 。
A. B.
B. C.
C. D.
D.
(1)
 与
与 同族且相邻,写出基态
同族且相邻,写出基态 原子的价层电子排布式:
原子的价层电子排布式:(2)O和S处于同一主族,第一电离能较大的是
 和
和 分子中的键角较大的是
分子中的键角较大的是 浓溶液反应的产物之一为
浓溶液反应的产物之一为 ,
,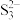 的空间构型为
的空间构型为(3)
 能与吡咯(
能与吡咯( )的阴离子(
)的阴离子( )形成双吡咯铜。已知吡咯分子中的大π键可用符号
)形成双吡咯铜。已知吡咯分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则吡咯分子中的大π键应表示为
),则吡咯分子中的大π键应表示为 吡咯分子中含有
吡咯分子中含有 键,
键, 噻吩的沸点为
噻吩的沸点为 ,吡咯(
,吡咯( )的沸点在
)的沸点在 之间,吡咯沸点较高,其原因是
之间,吡咯沸点较高,其原因是(4)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度:
 ,则下列物质酸性由强到弱的顺序是
,则下列物质酸性由强到弱的顺序是A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】I.近年来,我国航天事业发展迅猛,这与材料技术的进步密切相关。如新型储氢材料、陶瓷基复合材料氮化硼(BN)、太阳能电池材料砷化镓(GaAs)等,请按要求回答问题:
(1)基态砷原子简化的核外电子排布式为_______ ,其电子占据的最高能层符号是_______ ,占据最高能级的所在的原子轨道为_______ 形。与As位于同一周期,且未成对电子数也相同的元素有_______ (写元素符号)。
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气:NaBH4+2H2O=NaBO2+4H2↑(反应前后B元素的化合价不变)。上述方程式中所涉及的元素的电负性由大到小的顺序为_______ ;BH 的空间构型为
的空间构型为_______ 。
(3)乙二胺(H2NCH2CH2NH2)是一种有机物,分子中N原子、C原子的的杂化方式分别为_______ 、_______ 。乙二胺能与Cu2+、Mg2+等金属离子形成稳定环状离子,其原因是_______ 。其中与乙二胺形成的化合物稳定性相对较高的是_______ (填Cu2+或Mg2+)。
II.金属材料Fe、Cu、Zn等在工业生产和日常生活中有广泛的应用。
(4)黄铜是铜和锌组成的合金,铜、锌两种元素位于元素周期表的_______ 区,Cu、Zn的第二电离能(I2):_______ >_______ 。
(5)下列状态的铜,电离最外层一个电子所需能量最大的是_______ 。
(6)Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如[Fe(H2O)6]3+、[Fe(SCN)6]3-、[FeF6]3-。某同学按如图步骤完成实验:
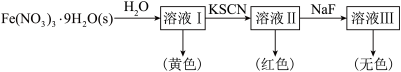
已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。
①1mol[Fe(H2O)6]3+中含有_______ molσ键;[Fe(H2O)6]3+为浅紫色,但溶液I却呈黄色,其原因是_______ ,为了能观察到溶液I中[Fe(H2O)6]3+的浅紫色,可采取的方法是_______ 。
②检验FeCl3溶液中含有Co2+的实验方法是:取FeCl3溶液于试管中,_______ 。
(1)基态砷原子简化的核外电子排布式为
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气:NaBH4+2H2O=NaBO2+4H2↑(反应前后B元素的化合价不变)。上述方程式中所涉及的元素的电负性由大到小的顺序为
 的空间构型为
的空间构型为(3)乙二胺(H2NCH2CH2NH2)是一种有机物,分子中N原子、C原子的的杂化方式分别为
II.金属材料Fe、Cu、Zn等在工业生产和日常生活中有广泛的应用。
(4)黄铜是铜和锌组成的合金,铜、锌两种元素位于元素周期表的
(5)下列状态的铜,电离最外层一个电子所需能量最大的是
| A.[Ar]3d104s1 | B.[Ar]3d10 | C.[Ar]3d94s1 | D.[Ar]3d104p1 |

已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。
①1mol[Fe(H2O)6]3+中含有
②检验FeCl3溶液中含有Co2+的实验方法是:取FeCl3溶液于试管中,
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物;B原子核外电子有6种不同的运动状态;B与C可形成正四面体形分子;D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_______ ,第一电离能最小的元素是_______ (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由低到高的顺序是_______ (填化学式),呈现如此递变规律的原因是_______ 。
(3)D元素的原子共有_______ 种不同能级的电子,电子占据的最高能层符号为_______ 该元素形成的单质,其晶体的堆积模型为_______ 。其晶胞棱长为a nm,则密度可用代数式表示为_______ g/cm3.
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由低到高的顺序是
(3)D元素的原子共有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】碳和硅是同主族元素,但是 和
和 的性质和应用却有着很大差异。
的性质和应用却有着很大差异。
(1)原子结构与元素性质分析
①基态碳原子占据的最高能级的原子轨道的形状是___________ (填名称)。
②基态 的价层电子轨道表示式是:
的价层电子轨道表示式是:___________
③元素C、Si、O的电负性由大到小的关系是___________
(2)微粒间相互作用与物质性质
① 和
和 中同时存在
中同时存在 键和
键和 键的是
键的是___________ (填化学式)。
② 分子的空间结构是
分子的空间结构是___________ ,碳原子的杂化轨道类型为___________ ﹔
③ 晶体结构如下图所示,硅原子的杂化轨道类型为
晶体结构如下图所示,硅原子的杂化轨道类型为___________ 。

(3)不同聚集状态的物质与性质
①Si与C同主族,但 与
与 的熔沸点等物理性质差距很大,请从晶体结构角度解释其原因
的熔沸点等物理性质差距很大,请从晶体结构角度解释其原因___________ 。
②干冰晶体结构如上图所示,下列关于 与
与 叙述正确的是
叙述正确的是___________ 。
a.固体 一定是晶体
一定是晶体
b.干冰晶体中,每个 周围紧邻12个
周围紧邻12个
c. 晶胞中,含有Si原子8个和O原子16个
晶胞中,含有Si原子8个和O原子16个
③某种含硅化合物晶胞结构如下图所示,这种含硅化合物的化学式为___________ 。
④已知该化合物的晶胞边长为acm,阿伏伽德罗常数的值为 ,则其晶体的密度为
,则其晶体的密度为___________  。
。

 和
和 的性质和应用却有着很大差异。
的性质和应用却有着很大差异。(1)原子结构与元素性质分析
①基态碳原子占据的最高能级的原子轨道的形状是
②基态
 的价层电子轨道表示式是:
的价层电子轨道表示式是:③元素C、Si、O的电负性由大到小的关系是
(2)微粒间相互作用与物质性质
①
 和
和 中同时存在
中同时存在 键和
键和 键的是
键的是②
 分子的空间结构是
分子的空间结构是③
 晶体结构如下图所示,硅原子的杂化轨道类型为
晶体结构如下图所示,硅原子的杂化轨道类型为
(3)不同聚集状态的物质与性质
①Si与C同主族,但
 与
与 的熔沸点等物理性质差距很大,请从晶体结构角度解释其原因
的熔沸点等物理性质差距很大,请从晶体结构角度解释其原因②干冰晶体结构如上图所示,下列关于
 与
与 叙述正确的是
叙述正确的是a.固体
 一定是晶体
一定是晶体b.干冰晶体中,每个
 周围紧邻12个
周围紧邻12个
c.
 晶胞中,含有Si原子8个和O原子16个
晶胞中,含有Si原子8个和O原子16个③某种含硅化合物晶胞结构如下图所示,这种含硅化合物的化学式为
④已知该化合物的晶胞边长为acm,阿伏伽德罗常数的值为
 ,则其晶体的密度为
,则其晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】硼化钒(VB2)一空气电池是目前储电能力最高的电池之一,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为___ 形。钒有+2、+3、+4、+5等几种化合价,其中V3+的价电子排布图为__ 。
(2)在第二周期中第一电离能介于B和O两种元素之间的元素有__ (填元素符号)。
(3)V2O5常用作SO2转化为SO3的催化剂:SO2分子中键角___ (填“>”“<”或“=”)120°,原因是__ ;SO3的三聚体环状结构如图所示,该分子中含有___ 个σ键。S原子的杂化方式为___ 。

(4)钒(II)与H2O形成[V(H2O)6]2+配离子过程中, 下列描述不合理的是__ (填序号)。
a.提供孤电子对的成键原子是氧原子
b.微粒的化学性质发生了改变
c.微粒中氢氧键(H-O)的夹角未发生改变
d.在[V(H2O)6]2+中存在的化学键有配位键、σ键、π键和氢键
(5)某六方硫钒化合物晶体的晶胞如图甲所示,该晶胞的化学式为___ 。图乙为该晶胞俯视图,该晶胞的密度为__ g·cm-3(NA为阿伏加 德罗常数的数值,列出计算式即可)。

(1)基态B原子电子占据最高能级的电子云轮廓图为
(2)在第二周期中第一电离能介于B和O两种元素之间的元素有
(3)V2O5常用作SO2转化为SO3的催化剂:SO2分子中键角

(4)钒(II)与H2O形成[V(H2O)6]2+配离子过程中, 下列描述不合理的是
a.提供孤电子对的成键原子是氧原子
b.微粒的化学性质发生了改变
c.微粒中氢氧键(H-O)的夹角未发生改变
d.在[V(H2O)6]2+中存在的化学键有配位键、σ键、π键和氢键
(5)某六方硫钒化合物晶体的晶胞如图甲所示,该晶胞的化学式为

您最近一年使用:0次



