解题方法
1 . 2021年我国科学家在高效且稳定的全无机CsPbX3(X=Cl,Br,I)太阳能电池研究领域取得进展。
(1)写出基态Pb原子的外围电子排布图______ ,基态Cs原子核外共有______ 种不同运动状态的电子。
(2)I-可与I2形成 ,
, 中心原于的价层电子对数为
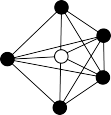
中心原于的价层电子对数为______ ,已知其VSEPR模型为三角双锥形(如图),则 的立体构型名称为
的立体构型名称为_______ 。
(3)化合物PCl5,、PBr5固态时均为离子晶体,其组成分别为[PCl4]+[PCl6]-、[PBr4]+Br-,分析PBr5中不存在类似[PCl6]-结构的原因:___________ 。
(4)卤素还可与金属形成丰富多彩的配合物,如与Pt(II)形成Pt(NH3)2Cl2.Pt(NH3)2Cl2有两种同分异构体(如图),其中顺铂是1969年发现的第一种具有抗癌活性的金属配合物,其配体为___________ ,推测在水中的溶解度顺铂___________ 反铂(填“>”或“<”)。

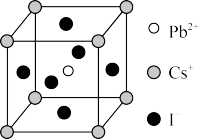
(5)CsPbI3晶体具有钙钛矿型的立方结构(如图),晶体中Cs+的配位数为___________ ,已知该晶体的密度为dg/cm3,阿伏加德罗常数值为NA,则晶胞参数a为___________ nm。
(6)CsPbI3晶胞结构的另一种表示中Cs+处于体心位置,则Pb2+处于______ 位置,I-处于______ 位置。
(1)写出基态Pb原子的外围电子排布图
(2)I-可与I2形成
 ,
, 中心原于的价层电子对数为
中心原于的价层电子对数为 的立体构型名称为
的立体构型名称为
(3)化合物PCl5,、PBr5固态时均为离子晶体,其组成分别为[PCl4]+[PCl6]-、[PBr4]+Br-,分析PBr5中不存在类似[PCl6]-结构的原因:
(4)卤素还可与金属形成丰富多彩的配合物,如与Pt(II)形成Pt(NH3)2Cl2.Pt(NH3)2Cl2有两种同分异构体(如图),其中顺铂是1969年发现的第一种具有抗癌活性的金属配合物,其配体为

(5)CsPbI3晶体具有钙钛矿型的立方结构(如图),晶体中Cs+的配位数为

(6)CsPbI3晶胞结构的另一种表示中Cs+处于体心位置,则Pb2+处于
您最近一年使用:0次
名校
2 . 1962年,青年化学家Bartlett发表了制成氟铂酸氙(XePtF6)的简报,震惊了化学界。
(1)Bartlett制备该稀有气体化合物的反应为Xe+PtF6=Xe+[PtF6]-,产物中阳离子的价电子排布式是__ ,阴离子中Pt和F之间的作用力为__ 。
(2)后来人们又合成了诸多氙的化合物,XeF4就是一种稳定的化合物。推测Xe和F的电负性大小:x(Xe)___ x(F)(填“<”或“>”)。XeF4能将全氟丙烯氟化为全氟丙烷:XeF4+2CF3CF=CF2→2CF3CF2CF3+Xe。在该反应中,部分碳原子的杂化方式由__ 变为__ 。
(3)XeF4可与水反应生成XeO3。判断XeO3的VSEPR模型名称为__ ,XeO3是__ (填“极性”或“非极性”)分子。任写一种与XeO3互为等电子体的离子:__ 。
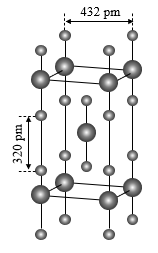
(4)XeF2为直线型分子,固态时XeF2晶体结构如图所示。该晶体的理论密度为4.30g/cm3,则Xe-F键长为___ pm。
(5)氙还能形成一些含氧酸盐,如高氙酸锂(Li4XeO6)、高氙酸钠(Na4XeO6)等,前者在约300℃分解为Li2O、Xe和O2,后者在360℃左右分解得类似产物。请解释它们分解温度高低差别的原因:__ 。
(6)研究者多用Xe来研究稀有气体化合物而少用Kr等其他稀有气体,是因为:__ 。
(1)Bartlett制备该稀有气体化合物的反应为Xe+PtF6=Xe+[PtF6]-,产物中阳离子的价电子排布式是
(2)后来人们又合成了诸多氙的化合物,XeF4就是一种稳定的化合物。推测Xe和F的电负性大小:x(Xe)
(3)XeF4可与水反应生成XeO3。判断XeO3的VSEPR模型名称为
(4)XeF2为直线型分子,固态时XeF2晶体结构如图所示。该晶体的理论密度为4.30g/cm3,则Xe-F键长为

(5)氙还能形成一些含氧酸盐,如高氙酸锂(Li4XeO6)、高氙酸钠(Na4XeO6)等,前者在约300℃分解为Li2O、Xe和O2,后者在360℃左右分解得类似产物。请解释它们分解温度高低差别的原因:
(6)研究者多用Xe来研究稀有气体化合物而少用Kr等其他稀有气体,是因为:
您最近一年使用:0次
名校
解题方法
3 . 据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______ (填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是_______ 。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:_________ ;用杂化轨道理论解释:_________ 。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是___________ 。1 mol [Cd(NH3)4]2+含___________ mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为__________ 。
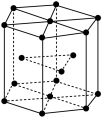
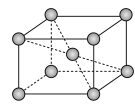
(5)锆晶胞如图所示,1个晶胞含_______ 个Zr原子;这种堆积方式称为__________ 。
(6)镉晶胞如图所示。已知:NA是阿伏加 德罗常数的值,晶体密度为 d g·cm-3。在该晶胞中两个镉原子最近核间距为______ nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________ (用含π的代数式表示)。
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为
(5)锆晶胞如图所示,1个晶胞含

(6)镉晶胞如图所示。已知:NA是阿伏加 德罗常数的值,晶体密度为 d g·cm-3。在该晶胞中两个镉原子最近核间距为

您最近一年使用:0次
2020-04-23更新
|
370次组卷
|
3卷引用:重庆市第一中学2019-2020学年高二下学期期末考试化学试题
名校
解题方法
4 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)元素F简单离子的价电子排布式为___________ ;写出元素G在周期表中的位置___________ 。
(2)B与氢元素形成的简单气态氢化物的空间构型为___________ ,C与氢元素形成的简单气态氢化物的VSEPR模型为___________ 。
(3)C、D、E三种元素的简单离子半径由大到小的顺序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为___________ 。
(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ 化合物(填“离子”或“共价”);M的最高价氧化物对应的水化物与NaOH溶液反应的化学方程式为___________ 。
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: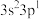 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)B与氢元素形成的简单气态氢化物的空间构型为
(3)C、D、E三种元素的简单离子半径由大到小的顺序为
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
5 . 现有五种元素A、B、C、D、E,其中A、B、C为三个不同周期的短周期元素,E为第四周期元素。请根据下列相关信息,回答下列问题:
(1)C基态原子中能量最高的电子,其电子云在空间有___________ 个方向,C简单离子核外有___________ 种运动状态不同的电子。
(2)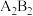 难溶于二硫化碳,简要说明理由
难溶于二硫化碳,简要说明理由___________ 。
(3)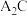 分子的空间构型为
分子的空间构型为___________ , 分子的VSEPR模型名称为
分子的VSEPR模型名称为___________ 。
(4)下列气态分子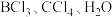 和
和 中,其键角由大到小的顺序为
中,其键角由大到小的顺序为___________ 。
| 元素 | 相关信息 |
| A | 核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 原子核外P电子数与s电子数相等 |
| C | 基态原子的价电子排布为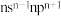 |
| D | 能层数与C相同,且电负性比C大 |
| E | 元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
(2)
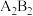 难溶于二硫化碳,简要说明理由
难溶于二硫化碳,简要说明理由(3)
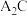 分子的空间构型为
分子的空间构型为 分子的VSEPR模型名称为
分子的VSEPR模型名称为(4)下列气态分子
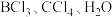 和
和 中,其键角由大到小的顺序为
中,其键角由大到小的顺序为
您最近一年使用:0次
名校
解题方法
6 . 硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式:________ 。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是__________ 。
(3)BF3分子中中心原子的杂化轨道类型是____ 。又知若有d轨道参与杂化,能大大提高中心原子的成键能力,分析BF3、SiF4水解的产物中, 除了相应的酸外,前者生成BF4-而后者生成SiF62-的原因:_______________ 。
(4)NaBH4被认为是有机化学中的“万能还原剂”,NaBH4的电子式为_________ ,其中三种元素的电负性由大到小的顺序是_______________ 。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 Na2B4O7•10H2O,实际上它的结构单元是由两个H3BO3和两个B(OH)4]-(合而成的双六元环,应该写成 Na2[B4O5(OH)4]•8H2O,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是______________ (填字母)。

A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
(6)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的_____ (填“立方体”“正四面体”或“正八面体”)空隙。建立如图所示坐标系,可得晶胞中A、C处原子的分数坐标,则N处的P原子分数坐标为______ 。若晶胞中硼原子和磷原子之间的最近核间距为a pm,则晶胞边长为____________ cm。
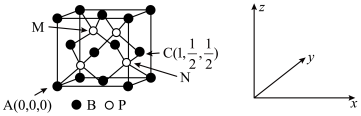
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式:
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是
(3)BF3分子中中心原子的杂化轨道类型是
(4)NaBH4被认为是有机化学中的“万能还原剂”,NaBH4的电子式为
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 Na2B4O7•10H2O,实际上它的结构单元是由两个H3BO3和两个B(OH)4]-(合而成的双六元环,应该写成 Na2[B4O5(OH)4]•8H2O,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是

A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
(6)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的

您最近一年使用:0次
2020-04-09更新
|
197次组卷
|
2卷引用:重庆巴蜀中学高2020届高三下学期3月月月考理综化学试题
名校
解题方法
7 . (1)基态溴原子的核外电子排布式为________ ,其核外电子所占用的最高能级电子云形状为_________ 。
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有_____ ,σ键与π键数目之比为______ 。
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是_____ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4) NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_______ 。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
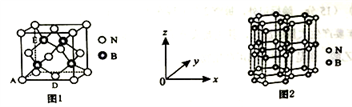
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0, 0),D为(0.5,0.5, 0),则E原子的坐标参数为________ 。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为___ pm.
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4) NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0, 0),D为(0.5,0.5, 0),则E原子的坐标参数为
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为
您最近一年使用:0次
名校
解题方法
8 . 锰酸锂(LiMn2O4) 可作为某锂离子电池的正极材料,工业上利用软锰矿浆(主要成分为 MnO2,含少量 Fe2O3、FeO、Al2O3、SiO2。等杂质)吸收含硫烟气(主要成分 SO2) 制备锰酸锂,生产流程如图所示:

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
(1)含硫烟气中 SO2的VSEPR模型为___________ 。
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是___________ 。
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:___________ 。
(4)滤液1中所含金属阳离子除 以外还有
以外还有___________ (填离子符号)。
(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入___________ ,再加入NaOH溶液调节pH范围为___________ ,过滤得到滤液 2 和滤渣,请设计实验方案由滤渣制得纯净 Al(OH)3[Al(OH)3在 pH≥12时溶解]的实验方案:___________ 。
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:___________ 。
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:
 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为___________ 。

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)含硫烟气中 SO2的VSEPR模型为
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:
(4)滤液1中所含金属阳离子除
 以外还有
以外还有(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:

 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为
您最近一年使用:0次
名校
解题方法
9 . 一种含Pt催化剂活化甲烷中碳氢键的反应机理如图所示。下列说法错误的是
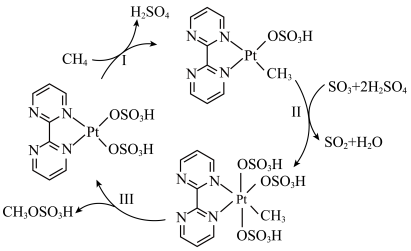

| A.反应II、III一定存在电子转移 |
| B.该过程涉及的氧化物均为含极性键的极性分子 |
| C.催化循环中含S的分子或离子VSEPR模型不完全相同 |
D.上述过程的总反应: |
您最近一年使用:0次



