名校
1 . 光伏材料又称太阳能材料,是指能将太阳能直接转换成电能的材料。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAlAs、InP、CdS 等。回答下列问题:
(1)基态Cr原子的价电子排布式为___________ 。
(2)原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为___________ 。
(3)基态P原子中电子占据的最高能层符号为___________ ; 的空间结构为
的空间结构为___________ 。
(4)砷化镓薄膜太阳能电池被用来为“天宫”空间站的核心舱供电。已知砷化镓的熔点为1238℃,其晶胞结构如下图所示。___________ 。
②该晶体的类型为___________ ;若晶胞密度为d  ,摩尔质量为M
,摩尔质量为M  ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为___________ nm(只列计算式)。
(1)基态Cr原子的价电子排布式为
(2)原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为(3)基态P原子中电子占据的最高能层符号为
 的空间结构为
的空间结构为(4)砷化镓薄膜太阳能电池被用来为“天宫”空间站的核心舱供电。已知砷化镓的熔点为1238℃,其晶胞结构如下图所示。
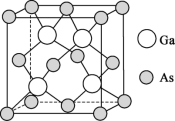
②该晶体的类型为
 ,摩尔质量为M
,摩尔质量为M  ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
您最近一年使用:0次
名校
解题方法
2 . 根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:___________ ,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是 ,该元素的名称是
,该元素的名称是___________ 。
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:
___________ ,
___________ 。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式___________ 、___________ 。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为___________ ;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为___________ 。
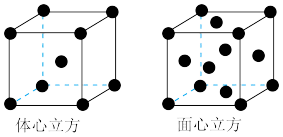
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:
 ,该元素的名称是
,该元素的名称是(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:


(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为

您最近一年使用:0次
解题方法
3 . 铁在人类物质文明的发展进程中起到重要的作用。回答下列问题:
(1)人体血液中含有铁元素,其存在形式的基态电子排布式为_______ 。
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在,其中Fe采取的杂化类型为_______ ,固态FeCl3的晶体类型为_______ 。
(3)Fe能与CO形成配合物Fe(CO)5。该配合物分子中有_______ 个σ键和_______ 个π键,所含三种元素原子的第一电离能从大到小的顺序为:_______ ,CH4的键角比H2O大的原因是:_______ 。
(4)Fe3+离子和K4[Fe(CN)6]反应生成蓝色沉淀,被称为普鲁士蓝,普鲁士蓝颜色很深,原因是_______ ,其晶体部分结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),Fe3+在晶体中的配位数是_______ ,已知图示立方体边长为a pm,则该晶体密度为_______ g·cm-3(写出表达式,用NA表示阿伏加德罗常数的值)。
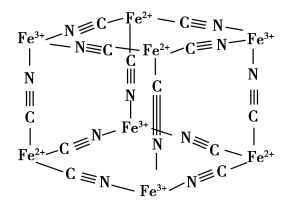
(1)人体血液中含有铁元素,其存在形式的基态电子排布式为
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在,其中Fe采取的杂化类型为
(3)Fe能与CO形成配合物Fe(CO)5。该配合物分子中有
(4)Fe3+离子和K4[Fe(CN)6]反应生成蓝色沉淀,被称为普鲁士蓝,普鲁士蓝颜色很深,原因是

您最近一年使用:0次
名校
解题方法
4 . 锂离子电池已破广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯无水溶液作电解液。回答下列问题:
(1)基态锂原子的电子排布图为________ 。基态磷原子子中,电子占据的最高能层符号为_____________ 。
(2)PO 的空间构型为
的空间构型为_______________ 。
(3)[Co(NH3)3Cl3]中Co3+的配位数为6,该配合物中的配位原子为____________ 。
(4)碳酸二乙酯的分子结构如图1所示,分子中所含元素的电负性由小到大的顺序为_____ ,分子中碳原子的杂化轨道类型为____ ,1 mol碳酸二乙酯中含有σ键的数目为_____ NA(NA为阿伏加德罗常数的值)。

(5)在元素周期表中,铁元素位于____ 区(填“s”“p”“d”或“ds”)。γ—Fe 的堆积方式如图2所示,其空间利用率为________ (用含π的式子表示)。
(6)氮化锂是一种新型无机贮氢材料,如图3所示,该晶体的化学式为____________ 。
(1)基态锂原子的电子排布图为
(2)PO
 的空间构型为
的空间构型为(3)[Co(NH3)3Cl3]中Co3+的配位数为6,该配合物中的配位原子为
(4)碳酸二乙酯的分子结构如图1所示,分子中所含元素的电负性由小到大的顺序为

(5)在元素周期表中,铁元素位于
(6)氮化锂是一种新型无机贮氢材料,如图3所示,该晶体的化学式为
您最近一年使用:0次
2020-12-31更新
|
231次组卷
|
3卷引用:安徽省皖南八校2021届高三第二次联考(12月)理综合化学试题
名校
解题方法
5 . Fe、C、N、O元素是与生命活动密不可分的元素,请回答下列问题:
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。已知N2O分子中氧原子只与一个氮原子相连,则N2O的分子空间构型是________ 。
(2)另一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2=2HCl+2COCl2,光气(COCl2)分子的空间构型是________ 。
(3)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。以下关于维生素C的说法正确的是________ (填字母序号)。
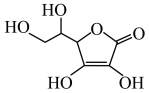
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有4 mol π键
c.该物质的熔点可能高于NaCl
d.分子中所含元素电负性由大到小的顺序为O>C>H
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(4)已知尿素的结构简式为H2NCONH2,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
①基态Fe3+的核外电子排布式为____________ 。
C、N、O三种元素的第一电离能由大到小的顺序是________ 。
②尿素分子中C原子和N原子的杂化方式分别是__________ 。
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(+3价)之间的作用力称为__________ ,与 互为等电子体的一种化合物分子是
互为等电子体的一种化合物分子是____________ (写化学式)。
(5)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构简式为

①以下关于维生素B1的说法正确的是________ (填字母序号,下同)。
A.只含σ键和π键 B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl D.该物质易溶于盐酸
②维生素B1晶体溶于水的过程中要克服的微粒间作用力有________ 。
A.离子键、共价键 B.离子键、氢键、共价键
C.氢键、范德华力 D.离子键、氢键、范德华力
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。已知N2O分子中氧原子只与一个氮原子相连,则N2O的分子空间构型是
(2)另一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2=2HCl+2COCl2,光气(COCl2)分子的空间构型是
(3)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。以下关于维生素C的说法正确的是

a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有4 mol π键
c.该物质的熔点可能高于NaCl
d.分子中所含元素电负性由大到小的顺序为O>C>H
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(4)已知尿素的结构简式为H2NCONH2,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
①基态Fe3+的核外电子排布式为
C、N、O三种元素的第一电离能由大到小的顺序是
②尿素分子中C原子和N原子的杂化方式分别是
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(+3价)之间的作用力称为
 互为等电子体的一种化合物分子是
互为等电子体的一种化合物分子是(5)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构简式为

①以下关于维生素B1的说法正确的是
A.只含σ键和π键 B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl D.该物质易溶于盐酸
②维生素B1晶体溶于水的过程中要克服的微粒间作用力有
A.离子键、共价键 B.离子键、氢键、共价键
C.氢键、范德华力 D.离子键、氢键、范德华力
您最近一年使用:0次
名校
解题方法
6 . 已知X.Y和Z三种元素的原子序数之和等于42,X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,请回答下列问题:
(1)X元素的原子结构示意图为_______ ;
(2)Y元素原子基态时的电子排布式为________ ;
(3)X与Z可形成化合物XZ3,该分子的VSEPR模型名称_____ ,该分子的立体构型名称_____ ;
(4)Z原子的电子云是_____ 形,电子云图上的黑点稠密,表明单位体积内电子_________ 。
(1)X元素的原子结构示意图为
(2)Y元素原子基态时的电子排布式为
(3)X与Z可形成化合物XZ3,该分子的VSEPR模型名称
(4)Z原子的电子云是
您最近一年使用:0次
名校
解题方法
7 . X、Y、Z、W是原子序数依次增大的前四周期元素。其中X是形成化合物种类最多的元素,Y原子基态时2p原子轨道上有3个未成对的电子,Z单质占空气体积的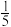 ,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的电负性从大到小的顺序是___ (用元素符号表示,下同),三种元素的第一电离能由大到小的顺序为______ 。
(2)写出X的电子排布式_____ 。
(3)W同周期的元素中,与W原子最外层电子数相等的元素还有_____ 。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是____ (用化学式表示),原因是_________ 。
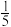 ,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
,W的内层电子全充满,最外层只有1个电子。请回答下列问题:(1)X、Y、Z的电负性从大到小的顺序是
(2)写出X的电子排布式
(3)W同周期的元素中,与W原子最外层电子数相等的元素还有
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是
您最近一年使用:0次



