解题方法
1 . 元素A、B、C、D、E、F、G在元素周期表中的位置如图所示,回答下列问题:
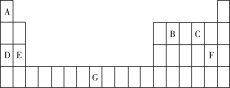
(1)G的基态原子价层电子排布式为_______ 。原子的第一电离能:D_____ E(填“>”或“<”)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l—l>l—b>b—b(l为孤对电子对,b为键合电子对),则关于A2C中的A—C—A键角可得出的结论是________。
(3)化合物G(BC)5的熔点为-20℃,沸点为103℃,其固体属于_______ 晶体,该物质中存在的化学键类型有_________ 。
(4)化合物BCF2的立体构型为________ ,其中B原子的杂化轨道类型是________ 。
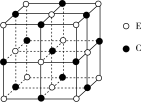
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。则EC晶体的密度(g·cm-3)_______ 。(写出表达式)


(1)G的基态原子价层电子排布式为
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l—l>l—b>b—b(l为孤对电子对,b为键合电子对),则关于A2C中的A—C—A键角可得出的结论是________。
| A.180° | B.接近120°,但小于120° |
| C.接近120°,但大于120° | D.接近109°28’,但小于109°28’ |
(4)化合物BCF2的立体构型为
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。则EC晶体的密度(g·cm-3)
您最近一年使用:0次
名校
解题方法
2 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵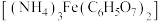 。
。
(1)Fe基态核外电子排布式为_______ ; 中与
中与 配位的原子是
配位的原子是_______ (填元素符号)。
(2) 分子中氮原子的轨道杂化类型是
分子中氮原子的轨道杂化类型是_______ ;C、N、O元素的第一电离能由大到小的顺序为_______ 。
(3)与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填化学式)。
(4)柠檬酸的结构简式如图。1mol柠檬酸分子中碳原子与氧原子形成的 键的数目为
键的数目为_______ mol。

(5)偏铝酸钠中阴离子的空间构型_______ 。
(6)氮化硼晶体的晶胞结构与金刚石晶体的晶胞结构相同,氮化硼晶体的密度为pg/cm3,阿伏加德罗常数为NA值,氮化硼的摩尔质量为mg/mol,则氮化硼晶体的体积_______ cm3。
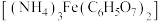 。
。(1)Fe基态核外电子排布式为
 中与
中与 配位的原子是
配位的原子是(2)
 分子中氮原子的轨道杂化类型是
分子中氮原子的轨道杂化类型是(3)与
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)柠檬酸的结构简式如图。1mol柠檬酸分子中碳原子与氧原子形成的
 键的数目为
键的数目为
(5)偏铝酸钠中阴离子的空间构型
(6)氮化硼晶体的晶胞结构与金刚石晶体的晶胞结构相同,氮化硼晶体的密度为pg/cm3,阿伏加德罗常数为NA值,氮化硼的摩尔质量为mg/mol,则氮化硼晶体的体积
您最近一年使用:0次
2019高三下·全国·专题练习
名校
解题方法
3 . 钇钡铜氧(YBa2Cu3O7-x)是一种高温超导材料(其中Y显+3价,Cu显+2、+3价),最早是将BaCO3、Y2(CO3)3和CuCO3混合在高温下反应制备的。
请回答下列问题:
(1)Y(钇)是一种重要的稀土金属,与Sc(钪)同族相邻。则Y原子核外有___________ 个价电子。Y位于元素周期表的___________ 区。
(2)在BaCO3中,CO32-的空间构型为___________ ,C原子采取___________ 杂化;BaCO3、CaCO3受热分解分别生成BaO、CaO,BaO、CaO熔点较高的是___________ (填化学式)。
(3)基态Cu3+的核外电子排布式为___________ 。
(4)若YBa2Cu3O7-x(0≤x≤0.5)材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=___________ 。
(5)铜有两种氧化物:CuO和Cu2O,后者比前者的热稳定性强,原因是___________ 。
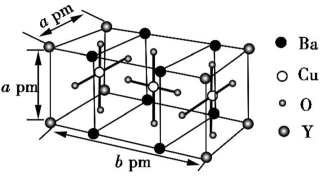
(6)如图是某种超导材料A的晶胞结构示意图,其化学式为___________ 。若A的摩尔质量为M g·mol-1,阿伏伽德罗常数的值为NA,晶胞参数为apm、apm、bpm,则晶体的密度为___________ g·cm-3。
请回答下列问题:
(1)Y(钇)是一种重要的稀土金属,与Sc(钪)同族相邻。则Y原子核外有
(2)在BaCO3中,CO32-的空间构型为
(3)基态Cu3+的核外电子排布式为
(4)若YBa2Cu3O7-x(0≤x≤0.5)材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=
(5)铜有两种氧化物:CuO和Cu2O,后者比前者的热稳定性强,原因是
(6)如图是某种超导材料A的晶胞结构示意图,其化学式为

您最近一年使用:0次
4 . 钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________ ;K、F、Zn的电负性从大到小的顺序为___________ 。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________ 。
(3)OF2分子的几何构型为___________ ,中心原子的杂化类型为___________ 。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________ ;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。
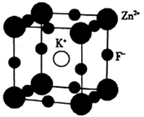
①晶胞中Zn2+的配位数为___________ 个。
②晶胞中紧邻的两个F-间的距离为_______________________ (列出算式即可)nm。
③该晶体的密度为___________ (列出算式即可,用NA表示阿伏伽德罗常数的数值)g·cm-3。
(1)基态锌原子的价电子排布式为
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是
(3)OF2分子的几何构型为
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为
②晶胞中紧邻的两个F-间的距离为
③该晶体的密度为
您最近一年使用:0次
2018-01-07更新
|
409次组卷
|
6卷引用:西藏拉萨市拉萨中学2022届高三上学期第一次月考理综化学试题
5 . X、Y、Z、U、W是原子序数依次增大的前四周期元素。其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的第一电离能从大到小的顺序是_____________ (用元素符号表示,下同)。
(2)写出W的价电子排布式__________________________ ,W同周期的元素中,与W原子最外层电子数相等的元素还有_____________ 。
(3)X、Y、Z的简单氢化物的键角从大到小的顺序是__________________________ (用化学式表示),原因是__________________________ 。
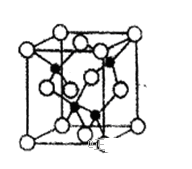
(4)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式_____________ ,该物质硬度大,推测该物质为_____________ 晶体。其中Y元素的杂化方式是_____________ 。
(1)X、Y、Z的第一电离能从大到小的顺序是
(2)写出W的价电子排布式
(3)X、Y、Z的简单氢化物的键角从大到小的顺序是
(4)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式

您最近一年使用:0次



