名校
1 . 如图是元素周期表的一部分:
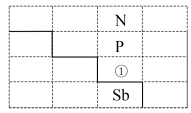
(1)写出元素①的元素符号___________ ,与①同周期的主族元素中,第一电离能比①大的有___________ 种。该周期的某种元素基态原子的核外电子排布式为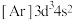 ,则该元素在元素周期表中的位置为
,则该元素在元素周期表中的位置为___________ 。
(2)基态锑(Sb)原子的价电子排布式为___________ 。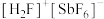 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 离子的空间构型为
离子的空间构型为___________ ,写出一种与 互为等电子体的分子
互为等电子体的分子___________ 。
(3)锂电池被广泛应用于储能电源系统。军事等领域。下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___________ 、___________ (填标号)。
A. B.
B.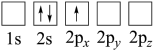
C.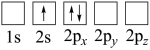 D.
D.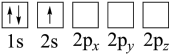
(4)已知基态W原子的价层电子排布式为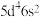 ,与基态Cr原子相比,基态W原子与基态Cr原子的未成对电子数之比为
,与基态Cr原子相比,基态W原子与基态Cr原子的未成对电子数之比为___________ 。
(5)基态Cu原子电子占据的最高能层的符号为________ ,基态Cu原子电子有_________ 种空间运动状态。

(1)写出元素①的元素符号
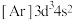 ,则该元素在元素周期表中的位置为
,则该元素在元素周期表中的位置为(2)基态锑(Sb)原子的价电子排布式为
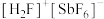 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 离子的空间构型为
离子的空间构型为 互为等电子体的分子
互为等电子体的分子(3)锂电池被广泛应用于储能电源系统。军事等领域。下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B.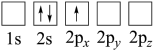
C.
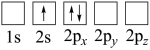 D.
D.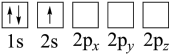
(4)已知基态W原子的价层电子排布式为
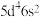 ,与基态Cr原子相比,基态W原子与基态Cr原子的未成对电子数之比为
,与基态Cr原子相比,基态W原子与基态Cr原子的未成对电子数之比为(5)基态Cu原子电子占据的最高能层的符号为
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)在周期表中,与Li化学性质最相似的邻族元素是_______ 。
(2) 的空间结构为
的空间结构为_______ 形,其中心原子的杂化轨道类型为_______ 。
(3)NH4H2PO4中,电负性最高的元素是_______ ;P的_____ 杂化轨道与O的2p轨道形成____ 键(填σ或π)。
(4)PH3和NH3相比,_______ 更易液化;原因_______ 。
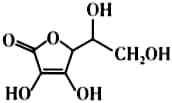
(5)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为_______ ;推测抗坏血酸在水中的溶解性:______ (填“难溶于水”或“易溶于水”)。
(1)在周期表中,与Li化学性质最相似的邻族元素是
(2)
 的空间结构为
的空间结构为(3)NH4H2PO4中,电负性最高的元素是
(4)PH3和NH3相比,
(5)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为

您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
(1)根据价层电子对互斥理论,当价层电子对数为5时,轨道形状为三角双锥形,孤电子对数不同则分子空间结构不同,孤电子对数为1、2、3时,对应的分子或离子空间结构分别为变形四面体、 形、直线形,则
形、直线形,则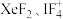 的空间构型分别为
的空间构型分别为_______ 、_______ 。
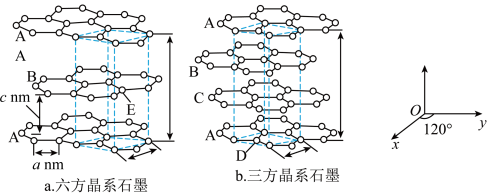
(2)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图a所示,图中用虚线标出了石墨的一个六方晶胞。若按 方式堆积而成,则如图
方式堆积而成,则如图 所示,图中用虚线标出了石墨的一个三方晶胞。
所示,图中用虚线标出了石墨的一个三方晶胞。 原子的分数坐标为
原子的分数坐标为_______ 。该六方石墨晶体的密度为_______  。
。
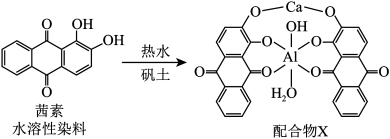
配合物在许多尖端领域如激光材料、超导材料、抗癌药物的研究、催化剂的研制、自组装超分子等方面有广泛的应用。回答下列问题:
(3)茜草中的茜素与 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。
配合物 中
中 的配体除
的配体除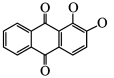 外还有
外还有_______ ,茜素水溶性较好的主要原因是_______ 。
(4)向 溶液中滴加
溶液中滴加 溶液后,经提纯、结晶可得到
溶液后,经提纯、结晶可得到 普鲁士蓝蓝色晶体。实验表明,
普鲁士蓝蓝色晶体。实验表明, 通过配位键构成了晶体的骨架。其局部结构如图1,记为I型立方结构。将I型立方结构平移、旋转、并置,可得到晶体的晶胞(如图2,记为II型立方结构,下层左后的小立方体
通过配位键构成了晶体的骨架。其局部结构如图1,记为I型立方结构。将I型立方结构平移、旋转、并置,可得到晶体的晶胞(如图2,记为II型立方结构,下层左后的小立方体 未标出)。
未标出)。
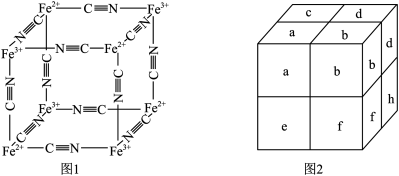
①可溶性氧化物(如 )有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因是
)有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因是_______ 。
②若 位于II型立方结构的棱心和体心上,则
位于II型立方结构的棱心和体心上,则 位于II型立方结构的
位于II型立方结构的_______ 上;若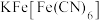 的摩尔质量为
的摩尔质量为 ,该蓝色晶体密度为
,该蓝色晶体密度为 ,II型立方结构的边长为
,II型立方结构的边长为 ,则阿伏加德罗常数的值可表示为
,则阿伏加德罗常数的值可表示为_______ 。
(1)根据价层电子对互斥理论,当价层电子对数为5时,轨道形状为三角双锥形,孤电子对数不同则分子空间结构不同,孤电子对数为1、2、3时,对应的分子或离子空间结构分别为变形四面体、
 形、直线形,则
形、直线形,则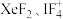 的空间构型分别为
的空间构型分别为(2)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图a所示,图中用虚线标出了石墨的一个六方晶胞。若按
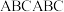 方式堆积而成,则如图
方式堆积而成,则如图 所示,图中用虚线标出了石墨的一个三方晶胞。
所示,图中用虚线标出了石墨的一个三方晶胞。 原子的分数坐标为
原子的分数坐标为 。
。
配合物在许多尖端领域如激光材料、超导材料、抗癌药物的研究、催化剂的研制、自组装超分子等方面有广泛的应用。回答下列问题:
(3)茜草中的茜素与
 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。
配合物
 中
中 的配体除
的配体除 外还有
外还有(4)向
 溶液中滴加
溶液中滴加 溶液后,经提纯、结晶可得到
溶液后,经提纯、结晶可得到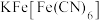 普鲁士蓝蓝色晶体。实验表明,
普鲁士蓝蓝色晶体。实验表明, 通过配位键构成了晶体的骨架。其局部结构如图1,记为I型立方结构。将I型立方结构平移、旋转、并置,可得到晶体的晶胞(如图2,记为II型立方结构,下层左后的小立方体
通过配位键构成了晶体的骨架。其局部结构如图1,记为I型立方结构。将I型立方结构平移、旋转、并置,可得到晶体的晶胞(如图2,记为II型立方结构,下层左后的小立方体 未标出)。
未标出)。
①可溶性氧化物(如
 )有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因是
)有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因是②若
 位于II型立方结构的棱心和体心上,则
位于II型立方结构的棱心和体心上,则 位于II型立方结构的
位于II型立方结构的 的摩尔质量为
的摩尔质量为 ,该蓝色晶体密度为
,该蓝色晶体密度为 ,II型立方结构的边长为
,II型立方结构的边长为 ,则阿伏加德罗常数的值可表示为
,则阿伏加德罗常数的值可表示为
您最近一年使用:0次
2023-11-04更新
|
355次组卷
|
2卷引用:河南省信阳高级中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
4 . 近日,《自然一通讯》发表了我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(如图),每个顶点为一个硼原子,每个三角形均为等边三角形,则每一个此基本结构单元由___________ 个硼原子构成。

(2)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子的空间构型为___________ ,Na在空气中燃烧产生黄色火焰,这种黄色焰色用光谱仪摄取的光谱为___________ 光谱(填“发射”或“吸收”)。
(3)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,请解释的键角比的键角大的原因:___________ 。
(4)立方氮化硼属于原子晶体,其晶胞结构如图1所示,可认为氮原子处于硼原子围成的某种空隙中,则氮原子处于硼原子围成的___________ (填空间结构)空隙中。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“•”标明N的相对位置___________ 。
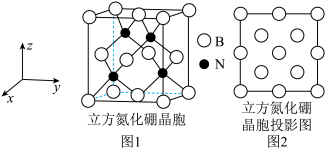
已知立方氮化硼的密度为dg⋅cm-3,阿伏加德罗常数的值为NA,则晶胞中硼原子与氮原子的最近距离为___________ nm。(只要求列算式)
(1)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(如图),每个顶点为一个硼原子,每个三角形均为等边三角形,则每一个此基本结构单元由

(2)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子的空间构型为
(3)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,请解释的键角比的键角大的原因:
(4)立方氮化硼属于原子晶体,其晶胞结构如图1所示,可认为氮原子处于硼原子围成的某种空隙中,则氮原子处于硼原子围成的

已知立方氮化硼的密度为dg⋅cm-3,阿伏加德罗常数的值为NA,则晶胞中硼原子与氮原子的最近距离为
您最近一年使用:0次
名校
解题方法
5 . 根据要求回答问题。
(1)基态锰原子的价电子排布式为___________ ,第四周期元素的基态原子核外单电子数与基态钴原子相同的是___________ (填元素符号)。
(2)Cu、Fe的第二电离能: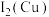
___________ 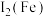 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(3)氧和硫同族,但是它们简单氢化物的键角不同,原因是___________ 。
(4)氧和同族元素能形成多种化合物,如 、
、 ,二者分子中S和Se的价层电子对数分别为
,二者分子中S和Se的价层电子对数分别为___________ 、___________ 。
(5)基态Mo原子的价电子排布为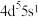 ,其位于元素周期表
,其位于元素周期表___________ 区,最高化合价为___________ 。
(1)基态锰原子的价电子排布式为
(2)Cu、Fe的第二电离能:
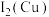
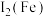 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(3)氧和硫同族,但是它们简单氢化物的键角不同,原因是
(4)氧和同族元素能形成多种化合物,如
 、
、 ,二者分子中S和Se的价层电子对数分别为
,二者分子中S和Se的价层电子对数分别为(5)基态Mo原子的价电子排布为
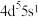 ,其位于元素周期表
,其位于元素周期表
您最近一年使用:0次
6 . 短周期元素X、Y、Z、M、T、R在元素周期表中的相对位置如图所示,请回答下列问题:
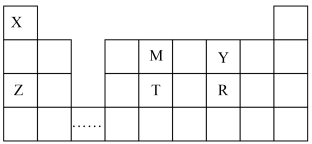
(1)元素X、M、Y的电负性由大到小的顺序为_______ (用元素符号表示)。
(2)T形成的单质的晶体类型为_______ 。
(3)基态R原子中,其电子占据的最高能层的符号为_______ ;基态Z离子占据的最高能级共有_______ 个原子轨道。
(4)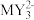 离子的空间构型为
离子的空间构型为_______ 。
(5)从原子轨道重叠方式分类,化合物M2X4中M、M之间的 键类型为_______(填序号)。
键类型为_______(填序号)。

(1)元素X、M、Y的电负性由大到小的顺序为
(2)T形成的单质的晶体类型为
(3)基态R原子中,其电子占据的最高能层的符号为
(4)
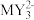 离子的空间构型为
离子的空间构型为(5)从原子轨道重叠方式分类,化合物M2X4中M、M之间的
 键类型为_______(填序号)。
键类型为_______(填序号)。| A.s-p | B.p-P | C.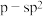 | D. |
您最近一年使用:0次
名校
解题方法
7 . X、Y、Z、W、M是原子序数依次增大的5种短周期元素。非金属元素X的核外电子数等于其周期数;Y与M的基态原子的未成对电子数均为2,且两者的最简单氢化物的空间结构均为V形;Z元素的电负性是同周期中最大的;W元素原子核外s能级上的电子总数与p能级上的电子总数相等。请回答下列问题:
(1)Y、Z、W、M的简单离子半径由大到小的顺序为_______ (填离子符号)。
(2)X、Y、Z、W的电负性由大到小的顺序为_______ (填元素符号,下同)。
(3)Z与M相比第一电离能比较大的是_______ ,其基态原子的电子排布式为_______ 。
(4) 的空间结构为
的空间结构为_______ ,其晶体类型为_______ 。
(5)X~M中某种元素的部分电离能(用 、
、 ……表示,单位
……表示,单位 )数据如表:
)数据如表:
①由此可判断该元素是_______ (填元素符号),其最高正价为_______ 。
②该元素的电离能越来越大的原因是_______ 。
(1)Y、Z、W、M的简单离子半径由大到小的顺序为
(2)X、Y、Z、W的电负性由大到小的顺序为
(3)Z与M相比第一电离能比较大的是
(4)
 的空间结构为
的空间结构为(5)X~M中某种元素的部分电离能(用
 、
、 ……表示,单位
……表示,单位 )数据如表:
)数据如表:| I |  |  |  |  | …… |
| 电离能 | 738 | 1451 | 7733 | 10540 |
②该元素的电离能越来越大的原因是
您最近一年使用:0次
名校
解题方法
8 . ⅥA族元素在生产、生活中有着重要的应用。
(1)臭氧分子是___________ (填“极性”或“非极性”)分子。
(2) 溶液中滴加氨水,
溶液中滴加氨水, 最终转化为
最终转化为 。
。 中含有
中含有___________ mol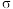 键,
键, 转化为
转化为 的原因为
的原因为___________ 。
(3)①As、Se、Br的第一电离能由小到大的顺序:___________ ,原因:___________ ;电负性由小到大的顺序:___________ ;
②热的浓硒酸可以溶解单质金,产生红黄色的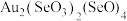 (Au为+3价),这种红黄色物质中Se元素的杂化方式为
(Au为+3价),这种红黄色物质中Se元素的杂化方式为___________ 。
(4)①基态Te原子电子排布式为___________ ;
②碲酸 中除了Te元素外只有羟基基团,
中除了Te元素外只有羟基基团, 的空间构型:
的空间构型:___________ ;
③第三代太阳能电池就是铜镓硒等化合物薄膜太阳能电池,其中一种结构如图所示:
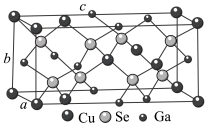
已知晶胞参数为anm、bnm、cnm。则晶体的密度为___________  。
。
(1)臭氧分子是
(2)
 溶液中滴加氨水,
溶液中滴加氨水, 最终转化为
最终转化为 。
。 中含有
中含有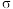 键,
键, 转化为
转化为 的原因为
的原因为(3)①As、Se、Br的第一电离能由小到大的顺序:
②热的浓硒酸可以溶解单质金,产生红黄色的
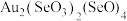 (Au为+3价),这种红黄色物质中Se元素的杂化方式为
(Au为+3价),这种红黄色物质中Se元素的杂化方式为(4)①基态Te原子电子排布式为
②碲酸
 中除了Te元素外只有羟基基团,
中除了Te元素外只有羟基基团, 的空间构型:
的空间构型:③第三代太阳能电池就是铜镓硒等化合物薄膜太阳能电池,其中一种结构如图所示:

已知晶胞参数为anm、bnm、cnm。则晶体的密度为
 。
。
您最近一年使用:0次
名校
解题方法
9 . 我国科技工作者利用计算机技术,预测了超硬钨氮化合物( )并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。
)并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。
(1)区分 是否为晶体的最可靠的科学方法为
是否为晶体的最可靠的科学方法为_______ 。
(2)已知基态W原子的价层电子排布式为 ,则基态W原子核外最外层电子占据的能层符号是
,则基态W原子核外最外层电子占据的能层符号是_______ ;与基态 原子相比,基态W原子与基态
原子相比,基态W原子与基态 原子的未成对电子数之比为
原子的未成对电子数之比为_______ 。
(3)常见的含氮微粒有 、
、 、
、 、
、 、
、 等。
等。
① 的组成元素中,电负性最大的元素是
的组成元素中,电负性最大的元素是_______ (填元素符号,下同);第一电离能最大的元素是_______ 。
② 中心原子的杂化类型为
中心原子的杂化类型为_______ ; 的空间构型为
的空间构型为_______ 。
③已知 中存在一个大π键,可用符号
中存在一个大π键,可用符号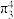 表示(3表示原子数,4表示参与形成大π键的p电子数),则一个
表示(3表示原子数,4表示参与形成大π键的p电子数),则一个 中键合电子(形成化学键的电子)的总数为
中键合电子(形成化学键的电子)的总数为_______ 。
④ 在水中的溶解性比
在水中的溶解性比 大很多,其主要原因是
大很多,其主要原因是_______ 。
(4)磷化硼(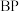 )是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设
)是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设 表示阿伏加德罗常数的值,则磷化硼晶体的密度为
表示阿伏加德罗常数的值,则磷化硼晶体的密度为_______  (用含a、
(用含a、 的计算式表示)。
的计算式表示)。

 )并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。
)并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。(1)区分
 是否为晶体的最可靠的科学方法为
是否为晶体的最可靠的科学方法为(2)已知基态W原子的价层电子排布式为
 ,则基态W原子核外最外层电子占据的能层符号是
,则基态W原子核外最外层电子占据的能层符号是 原子相比,基态W原子与基态
原子相比,基态W原子与基态 原子的未成对电子数之比为
原子的未成对电子数之比为(3)常见的含氮微粒有
 、
、 、
、 、
、 、
、 等。
等。①
 的组成元素中,电负性最大的元素是
的组成元素中,电负性最大的元素是②
 中心原子的杂化类型为
中心原子的杂化类型为 的空间构型为
的空间构型为③已知
 中存在一个大π键,可用符号
中存在一个大π键,可用符号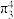 表示(3表示原子数,4表示参与形成大π键的p电子数),则一个
表示(3表示原子数,4表示参与形成大π键的p电子数),则一个 中键合电子(形成化学键的电子)的总数为
中键合电子(形成化学键的电子)的总数为④
 在水中的溶解性比
在水中的溶解性比 大很多,其主要原因是
大很多,其主要原因是(4)磷化硼(
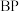 )是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设
)是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设 表示阿伏加德罗常数的值,则磷化硼晶体的密度为
表示阿伏加德罗常数的值,则磷化硼晶体的密度为 (用含a、
(用含a、 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
2022-06-15更新
|
129次组卷
|
2卷引用:河南省南阳市2022-2023学年高二下学期期末考试化学试题



