解题方法
1 . 请按要求完成填空:
(1)完成下表中的空白:
(2)配合物[Cu(NH3)4]SO4的中心离子是___________ 、配体是___________ 、配位原子是___________ 、配位数是___________ 。
(1)完成下表中的空白:
| 粒子 | 中心原子孤电子对数 | 中心原子的杂化轨道类型 | VSEPR模型 | 空间结构 |
| CO2 | ① | ② | ③ | ④ |
SO | ⑤ | ⑥ | ⑦ | ⑧ |
您最近一年使用:0次
名校
解题方法
2 . 磷及其化合物在工业生产中起着重要的作用。
(1)基态磷原子的价层电子排布图为
___________ 。
(2)磷元素有白磷、黑磷等常见的单质。黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是
___________ (填字母序号)。
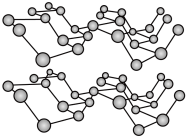
a.黑磷与白磷互为同素异形体 b.层与层之间的作用力是共价键
c.黑磷晶体属于混合型晶体 d.分子中磷原子杂化类型为 杂化
杂化
(3) 与水会形成黄色的配离子
与水会形成黄色的配离子
 ,为避免颜色干扰,常在
,为避免颜色干扰,常在
 溶液中加入
溶液中加入
 形成无色的
形成无色的
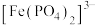 。由此推测,与
。由此推测,与
 能形成更稳定配离子的配体是
能形成更稳定配离子的配体是
___________ ,其空间结构是
___________ 。
(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟(InP)的熔点分别为2000、1070℃,二者属于___________ 晶体,其熔点差异的主要原因是___________ 。
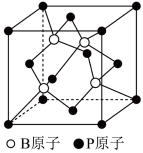
②磷化硼是一种半导体材料,其晶胞结构如图所示。已知晶胞边长apm,阿伏加德罗常数为 ,则磷化硼晶体的密度是
,则磷化硼晶体的密度是___________  (列出表达式)。
(列出表达式)。
(1)基态磷原子的价层电子排布图为
(2)磷元素有白磷、黑磷等常见的单质。黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是

a.黑磷与白磷互为同素异形体 b.层与层之间的作用力是共价键
c.黑磷晶体属于混合型晶体 d.分子中磷原子杂化类型为
 杂化
杂化(3)
 与水会形成黄色的配离子
与水会形成黄色的配离子 ,为避免颜色干扰,常在
,为避免颜色干扰,常在 溶液中加入
溶液中加入 形成无色的
形成无色的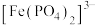 。由此推测,与
。由此推测,与 能形成更稳定配离子的配体是
能形成更稳定配离子的配体是(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟(InP)的熔点分别为2000、1070℃,二者属于
②磷化硼是一种半导体材料,其晶胞结构如图所示。已知晶胞边长apm,阿伏加德罗常数为
 ,则磷化硼晶体的密度是
,则磷化硼晶体的密度是 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
名校
解题方法
3 . 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的核外电子排布式是___________ 。
(2)N原子的第一电离能比O原子的第一电离能要大,可能原因是___________ 。
(3)NH3分子的VSEPR模型名称是___________ 。
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
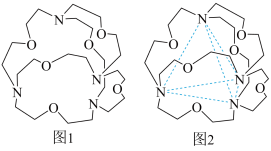
下列分子或离子中,能被该有机化合物识别的是___________(填标号)。
(5)下列说法正确的是___________。
(1)基态氮原子的核外电子排布式是
(2)N原子的第一电离能比O原子的第一电离能要大,可能原因是
(3)NH3分子的VSEPR模型名称是
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是___________(填标号)。
A. | B. | C. | D. |
| A.NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 |
| B.HCN的分子结构为直线形 |
C. 离子的VSEPR模型与空间结构是一致的 离子的VSEPR模型与空间结构是一致的 |
| D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
您最近一年使用:0次
名校
解题方法
4 . 下列有关分子空间结构的说法正确的是
A. 、 、 、 、 分子中所有原子的最外层电子都满足8电子稳定结构 分子中所有原子的最外层电子都满足8电子稳定结构 |
B. 与 与 的VSEPR模型均呈四面体形 的VSEPR模型均呈四面体形 |
C. 、 、 、 、 与 与 四种粒子的中心原子杂化轨道类型相同,且其中容纳的孤电子对数相等 四种粒子的中心原子杂化轨道类型相同,且其中容纳的孤电子对数相等 |
D. 中存在离子键、极性键、氢键等化学键 中存在离子键、极性键、氢键等化学键 |
您最近一年使用:0次
2023-07-12更新
|
243次组卷
|
4卷引用:湖北省恩高芳华中学2022-2023学年高二上学期期末考试化学试卷
名校
解题方法
5 . 中国早在周朝已能冶炼铸铁了。目前,铁及其化合物广泛地应用到各个领域。请回答下列问题:
(1)基态铁原子的电子排布式为_______ 。
(2)我国菱铁矿FeCO3储量较为丰富。其中CO 的空间结构为
的空间结构为_______ 。
(3)草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如下,碳原子的杂化方式是_______ 。
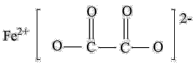
(4)Fe(CO)5溶于汽油、苯、丙酮等有机溶剂,熔点、沸点分别在-20℃、103.6℃左右。因此可知Fe(CO)5属于_______ 晶体。
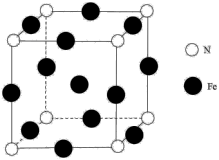
(5)铁与氨气反应生成一种如图所示晶胞结构的产物,N周围最近的Fe数目是_______ 。若该晶体的密度是dg·cm-3,则两个最近的Fe间的距离为_______ cm(设NA为阿伏加德罗常数的值)。
(1)基态铁原子的电子排布式为
(2)我国菱铁矿FeCO3储量较为丰富。其中CO
 的空间结构为
的空间结构为(3)草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如下,碳原子的杂化方式是
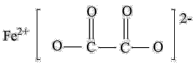
(4)Fe(CO)5溶于汽油、苯、丙酮等有机溶剂,熔点、沸点分别在-20℃、103.6℃左右。因此可知Fe(CO)5属于
(5)铁与氨气反应生成一种如图所示晶胞结构的产物,N周围最近的Fe数目是

您最近一年使用:0次
名校
解题方法
6 . 请回答下列问题:
(1)铱(Ir)与钴为同族元素,其核外电子占据最高能层的符号为 p,则基态 Ir 原子的价电子排布式为_______ 。
(2)下列状态的钙中,电离最外层一个电子所需能量最大的是_______(填标号);
(3)N、P、O、S 的简单氢化物性质的比较:
①热稳定性:NH3>PH3,其原因是_______ ,
②在乙醇中的溶解度:H2O>H2S,其原因是_______ ;
(4)H3O+离子和 SeO3分子的空间构型分别是_______ 、_______ ,O、F、S 电负性由大到小的顺序为_______ ;
(1)铱(Ir)与钴为同族元素,其核外电子占据最高能层的符号为 p,则基态 Ir 原子的价电子排布式为
(2)下列状态的钙中,电离最外层一个电子所需能量最大的是_______(填标号);
A.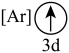 | B.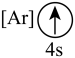 | C.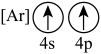 | D.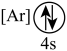 |
①热稳定性:NH3>PH3,其原因是
②在乙醇中的溶解度:H2O>H2S,其原因是
(4)H3O+离子和 SeO3分子的空间构型分别是
您最近一年使用:0次
名校
解题方法
7 .  为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是A.0.5 mol 中氙的价层电子对数为 中氙的价层电子对数为 |
B.23 g 中 中 杂化的原子数为 杂化的原子数为 |
| C.氢键(X-H…Y)中三原子在一条直线上时,作用力最强 |
D.标准状况下,11.2 L CO和 的混合气体中分子数为 的混合气体中分子数为 |
您最近一年使用:0次
名校
解题方法
8 . S单质的常见形式为S8,其环状结构如图所示,
(1)S原子价电子排布式___________ ;S原子的核外不同运动状态的电子数是___________ 个,能量最高的3p轨道的电子云的形状是___________
(2) S8的S原子采用的轨道杂化方式是___________ 。
(3)气态SeO3分子的空间立体构型为___________ , 离子的VSEPR模型为
离子的VSEPR模型为___________ 。
(4)H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角___________ (填大或小)

(1)S原子价电子排布式
(2) S8的S原子采用的轨道杂化方式是
(3)气态SeO3分子的空间立体构型为
 离子的VSEPR模型为
离子的VSEPR模型为(4)H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角
您最近一年使用:0次
名校
解题方法
9 . 下列说法不正确的是
A.键角: | B.沸点: |
C. 的空间结构为平面三角形 的空间结构为平面三角形 | D. 是极性分子 是极性分子 |
您最近一年使用:0次
2022-12-29更新
|
448次组卷
|
2卷引用:辽宁省大连市2022-2023学年高二上学期期末考试化学试题
名校
解题方法
10 . 根据杂化轨道理论和价层电子对互斥模型判断,下列结果错误的是
| 选项 | 分子或离子 | 价层电子对互斥模型 | 分子或离子的空间结构名称 |
| A | CO2 | 直线形 | 直线形 |
| B | HCHO | 平面三角形 | 平面三角形 |
| C | CO | 四面体 | 三角锥形 |
| D | H3O+ | 四面体 | 三角锥形 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-20更新
|
337次组卷
|
3卷引用:黑龙江省哈尔滨市德强高级中学2021-2022学年高二下学期4月月考化学试题



