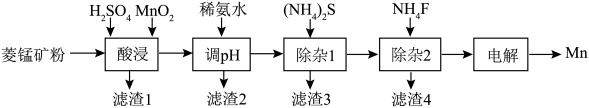
1 . 工业上以菱锰矿(主要成分为MnCO3,含杂质CaCO3、FeCO3、NiCO3)为原料制取金属锰的工艺流程如下:
已知常温下,溶度积常数(Ksp)如下表:
(1)基态Mn2+的价层电子轨道表示式为___________ , 的空间结构为
的空间结构为___________ 。
(2)“酸浸”时,为了加快反应速率,可采取的措施有___________ (答两条),该过程一般选择硫酸而不用盐酸的原因是___________ 。
(3)“酸浸”过程中,MnO2发生的主要反应的离子方程式为___________ 。
(4)常温下,加稀氨水时调pH约为4,则滤渣2的主要成分是___________ 。
(5)“除杂1”时加入适量的(NH4)2S,除去的主要离子为___________ ,过滤后得到的滤液中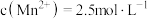 ,则其
,则其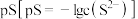 的范围是
的范围是___________ 。

已知常温下,溶度积常数(Ksp)如下表:
 | 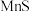 |  |  |  |  |
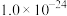 | 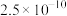 | 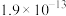 | 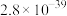 | 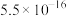 | 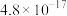 |
(1)基态Mn2+的价层电子轨道表示式为
 的空间结构为
的空间结构为(2)“酸浸”时,为了加快反应速率,可采取的措施有
(3)“酸浸”过程中,MnO2发生的主要反应的离子方程式为
(4)常温下,加稀氨水时调pH约为4,则滤渣2的主要成分是
(5)“除杂1”时加入适量的(NH4)2S,除去的主要离子为
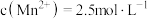 ,则其
,则其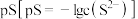 的范围是
的范围是
您最近一年使用:0次
名校
解题方法
2 . X、Y、Z、W为原子序数依次增大的前四周期元素,X为元素周期表中半径最小的原子,Z是地壳中含量最多的元素,W的原子序数为29,X、Y、Z、W形成的阳离子如图所示,下列说法正确的是
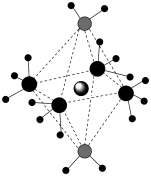
A.原子半径: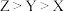 | B.该阳离子中心离子的配位数为6 |
C.氢化物的沸点: | D.两种配体中的键角: |
您最近一年使用:0次
2024-03-15更新
|
280次组卷
|
2卷引用:陕西省西安市西安中学2024届高三模拟考试(一)理综-化学试题
解题方法
3 . 从微粒结构角度分析,下列说法正确的是
A.三氧化硫有单分子气体和三聚分子固体(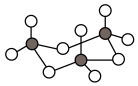 )两种存在形式,两种形式中S原子的杂化轨道类型相同 )两种存在形式,两种形式中S原子的杂化轨道类型相同 |
B. 中Al原子采用 中Al原子采用 杂化, 杂化, 离子的空间构型为平面正方形 离子的空间构型为平面正方形 |
C.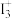 的空间结构为V形,中心原子的杂化方式为 的空间结构为V形,中心原子的杂化方式为 |
D. ( (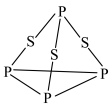 )中S和P原子最外层均满足8电子稳定结构 )中S和P原子最外层均满足8电子稳定结构 |
您最近一年使用:0次
2024-03-14更新
|
83次组卷
|
2卷引用:山东省泰安市泰山国际学校2023-2024学年高二下学期3月月考化学试题
名校
解题方法
4 . 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是
A. 与 与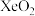 的键角相等 的键角相等 |
B.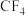 和 和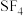 均为非极性分子 均为非极性分子 |
C. 和 和 的空间构型均为平面三角形 的空间构型均为平面三角形 |
D. 和 和 的VSEPR模型均为四面体 的VSEPR模型均为四面体 |
您最近一年使用:0次
2024-03-13更新
|
481次组卷
|
4卷引用:湖南省邵东市第三中学2023-2024学年高二上学期1月期末考试化学试卷
名校
解题方法
5 . 下列化学用语或说法中正确的是
A. 的名称:3-甲基丁烷 的名称:3-甲基丁烷 |
B.总共含有4个能级的能层符号: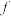 |
C. 的VSEPR模型为: 的VSEPR模型为: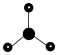 |
D.在氨水中, 与 与 分子间的氢键主要形式可表示为: 分子间的氢键主要形式可表示为: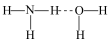 |
您最近一年使用:0次
解题方法
6 . 白磷(P4)在Cl2中燃烧生成PCl3和PCl5。下列说法正确的是
| A.P4分子中每个磷原子价层电子对数为4 |
| B.PCl3的空间构型为平面正三角形 |
| C.PCl5分子中P原子最外层满足8电子结构 |
| D.因P电负性比Cl小,故PCl3的水解产物为PH3和HClO |
您最近一年使用:0次
解题方法
7 . 北京时间2023年10月26日11时14分,载有3名航天员的神舟十七号载人飞船由长征二号 遥十七运载火箭成功发射至预定轨道。火箭采用偏二甲肼
遥十七运载火箭成功发射至预定轨道。火箭采用偏二甲肼 为推进剂(燃料)、
为推进剂(燃料)、 为氧化剂。为发挥中国空间站的综合效益,推出的首个太空科普教育品牌“天宫授课”,已由中国航天员在太空完成了四次授课。“天宫课堂”逐渐成为中国太空科普的国家品牌。偏二甲肼的制备方法为:
为氧化剂。为发挥中国空间站的综合效益,推出的首个太空科普教育品牌“天宫授课”,已由中国航天员在太空完成了四次授课。“天宫课堂”逐渐成为中国太空科普的国家品牌。偏二甲肼的制备方法为: ,下列说法正确的是
,下列说法正确的是
 遥十七运载火箭成功发射至预定轨道。火箭采用偏二甲肼
遥十七运载火箭成功发射至预定轨道。火箭采用偏二甲肼 为推进剂(燃料)、
为推进剂(燃料)、 为氧化剂。为发挥中国空间站的综合效益,推出的首个太空科普教育品牌“天宫授课”,已由中国航天员在太空完成了四次授课。“天宫课堂”逐渐成为中国太空科普的国家品牌。偏二甲肼的制备方法为:
为氧化剂。为发挥中国空间站的综合效益,推出的首个太空科普教育品牌“天宫授课”,已由中国航天员在太空完成了四次授课。“天宫课堂”逐渐成为中国太空科普的国家品牌。偏二甲肼的制备方法为: ,下列说法正确的是
,下列说法正确的是A. 的VSEPR模型: 的VSEPR模型: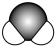 |
B.偏二甲肼中的 原子的杂化轨道类型: 原子的杂化轨道类型: |
C. 的 的 键电子云轮廓图: 键电子云轮廓图: |
D. 的形成过程为: 的形成过程为: |
您最近一年使用:0次
2024-03-05更新
|
154次组卷
|
2卷引用:浙江省湖州市德清县求是高级中学有限公司2023-2024学年高二上学期期末考试化学试题
23-24高二上·广东深圳·期末
名校
8 . 化合物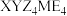 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为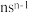 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是
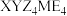 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为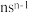 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是A.元素电负性: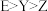 | B.简单氢化物沸点: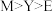 |
C.第一电离能: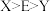 | D.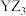 和 和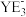 空间结构均为三角锥形 空间结构均为三角锥形 |
您最近一年使用:0次
名校
解题方法
9 . 硫酸是重要的化工原料。稀硫酸具有酸的通性;浓硫酸具有吸水性、脱水性和强氧化性,能氧化大多数金属单质和部分非金属单质。金属冶炼时产生的含SO2废气经回收处理、催化氧化、吸收后可制得硫酸。2SO2(g)+O2(g) 2SO3(g)
2SO3(g)  =-196.6 kJ·mol-1。工业制硫酸尾气中的SO2可用氨水吸收,吸收液经处理后释放出的SO2又可循环利用。下列有关SO2、SO3、SO
=-196.6 kJ·mol-1。工业制硫酸尾气中的SO2可用氨水吸收,吸收液经处理后释放出的SO2又可循环利用。下列有关SO2、SO3、SO 、H2SO4的说法正确的是
、H2SO4的说法正确的是
 2SO3(g)
2SO3(g)  =-196.6 kJ·mol-1。工业制硫酸尾气中的SO2可用氨水吸收,吸收液经处理后释放出的SO2又可循环利用。下列有关SO2、SO3、SO
=-196.6 kJ·mol-1。工业制硫酸尾气中的SO2可用氨水吸收,吸收液经处理后释放出的SO2又可循环利用。下列有关SO2、SO3、SO 、H2SO4的说法正确的是
、H2SO4的说法正确的是| A.SO2转化为SO3时没有破坏共价键 |
| B.SO3的空间构型为三角锥形 |
C.SO 与SO3中的键角相等 与SO3中的键角相等 |
D.硫酸的结构为: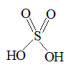 ,可以推测H2SO4分子间能形成氢键 ,可以推测H2SO4分子间能形成氢键 |
您最近一年使用:0次
2024-02-24更新
|
253次组卷
|
2卷引用:江苏省南京市六校联合体2023-2024学年高二下学期四月联考化学试卷
名校
10 . 完成下列问题
(1)H3O+中H-O-H键角比H2O中H-O-H键角大,原因为___________ 。
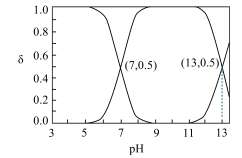
(2)H2S溶液中H2S、HS-、S2-含硫粒子总浓度中所占分数δ随溶液pH的变化关系如图计算H2S的Ka2=___________ 。
(3)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知上述反应中相关的化学键键能数据如下:
则该反应的△H=___________ 。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___________ (填“A”或“B")。
(4)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00mL浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
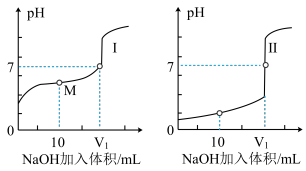
滴定醋酸的曲线是___________ (填“I”或“Ⅱ”)。V1和V2关系:V1_______ V2(填“>”“=”或“<”)。
(5)25℃时,amol/L的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为___________ 。(用含a的代数式表示)。
(1)H3O+中H-O-H键角比H2O中H-O-H键角大,原因为
(2)H2S溶液中H2S、HS-、S2-含硫粒子总浓度中所占分数δ随溶液pH的变化关系如图计算H2S的Ka2=

(3)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)已知上述反应中相关的化学键键能数据如下:
| 化学键 |  |  |  |  |
| 键能/ kJ∙mol-1 | 413 | 745 | 436 | 1075 |
(4)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00mL浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

滴定醋酸的曲线是
(5)25℃时,amol/L的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为
您最近一年使用:0次
2024-02-22更新
|
60次组卷
|
2卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题



