名校
解题方法
1 . 下列化学用语或表述不正确的是
A.基态 原子价电子排布式: 原子价电子排布式: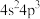 |
B.用电子式表示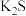 的形成: 的形成: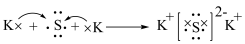 |
C.基态N原子的价层电子轨道表达式: |
D. 分子的 分子的 模型: 模型: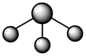 |
您最近一年使用:0次
2024-03-01更新
|
138次组卷
|
3卷引用:山东省泰安市泰山国际学校2023-2024学年高二下学期3月月考化学试题
名校
2 . 化合物R是一种新型锅炉水除氧剂,其结构式如图所示。下列说法正确的是


| A.非金属性:C>N>O |
| B.R分子中氮原子与碳原子均采取sp3杂化 |
| C.R分子中所含σ键与π键的数目之比为11:1 |
| D.R分子中的所有原子可能共平面 |
您最近一年使用:0次
名校
3 . 下列说法正确的有几个
①最外层电子数为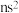 的元素都在元素周期表的第2列
的元素都在元素周期表的第2列
②分子中一定存在 键,不一定存在
键,不一定存在 键
键
③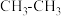 、
、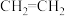 、
、 中碳碳键键长相同
中碳碳键键长相同
④基态原子的价电子排布为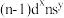 的元素,其族序数一定为
的元素,其族序数一定为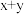
⑤ 核外电子跃迁过程中形城了发射光谱
核外电子跃迁过程中形城了发射光谱
⑥ 与
与 空间结构为V形且中心原子均为
空间结构为V形且中心原子均为 杂化
杂化
①最外层电子数为
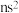 的元素都在元素周期表的第2列
的元素都在元素周期表的第2列②分子中一定存在
 键,不一定存在
键,不一定存在 键
键③
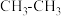 、
、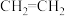 、
、 中碳碳键键长相同
中碳碳键键长相同④基态原子的价电子排布为
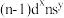 的元素,其族序数一定为
的元素,其族序数一定为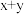
⑤
 核外电子跃迁过程中形城了发射光谱
核外电子跃迁过程中形城了发射光谱⑥
 与
与 空间结构为V形且中心原子均为
空间结构为V形且中心原子均为 杂化
杂化| A.0个 | B.1个 | C.2个 | D.3个 |
您最近一年使用:0次
2024-02-19更新
|
316次组卷
|
4卷引用:山东省青岛市第二中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
4 . 《中华本草》中记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症等。下列叙述正确的是
| A.Zn的核外电子排布式为3d104s2 |
| B.ZnCO3中阴离子空间结构为平面正三角形 |
| C.ZnCO3中C的杂化方式为sp3 |
| D.电负性:Zn>C>O |
您最近一年使用:0次
2024-02-11更新
|
180次组卷
|
2卷引用:山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
5 . 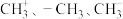 都是重要的有机反应中间体,有关说法正确的是
都是重要的有机反应中间体,有关说法正确的是
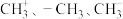 都是重要的有机反应中间体,有关说法正确的是
都是重要的有机反应中间体,有关说法正确的是A.CH 中的所有原子共平面 中的所有原子共平面 |
B.CH 空间结构为正四面体形 空间结构为正四面体形 |
| C.碳原子均采取sp3杂化 |
D.CH 与CH 与CH 形成的化合物中含有离子键 形成的化合物中含有离子键 |
您最近一年使用:0次
2024-02-11更新
|
357次组卷
|
4卷引用:山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题
6 . 铬是一种重要的元素,在合金、电镀、鞣制领域都有重要的应用, 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。
(1)基态Cr原子价层电子的轨道表达式为__________ ,同周期元素的基态原子最外层电子数与Cr相同的元素有__________ 种。
(2) 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为__________ ,基态S原子核外电子中成对电子数和未成对电子数之比为__________ 。
(3)NH3、H2O、 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是____________________ 。
(4) 中
中 键的数目为
键的数目为__________ ,基态N原子电子占据最高能级的电子云轮廓图为__________ 形。
(5)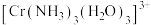 中配体
中配体 的杂化类型是
的杂化类型是__________ , 的键角
的键角__________  的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是______________________________ 。
 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。(1)基态Cr原子价层电子的轨道表达式为
(2)
 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为(3)NH3、H2O、
 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是(4)
 中
中 键的数目为
键的数目为(5)
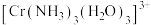 中配体
中配体 的杂化类型是
的杂化类型是 的键角
的键角 的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是
您最近一年使用:0次
2024-02-01更新
|
270次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
名校
7 . 周期表前四周期的元素X、Y、Z、Q、R,原子序数依次增大。X的核外电子总数与其周期数相同,基态Y原子核外有7种运动状态不同的电子,Z的价层电子中的未成对电子有2个,Q与Z同族,R的最外层只有1个电子,内层全充满。下列判断正确的是
A.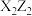 是非极性分子 是非极性分子 | B.第一电离能:Z>Y>Q |
| C.R为金属元素,属于s区 | D.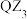 分子空间构型为平面三角形 分子空间构型为平面三角形 |
您最近一年使用:0次
2024-02-01更新
|
284次组卷
|
3卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
名校
解题方法
8 . 四氟化硅、二氟甲烷(CH2F2)等含氟化合物在生产、生活中有重要的应用。回答下列问题:
(1)基态氟原子核外电子的空间运动状态有___________ 种,核外电子的最高能级符号为___________ ,最高能级电子的电子云形状为___________ 。
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为___________ 。
②N2F2结构式为___________ ,其分子中。σ键与π键的数目之比为___________ 。
(3)氢氟酸能腐蚀玻璃生成SiF4,SiF4中Si的杂化方式为___________ ,SiF4的空间构型为___________ 。
(4) CH2F2难溶于水,而三氟甲烷(CHF3)可溶于水,其可能的原因是___________ 。
(1)基态氟原子核外电子的空间运动状态有
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为
②N2F2结构式为
(3)氢氟酸能腐蚀玻璃生成SiF4,SiF4中Si的杂化方式为
(4) CH2F2难溶于水,而三氟甲烷(CHF3)可溶于水,其可能的原因是
您最近一年使用:0次
2023-12-26更新
|
208次组卷
|
5卷引用:山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
9 . 下列关于 、
、 、
、 三种微粒的说法不正确的是
三种微粒的说法不正确的是
 、
、 、
、 三种微粒的说法不正确的是
三种微粒的说法不正确的是| A.三种微粒所含有的电子数相等 |
| B.三种微粒中氮原子的杂化方式相同 |
| C.三种微粒的空间构型相同 |
D.键角大小关系:NH >NH3>NH >NH3>NH |
您最近一年使用:0次
2023-06-24更新
|
561次组卷
|
22卷引用:山东省泰安市2022-2023学年高二下学期4月期中考试化学试题
山东省泰安市2022-2023学年高二下学期4月期中考试化学试题2015-2016学年黑龙江省哈尔滨九中高二下期末化学试卷四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题陕西省宝鸡市金台区2020-2021学年高二下学期期中考试化学试题新疆新源县第二中学2020-2021学年高二下学期期末联考化学试题(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.2.3 分子的空间结构及中心原子杂化轨道类型的判断方法-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题专题4 分子空间结构与物质性质 本专题复习提升专题强化练4 微粒的空间结构黑龙江省哈尔滨市宾县第二中学2021-2022学年高二下学期期末考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章02练基础(已下线)【知识图鉴】单元讲练测选择性必修2第二章01讲核心辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题辽宁省鞍山市普通高中2022-2023学年高二下学期第一次月考化学(A卷)试题四川省广元中学2022-2023学年高二下学期4月月考化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题陕西师范大学附属中学2022-2023学年高二下学期期末考试化学试题辽宁省丹东市第二中学 大石桥市第三高级中学2022-2023学年高二上学期期末联考化学试题广东省东莞实验中学2022-2023学年高二上学期第一次月考化学试题北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷(已下线)热点04 分子的空间结构
名校
解题方法
10 . 下表中各粒子对应的空间结构及解释均正确的是
| 选项 | 粒子 | 空间结构 | 解释 |
| A | 氨基负离子( ) ) | 直线形 | N原子采取 杂化 杂化 |
| B | 二氧化硫( ) ) | V形 | S原子采取 杂化 杂化 |
| C | 碳酸根离子( ) ) | 三角锥形 | C原子采取 杂化 杂化 |
| D | 乙炔( ) ) | 直线形 | C原子采取 杂化且C原子的价电子均参与成键 杂化且C原子的价电子均参与成键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-07更新
|
299次组卷
|
27卷引用:山东省泰安市宁阳一中2020-2021学年高二下学期3月月考化学试题
山东省泰安市宁阳一中2020-2021学年高二下学期3月月考化学试题2015-2016学年江苏省泰州中学高二下期中化学试卷四川省新津中学2019-2020学年高二下学期4月月考(入学)化学试题四川省成都外国语学校2019-2020学年高二下学期期中考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题四川绵阳南山中学双语学校2020-2021学年高二上学期10月月考化学试题湖南师范大学附属中学2020-2021学年高二上学期第三次大练习化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 B素养拓展区河南省名校联盟2020-2021学年高二下学期开学考试化学试题(已下线)2.2 分子的空间结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)(已下线)作业04 分子的空间结构-2021年高二化学暑假作业(人教版2019)(已下线)2.2.2 杂化轨道理论(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第2.2.2讲 杂化轨道理论-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)(已下线)第2章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)专题4 分子空间结构与物质性质 专题强化练5 分子(离子)的空间结构与杂化轨道类型的判断第二节 分子的空间结构 第2课时 杂化轨道理论湖南省邵阳市新邵县2021-2022学年高二上学期期末考试化学试题福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题天津市耀华中学2022-2023学年高二上学期期末考试化学试题陕西省武功县普集高级中学2022-2023学年高二下学期第一次月考化学试题广东省阳山县南阳中学2022-2023学年高二下学期第一次月考化学试题广东省深圳龙岗四校2022--2023学年高二下学期期中考试化学试题安徽省颍上第一中学2022-2023学年高二下学期5月月考化学试题黑龙江省大庆市肇州县第二中学2023-2024学年高二上学期12月月考化学试题湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题四川省内江市威远县威远中学校2023-2024学年高二下学期第一次月考化学试卷四川省绵阳市东辰学校2023-2024学年高二上学期第四次月考化学试题



