名校
解题方法
1 . 下列分子中的中心原子杂化轨道的类型相同的是
| A.CO2与SO2 | B.CH4与NH3 |
| C.BeCl2与BF3 | D.C2H6与C2H2 |
您最近一年使用:0次
2022-11-30更新
|
1158次组卷
|
24卷引用:河北省衡水市桃城区第十四中学2019-2020学年高二下学期摸底考试化学试题
河北省衡水市桃城区第十四中学2019-2020学年高二下学期摸底考试化学试题福建省福州市格致中学2018-2019学年高二下学期期中考试化学试题福建省南安市侨光中学2019-2020学年高二下学期第一次阶段考化学试题吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题新疆生产建设兵团第四师第一中学2019-2020学年高二下学期期中考试化学试题江苏省盐城市东台市创新学校2019-2020学年高二下学期5月份月检测化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构(人教版2019)选择性必修2 第二章 分子结构与性质 学科素养提升鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2章学科素养提升(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构高二选择性必修2(人教版2019)第二章 分子结构与性质 第二节 分子的空间结构 课时2 杂化轨道理论(已下线)2.2.1 分子空间结构的理论分析-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)福建省莆田第二十五中学2020-2021学年高二下学期第一次月考化学试题黑龙江省齐齐哈尔市第一中学2020-2021学年高二下学期4月月考化学试题新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高二年级下学期期中考试化学试题吉林省长春市榆树高级中学2020-2021学年高二下学期期中考试化学试题福建省福州市金山中学2020-2021学年高二下期中考试化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题内蒙古赤峰市元宝山区第一中学2021-2022学年高二下学期4月月考化学试题专题4 分子空间结构与物质性质 第一单元 分子的空间结构 第1课时 分子的空间结构模型第二节 分子的空间结构 第2课时 杂化轨道理论四川省江油中学2022-2023学年高二上学期期中测试化学试题(已下线)2.2 分子空间结构-同步学习必备知识4.1.1杂化轨道理论 课中
名校
解题方法
2 . 有关 、
、 、
、 之叙述正确的是
之叙述正确的是
 、
、 、
、 之叙述正确的是
之叙述正确的是A.C原子的轨道杂化类型分别为sp, 、 、 | B. 键总数: 键总数: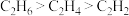 |
C.σ键总数: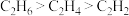 | D.碳碳键的总键能: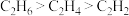 |
您最近一年使用:0次
2022-05-20更新
|
201次组卷
|
8卷引用:2016-2017学年河北省衡水中学高二上学期五调考试化学试卷
2016-2017学年河北省衡水中学高二上学期五调考试化学试卷2015-2016学年四川省雅安中学高二上10月月考化学试卷陕西省黄陵中学2016-2017学年高二(重点班)下学期第四学月考试化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题(已下线)第二单元 化学键与分子间作用力(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)吉林省长春市清蒲中学2020-2021学年高二下学期期中考试化学试题浙江省宁波市三锋教研联盟2021-2022学年高二下学期期中联考化学试题(已下线)2.2.2 炔烃课堂例题
9-10高二下·辽宁锦州·期末
名校
解题方法
3 . 如图所示,在乙烯分子中有5个σ键和一个π键,它们分别是
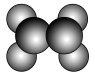
| A.sp2杂化轨道形成σ键,未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键 |
| C.C—H之间是sp2形成σ键,C—C之间是未参加杂化的2p轨道形成π键 |
| D.C—C之间是sp2形成σ键,C—H之间是未参加杂化的2p轨道形成π键 |
您最近一年使用:0次
2021-12-25更新
|
1585次组卷
|
66卷引用:河北省蠡县中学2016-2017学年高二6月月考化学试题
河北省蠡县中学2016-2017学年高二6月月考化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.2 第2课时河北省石家庄市鹿泉一中2017-2018学年高二3月月考化学试题河北省邯郸市大名县第一中学2019-2020学年高二下学期第四次半月考化学试题(清北班)(已下线)09—10年锦州市高二下学期期末考试化学卷(已下线)09~10年银川一中高二下学期期末考试化学卷(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2011-2012学年陕西省师大附中高二下学期期中考试化学试卷(已下线)2012--2013学年新疆乌鲁木齐市一中高二下学期期中考试化学试卷(平行班)(已下线)2012-2013学年宁夏银川一中高二下学期期末考试化学试卷(已下线)2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(已下线)2013届新疆乌鲁木齐市一中高二第二学期期中考试化学试卷(已下线)2015届西藏拉萨中学高三第一次月考化学试卷2015届西藏拉萨中学高三第一次月考化学试卷22014-2015江苏省南通中学高二上学期期末化学(理)试卷2014-2015学年辽宁实验分校高二下6月阶段测试化学试卷2014-2015学年吉林省吉林市第一中学高二下期末化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷2015-2016学年吉林省吉林五十五中高二下3月月考化学试卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年广东汕头金山中学高二下第十二周练化学卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年河南省三门峡市灵宝一中高二下第一次月考化学试卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷河南省焦作市博爱一中2016-2017学年高二下学期第一次月考化学试题内蒙古包头市第三十三中学2016-2017学年高二下学期期末考试化学试题人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第2课时)山东省单县五中2017-2018学年高二下学期第一次月考化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题(已下线)2019年11月26日《每日一题》2020年高考化学一轮复习—— 共价键的分类与判断2020届高三化学二轮物质结构题型专攻——分子结构与性质【选择基础专练】河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题山东省泰安市新泰市第二中学2019-2020学年高二下期中考试化学试题宁夏育才中学2019-2020学年高二下学期开学检测化学试题山西省太原市实验中学校2019-2020学年高二下学期期中考试化学试题天津市和平区2020届高三一模化学试题甘肃省庆阳市镇原中学2019-2020学年高二下学期期末考试化学试题四川省自贡市田家炳中学2020-2021学年高二上学期开学考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题内蒙古赤峰第二实验中学2021届高三模拟考试(一)化学试题新疆哈密市第八中学2019-2020学年高二下学期期中考试化学试题河南省汤阴县五一中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构高二选择性必修3(人教版2019)第一章 有机化合物的结构特点与研究方法 第一节 有机化合物的结构特点 课时2 有机化合物中的共价键(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构 课时2 杂化轨道理论鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构 第1课时 分子空间结构的理论分析高二选择性必修2(人教版2019)第二章 分子结构与性质 第二节 分子的空间结构 课时2 杂化轨道理论(已下线)2.2.1 分子空间结构的理论分析-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题河南省开封市五县2020-2021学年高二下学期月考化学试题(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.2.2 杂化轨道理论(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)2.2.2 杂化轨道理论-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)课中-1.1.2 有机化合物中的共价键和有机化合物的同分异构现象-人教2019选择性必修3云南省楚雄彝族自治州民族中学2021-2022学年高二下学期3月月考化学试题陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题北京交通大学附属中学2020-2021学年高二下学期期末考试化学试题(已下线)第39练 共价键-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第40练 分子的空间结构-2023年高考化学一轮复习小题多维练(全国通用)安徽省滁州市定远县育才学校2021-2022学年高二分层班下学期期中考试化学试题山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题四川省宜宾市南溪区第二中学校2021-2022学年高二上学期12月月考化学试题2.2.2 杂化轨道理论-随堂练习(已下线)猜想02 分子结构与性质【考题猜想】)(9大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
4 . 磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外子排布式为_______ 。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_______ ,电负性由大到小的顺序为_______ 。
(3)AsCl3分子的立体构型为_______ ,其中As的杂化轨道类型为_______ 。
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是_______ 。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。
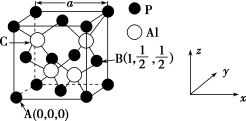
①磷化铝的晶体类型为_______ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______ 。
③磷化铝的晶胞参数a=546.35 pm,其密度为_______ g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
(1)基态砷原子的核外子排布式为
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为
(3)AsCl3分子的立体构型为
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O
 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。

①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数a=546.35 pm,其密度为
您最近一年使用:0次
2021-04-22更新
|
395次组卷
|
3卷引用:辽宁省海城市高中教育集团2019-2020学年高二下学期6月联考化学试题
名校
解题方法
5 . 某有机物X是一种免疫调节剂,其结构简式为 ,下列有关X的说法中错误的是
,下列有关X的说法中错误的是
 ,下列有关X的说法中错误的是
,下列有关X的说法中错误的是| A.其共平面碳原子最多有9个 |
B.既能与钠反应也能与 溶液反应 溶液反应 |
C.X分子中C、N、O原子均采用 杂化 杂化 |
| D.X分子间能发生分子间取代反应但分子内不能发生取代反应 |
您最近一年使用:0次
名校
解题方法
6 . 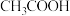 分子中
分子中 及
及 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是
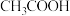 分子中
分子中 及
及 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是
A. 、 、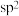 | B.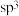 、sp 、sp | C.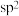 、sp 、sp | D.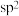 、 、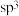 |
您最近一年使用:0次
名校
解题方法
7 . 氢原子是最轻的原子,人们曾预言它可能是所有元素之母。碳是地球上组成生命的最基本的元素之一。按要求回答:
(1)宇宙中含量最多的元素是氢和______ 。基态碳原子的核外电子占有______ 个原子轨道。
(2)光化学烟雾中除了含有NOx外,还含有HCOOH、 (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN中C的杂化方式有______ 。1mol PAN中含有的σ键数目为______ 。组成PAN的元素的电负性大小顺序为______ 。
②相同压强下,HCOOH的沸点比CH3OCH3______ (填“高”或“低”),
(3)水溶液中有H3O+、 、
、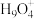 等微粒的形式。请画出
等微粒的形式。请画出 的结构式:
的结构式:______ 。
(1)宇宙中含量最多的元素是氢和
(2)光化学烟雾中除了含有NOx外,还含有HCOOH、
 (PAN)等二次污染物。
(PAN)等二次污染物。①PAN中C的杂化方式有
②相同压强下,HCOOH的沸点比CH3OCH3
(3)水溶液中有H3O+、
 、
、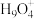 等微粒的形式。请画出
等微粒的形式。请画出 的结构式:
的结构式:
您最近一年使用:0次
名校
8 . 2019年8月科学家在Science杂志首次报道了具有半导体特性的18个原子纯碳环分子(如图所示)。下列说法不正确的是
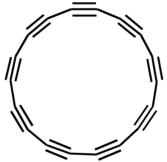

| A.该分子所有的碳杂化方式都是sp |
| B.该分子可能要比苯更加活泼 |
| C.该分子属于有机物 |
| D.该分子具有半导体的功能,可以使类似的直碳链成为分子级电子元件 |
您最近一年使用:0次
2020-06-11更新
|
408次组卷
|
6卷引用:河北省沧州市任丘市第一中学2019-2020学年高二下学期开学考试化学试题
名校
9 . 二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
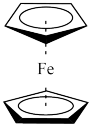

| A.二茂铁属于分子晶体 |
| B.环戊二烯中碳原子的杂化方式有sp3和sp2 |
C.1mol 环戊二烯(  )中含有σ键的数目为5NA )中含有σ键的数目为5NA |
| D.二茂铁分子中的化学键有极性共价键、非极性共价键和配位键 |
您最近一年使用:0次
2020-06-11更新
|
126次组卷
|
2卷引用:河北省沧州市任丘市第一中学2019-2020学年高二下学期开学考试化学试题
名校
解题方法
10 . 四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是________ 、________ ;杂化轨道分别是________ 、________ ;a分子的立体结构是________ 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________ 晶体、________ 晶体。
(3)Y与Z比较,电负性较大的是________ ,W2+离子的核外电子排布式是________ 。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
(3)Y与Z比较,电负性较大的是
您最近一年使用:0次



