名校
1 . A、B、C、D、E为短周期元素且它们的原子序数依次增大,A原子的核外电子总数与其周期数相同:D原子的L能层中,成对电子与未成对电子占据的轨道数相同,并且无空轨道;B原子的L能层中未成对电子数与D原子的相同,但有空轨道:D与E同族。回答下列问题。
(1)A与上述其他元素形成的二元共价化合物中,有一种化合物分子呈三角锥形,该分子的化学式为___________ ,其中心原子的杂化方式为___________ ,A分别与B、C、D形成的共价化合物中既含有极性共价键,又含有非极性共价键的化合物有___________ (填化学式,任意写出两种)。
(2)这些元素形成的含氧酸根离子中,其中心原子的价层电子对数为3的酸根离子是___________ (填化学式,下同);酸根离子呈三角锥形结构的是___________ 。
(3) 分子的空间结构为
分子的空间结构为___________ ;根据电子云重叠方式的不同,该分子中共价键的类型为___________ 。
(4)B的一种氢化物的相对分子质量是26,其分子中 键和
键和 键的数目之比为
键的数目之比为___________ 。
(1)A与上述其他元素形成的二元共价化合物中,有一种化合物分子呈三角锥形,该分子的化学式为
(2)这些元素形成的含氧酸根离子中,其中心原子的价层电子对数为3的酸根离子是
(3)
 分子的空间结构为
分子的空间结构为(4)B的一种氢化物的相对分子质量是26,其分子中
 键和
键和 键的数目之比为
键的数目之比为
您最近一年使用:0次
2 . 氧元素和卤族元素形成的物质可以用物质结构与性质的知识去认识和理解。
(1) 的空间结构为
的空间结构为___________ ,溴的基态原子价层电子排布式为___________ 。
(2)根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是___________ 。
(3)下列分子既不存在“ ”
” 键,也不存在“
键,也不存在“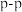 ”
” 键的是___________(填字母)。
键的是___________(填字母)。
(4)已知 为V形,中心氯原子周围有4个价层电子对。
为V形,中心氯原子周围有4个价层电子对。 中心氯原子的杂化轨道类型为
中心氯原子的杂化轨道类型为___________ 。
(5)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为___________ 。 ,则氧化物的密度是
,则氧化物的密度是___________  (只要求列算式,不必计算出数值,阿伏加德罗常数的值为
(只要求列算式,不必计算出数值,阿伏加德罗常数的值为 )。
)。
(1)
 的空间结构为
的空间结构为(2)根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是
| 元素 | 氟 | 氯 | 溴 | 碘 |
第一电离能/( ) ) | 1681 | 1251 | 1140 | 1008 |
(3)下列分子既不存在“
 ”
” 键,也不存在“
键,也不存在“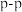 ”
” 键的是___________(填字母)。
键的是___________(填字母)。A. | B. | C. | D. |
(4)已知
 为V形,中心氯原子周围有4个价层电子对。
为V形,中心氯原子周围有4个价层电子对。 中心氯原子的杂化轨道类型为
中心氯原子的杂化轨道类型为(5)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为

 ,则氧化物的密度是
,则氧化物的密度是 (只要求列算式,不必计算出数值,阿伏加德罗常数的值为
(只要求列算式,不必计算出数值,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2024-03-04更新
|
121次组卷
|
2卷引用:湖北省武汉西藏中学2023-2024学年高二下学期5月期中考试化学试题
3 . 臭氧( )在
)在 和
和 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1) 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述)。
(2) 基态核外电子排布式为
基态核外电子排布式为___________ 。
(3)与 分子互为等电子体的一种阴离子为
分子互为等电子体的一种阴离子为___________ (填化学式)。
(4) 分子中
分子中 键与
键与 键的数目比
键的数目比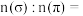
___________ 。
(5) 与
与 反应生成的
反应生成的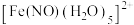 中,
中, 以N原子与
以N原子与 形成配位键。请在
形成配位键。请在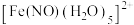 结构示意图的相应位置补填缺少的配体。
结构示意图的相应位置补填缺少的配体。_________

(6)锗的基态原子核外电子排布式为___________ ; 的分子空间构型为
的分子空间构型为___________ 。
 )在
)在 和
和 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(2)
 基态核外电子排布式为
基态核外电子排布式为(3)与
 分子互为等电子体的一种阴离子为
分子互为等电子体的一种阴离子为(4)
 分子中
分子中 键与
键与 键的数目比
键的数目比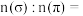
(5)
 与
与 反应生成的
反应生成的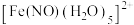 中,
中, 以N原子与
以N原子与 形成配位键。请在
形成配位键。请在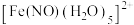 结构示意图的相应位置补填缺少的配体。
结构示意图的相应位置补填缺少的配体。
(6)锗的基态原子核外电子排布式为
 的分子空间构型为
的分子空间构型为
您最近一年使用:0次
名校
解题方法
4 . 已知:红磷在氯气中燃烧可以生成两种化合物:PCl3和PCl5,PCl5分子中,P原子的1个3s轨道、3个3p轨道和1个3d轨道发生杂化形成5个sp3d杂化轨道;PCl5分子呈三角双锥形,其结构如图1所示:

(1)N、P是同一族元素,P能形成PCl3、PCl5两种氯化物,而N只能形成一种氯化物NCl3,而不能形成NCl5,原因是_______ 。
(2)下列关于PCl5分子的说法正确的有 _______。
(3)PCl5是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种 正八面体形阴离子,该晶体的晶胞如图2所示,熔体中P﹣Cl的键长只有198nm和206nm两种,这两种离子的化学式为 _______ 。

(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因_______ 。

(1)N、P是同一族元素,P能形成PCl3、PCl5两种氯化物,而N只能形成一种氯化物NCl3,而不能形成NCl5,原因是
(2)下列关于PCl5分子的说法正确的有 _______。
| A.PCl5分子中磷原子没有孤对电子 |
| B.PCl5分子中没有形成π键 |
| C.PCl5分子中所有的Cl﹣P﹣Cl键角都相等 |
| D.SF4分子中S原子也采取sp3d杂化 |

(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因
您最近一年使用:0次
解题方法
5 . 已知和氮元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y的原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是 。试回答:
。试回答:
(1)X元素的基态原子的核外电子排布式为_________ ,Y元素原子价电子排布图(也叫轨道表示式)为_________ 。
(2)X、Y两元素之间形成的化学键为_________ (填“共价键”或“离子键”)。
(3) 的空间结构为
的空间结构为_________ 形,中心原子采取_________ 杂化,分子为_________ (填“极性分子”或“非极性分子”)。
(4) 的沸点与
的沸点与 比较:
比较:_________ (填化学式)的高,原因_________ 。
 。试回答:
。试回答:(1)X元素的基态原子的核外电子排布式为
(2)X、Y两元素之间形成的化学键为
(3)
 的空间结构为
的空间结构为(4)
 的沸点与
的沸点与 比较:
比较:
您最近一年使用:0次
6 . 据报道,我国化学研究人员用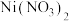 和
和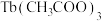 等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
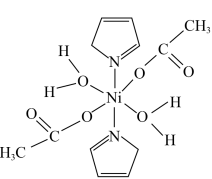
请回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ , 在元素周期表中的位置是
在元素周期表中的位置是_______ 。
(2)C、N、O三种元素第一电离能最大的是_______ (填元素符号)。
(3)镍的一维链状配位聚合物中,碳原子的杂化方式为_______ 。已知: 的沸点为117.9℃,
的沸点为117.9℃,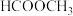 的沸点为32℃。
的沸点为32℃。 的沸点高于
的沸点高于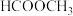 的沸点的主要原因是
的沸点的主要原因是_______ 。
(4)氧化镍的晶胞结构如图所示。若 为阿伏加德罗常数的值,晶胞中最近的
为阿伏加德罗常数的值,晶胞中最近的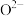 之间的距离为anm,则氧化镍的密度为
之间的距离为anm,则氧化镍的密度为_______ 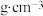 。
。

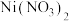 和
和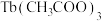 等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
请回答下列问题:
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 在元素周期表中的位置是
在元素周期表中的位置是(2)C、N、O三种元素第一电离能最大的是
(3)镍的一维链状配位聚合物中,碳原子的杂化方式为
 的沸点为117.9℃,
的沸点为117.9℃,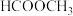 的沸点为32℃。
的沸点为32℃。 的沸点高于
的沸点高于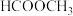 的沸点的主要原因是
的沸点的主要原因是(4)氧化镍的晶胞结构如图所示。若
 为阿伏加德罗常数的值,晶胞中最近的
为阿伏加德罗常数的值,晶胞中最近的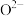 之间的距离为anm,则氧化镍的密度为
之间的距离为anm,则氧化镍的密度为 。
。
您最近一年使用:0次
7 . 钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________ 。
(2)已知第四电离能大小:I4(Fe)>I4(Co),从原子结构的角度分析可能的原因是___________ 。
(3)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:
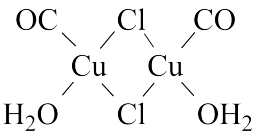
①该配合物中氯原子的杂化方式为___________ 。
②该配合物中,CO作配体时配位原子是C而不是O的原因是___________ 。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:

若与Zn距离最近的Te原子间距为apm,则晶体密度为___________ g/cm3
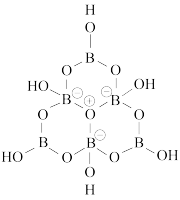
(5)基态硼原子的价电子排布图为:___________ ;科学家合成了一种含硼阴离子 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为___________ ,该结构中共有___________ 种不同化学环境的氧原子。
(1)钴元素在周期表中的位置是
(2)已知第四电离能大小:I4(Fe)>I4(Co),从原子结构的角度分析可能的原因是
(3)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:

①该配合物中氯原子的杂化方式为
②该配合物中,CO作配体时配位原子是C而不是O的原因是
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:

若与Zn距离最近的Te原子间距为apm,则晶体密度为
(5)基态硼原子的价电子排布图为:
 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为
您最近一年使用:0次
解题方法
8 . 铜是人类广泛使用的一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)我国秦俑彩绘上用的颜料被称为“中国蓝”(成分为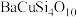 ),
),
①“中国蓝”中基态铜离子的价层电子排布式为_______ 。
② 的第三电离能远大于第二电离能,原因是
的第三电离能远大于第二电离能,原因是_______
(2)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。

①邻氨基吡啶的铜配合物中, 的配位数是
的配位数是_______ ,N原子的杂化类型为_______ 。
②1mol邻氨基吡啶 中
中 键的数目为
键的数目为_______ 。
(3) 可形成
可形成 ,其中
,其中 代表
代表 。
。
①该配合物分子中,VSEPR模型为四面体或正四面体的非金属原子共有_______ 个。
② 、B、H的电负性由大到小的顺序为
、B、H的电负性由大到小的顺序为_______ 。
(4)一种由 、
、 、
、 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:

若晶胞底边的边长均为a nm,高为c nm,阿加德罗常数的值为 ,设晶体的最简式的式量为M,则该晶体的密度为
,设晶体的最简式的式量为M,则该晶体的密度为_______  。
。
(1)我国秦俑彩绘上用的颜料被称为“中国蓝”(成分为
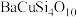 ),
),①“中国蓝”中基态铜离子的价层电子排布式为
②
 的第三电离能远大于第二电离能,原因是
的第三电离能远大于第二电离能,原因是(2)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。

①邻氨基吡啶的铜配合物中,
 的配位数是
的配位数是②1mol邻氨基吡啶
 中
中 键的数目为
键的数目为(3)
 可形成
可形成 ,其中
,其中 代表
代表 。
。①该配合物分子中,VSEPR模型为四面体或正四面体的非金属原子共有
②
 、B、H的电负性由大到小的顺序为
、B、H的电负性由大到小的顺序为(4)一种由
 、
、 、
、 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
若晶胞底边的边长均为a nm,高为c nm,阿加德罗常数的值为
 ,设晶体的最简式的式量为M,则该晶体的密度为
,设晶体的最简式的式量为M,则该晶体的密度为 。
。
您最近一年使用:0次
解题方法
9 . 2019年1月,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆:也首次实现了我国地外天体采样返回;所搭载的“玉兔二号”月球车,通过砷化镓( )太阳能电池提供能量进行工作。带回的月壤中包含了
)太阳能电池提供能量进行工作。带回的月壤中包含了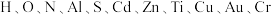 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1)基态 最高能层中成对电子与未成对电子的数目之比为
最高能层中成对电子与未成对电子的数目之比为_______ 。
(2) 的熔点为1238℃且熔融状态不导电,据此判断它是
的熔点为1238℃且熔融状态不导电,据此判断它是_______ (填“共价”或“离子”)化合物。
(3)H和O可以形成 和
和 。
。 是
是_______ (填“极性”或“非极性”)分子。
(4)砷化镓可由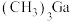 和
和 在
在 制得,
制得,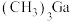 中碳原子的杂化方式为
中碳原子的杂化方式为_______ 。
(5)S与O可形成多种酸根离子及化合物,如 、
、 、
、 、
、 等,其中
等,其中 的
的 模型是
模型是_______ ; 的空间构型为
的空间构型为_______ 。
(6) 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
_______  (填“>”或“<”)。
(填“>”或“<”)。
 )太阳能电池提供能量进行工作。带回的月壤中包含了
)太阳能电池提供能量进行工作。带回的月壤中包含了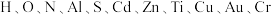 等多种元素。回答下列问题:
等多种元素。回答下列问题:(1)基态
 最高能层中成对电子与未成对电子的数目之比为
最高能层中成对电子与未成对电子的数目之比为(2)
 的熔点为1238℃且熔融状态不导电,据此判断它是
的熔点为1238℃且熔融状态不导电,据此判断它是(3)H和O可以形成
 和
和 。
。 是
是(4)砷化镓可由
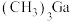 和
和 在
在 制得,
制得,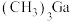 中碳原子的杂化方式为
中碳原子的杂化方式为(5)S与O可形成多种酸根离子及化合物,如
 、
、 、
、 、
、 等,其中
等,其中 的
的 模型是
模型是 的空间构型为
的空间构型为(6)
 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
解题方法
10 . 物质的组成、结构决定着物质的性质与变化,我们必须在原子、分子层次上深入地研究物质的结构。在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1)基态Ga原子核外电子排布式为_______ ;N原子的外围电子轨道表示式为________ 。
(2)在1 mol 5-氨基四唑中含有的σ键的数目为________ 。该有机物中氮原子的杂化方式为___________ 。
(3)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如下图)顶点的氮原子,这种碳氮化钛化合物的化学式为___________ 。该晶胞参数为anm,该晶体的密度为为___________ g/cm3。

 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。(1)基态Ga原子核外电子排布式为
(2)在1 mol 5-氨基四唑中含有的σ键的数目为
(3)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如下图)顶点的氮原子,这种碳氮化钛化合物的化学式为

您最近一年使用:0次



