名校
解题方法
1 . NH3与甲醛CH2O反应可以制备乌洛托品(六亚甲基四胺,分子结构为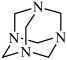 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
(1)基态氮原子的价电子轨道表达式为___________ ,第三电离能I3(C)___________ I3(N)(填“>”或“<)。
(2)NH3的空间构型为___________ ,CH2O中C采取的杂化类型为___________ 。CH2O中碳氢键与NH3中氮氢键相比,键长较长的是___________ 。
(3)乌洛托品为___________ (填“极性”或“非极性”)分子,分子中的所有N原子呈正四面体分布,所有C原子呈___________ 几何体分布,该分子可与H+形成配位键,电子对给予体为___________ 原子。
(4)在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为___________ 。乌洛托品比金刚烷(C10H16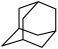 )水溶性更高,理由是
)水溶性更高,理由是___________ 。
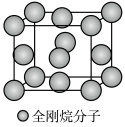
(5)金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3,阿伏加德罗常数为L×1023mol-1,则晶体的密度为___________ g/cm3。
 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:(1)基态氮原子的价电子轨道表达式为
(2)NH3的空间构型为
(3)乌洛托品为
(4)在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为
 )水溶性更高,理由是
)水溶性更高,理由是(5)金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3,阿伏加德罗常数为L×1023mol-1,则晶体的密度为

您最近一年使用:0次
2022-03-27更新
|
625次组卷
|
5卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)(结构与性质)
(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(结构与性质)四川省南充市2022届高三 适应性考试(二模)理综化学试题贵州省贵阳市五校2021-2022学年高三下学期联考理科综合化学试题(七)湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题
2022·河北·模拟预测
解题方法
2 . 卤族元素及其化合物用途非常广泛。回答下列问题:
(1) 可以与一定量的水形成
可以与一定量的水形成 晶体,基态B原子核外电子的空间运动状态有
晶体,基态B原子核外电子的空间运动状态有_______ 种, 中B原子采用的是
中B原子采用的是_______ 杂化。
(2)氯的化合物很多,常见的有 、
、 等.其中
等.其中 常温常压下为无色液体,则
常温常压下为无色液体,则 的空间构型为
的空间构型为_______ ,其固体的晶体类型为_______ 。无水 不能干燥
不能干燥 是因为形成了
是因为形成了 ,形成的配位离子中提供空轨道的是
,形成的配位离子中提供空轨道的是_______ ,提供孤对电子的是_______ 。
(3)某化合物 由
由 和
和 层交替堆叠构成.该化合物的所有组成元素位于元素周期表的
层交替堆叠构成.该化合物的所有组成元素位于元素周期表的_______ (填“s”“d”或“p”)区。O、S、N,3种元素的第一电离能由大到小的顺序是_______ 。
(4) 为直线形分子,属四方晶系,
为直线形分子,属四方晶系, 晶体结构如图所示.晶胞棱边夹角均为
晶体结构如图所示.晶胞棱边夹角均为 ,1个
,1个 晶胞中有
晶胞中有_______ 个 分子。若
分子。若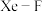 键的键长为190pm,设阿伏加德罗常数的值为
键的键长为190pm,设阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  (结果保留两位小数)。
(结果保留两位小数)。

(1)
 可以与一定量的水形成
可以与一定量的水形成 晶体,基态B原子核外电子的空间运动状态有
晶体,基态B原子核外电子的空间运动状态有 中B原子采用的是
中B原子采用的是(2)氯的化合物很多,常见的有
 、
、 等.其中
等.其中 常温常压下为无色液体,则
常温常压下为无色液体,则 的空间构型为
的空间构型为 不能干燥
不能干燥 是因为形成了
是因为形成了 ,形成的配位离子中提供空轨道的是
,形成的配位离子中提供空轨道的是(3)某化合物
 由
由 和
和 层交替堆叠构成.该化合物的所有组成元素位于元素周期表的
层交替堆叠构成.该化合物的所有组成元素位于元素周期表的(4)
 为直线形分子,属四方晶系,
为直线形分子,属四方晶系, 晶体结构如图所示.晶胞棱边夹角均为
晶体结构如图所示.晶胞棱边夹角均为 ,1个
,1个 晶胞中有
晶胞中有 分子。若
分子。若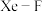 键的键长为190pm,设阿伏加德罗常数的值为
键的键长为190pm,设阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为 (结果保留两位小数)。
(结果保留两位小数)。
您最近一年使用:0次
名校
解题方法
3 . 根据所学内容填空:
(1)有下列物质:①HF、② 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ ,其中属于极性分子的是
,其中属于极性分子的是_______ (填序号,下同),既有 键又有
键又有 键的是
键的是_______ 。
(2)下列分子中,空间构型为正四面体且键角为109°28′的是_______ 。
a. b.
b. c.
c.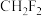 d.
d. e.
e. f.
f.
(3) 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是_______ 。
(4)丙烯腈分子( )中碳原子杂化轨道类型为
)中碳原子杂化轨道类型为_______ 。
(5)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。
① 的酸性比
的酸性比
_______ (填“强”或“弱”)。 离子的空间构型为
离子的空间构型为_______ 。
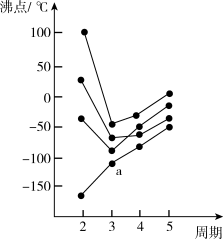
②如图所示,每条折线表示周期表ⅣA—ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______ (化学式)。
(1)有下列物质:①HF、②
 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ ,其中属于极性分子的是
,其中属于极性分子的是 键又有
键又有 键的是
键的是(2)下列分子中,空间构型为正四面体且键角为109°28′的是
a.
 b.
b. c.
c.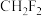 d.
d. e.
e. f.
f.
(3)
 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是(4)丙烯腈分子(
 )中碳原子杂化轨道类型为
)中碳原子杂化轨道类型为(5)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。
①
 的酸性比
的酸性比
 离子的空间构型为
离子的空间构型为②如图所示,每条折线表示周期表ⅣA—ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
您最近一年使用:0次
2022-04-09更新
|
433次组卷
|
3卷引用:河北省衡水市第二中学2021-2022学年高二下学期期中考试化学试题



