名校
解题方法
1 . 甲醇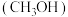 是一种用途广泛的基础有机原料和优质燃料。
是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜做催化剂的条件下直接氧化成甲醛 。
。
①基态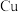 原子的价层电子的轨道表示式为
原子的价层电子的轨道表示式为_______ 。
②甲醛中碳原子的杂化方式为_______ 杂化,其组成元素的电负性由小到大 的顺序为_______ 。
(2)在一定条件下,甲醇可转化为乙酸甲酯 ,一个乙酸甲酯分子中
,一个乙酸甲酯分子中 键和
键和 键个数之比为
键个数之比为_______ 。
(3)由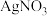 制备的
制备的 可用于检验醛基。
可用于检验醛基。 中配位原子为
中配位原子为_______ , 的空间构型为
的空间构型为_______ 。
(4)图中银晶胞的边长为 ,该晶胞中
,该晶胞中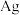 的配位数为
的配位数为_______ ;该晶胞密度为_______ 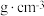 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
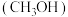 是一种用途广泛的基础有机原料和优质燃料。
是一种用途广泛的基础有机原料和优质燃料。(1)甲醇可以在铜做催化剂的条件下直接氧化成甲醛
 。
。①基态
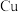 原子的价层电子的轨道表示式为
原子的价层电子的轨道表示式为②甲醛中碳原子的杂化方式为
(2)在一定条件下,甲醇可转化为乙酸甲酯
 ,一个乙酸甲酯分子中
,一个乙酸甲酯分子中 键和
键和 键个数之比为
键个数之比为(3)由
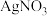 制备的
制备的 可用于检验醛基。
可用于检验醛基。 中配位原子为
中配位原子为 的空间构型为
的空间构型为(4)图中银晶胞的边长为
 ,该晶胞中
,该晶胞中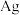 的配位数为
的配位数为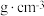 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
7日内更新
|
295次组卷
|
5卷引用:四川省成都市锦江区嘉祥外国语高级中学2023-2024学年高三下学期第二次诊断性考试化学试题
名校
解题方法
2 . 配合物在化学实验中有重要的作用,可以作为催化剂、反应中间体、反应物等参与反应,从而改变反应速率和反应路径
(1)基态Ti原子的价层电子轨道表示式为_____ 。
(2)区分晶态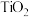 和非晶态
和非晶态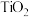 最可靠的科学方法是
最可靠的科学方法是_____ ,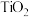 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为_____ 。
(3)一种由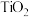 形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。
形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。_____ ,其中碳原子的杂化方式为_____ 。
②该配合物中心离子是_____ ,配位数为_____ 。
(4)已知配合物的稳定性: ,其原因是
,其原因是_____ 。
(5)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为 ,晶胞如图所示(氢未标出)。
,晶胞如图所示(氢未标出)。 ,B点原子的分数坐标为
,B点原子的分数坐标为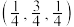 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_____ 。
②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的 ,晶胞密度为
,晶胞密度为_____  (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
(1)基态Ti原子的价层电子轨道表示式为
(2)区分晶态
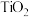 和非晶态
和非晶态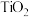 最可靠的科学方法是
最可靠的科学方法是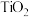 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为(3)一种由
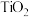 形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。
形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。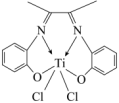
②该配合物中心离子是
(4)已知配合物的稳定性:
 ,其原因是
,其原因是(5)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为
 ,晶胞如图所示(氢未标出)。
,晶胞如图所示(氢未标出)。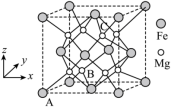
 ,B点原子的分数坐标为
,B点原子的分数坐标为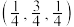 ,则C点原子的分数坐标为
,则C点原子的分数坐标为②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的
 ,晶胞密度为
,晶胞密度为 (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
3 . 上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是___________ ,写出其基态原子的最外层电子排布图:___________ 。
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。___________ 种。
②Ni(cod)2分子内存在的作用力有___________ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(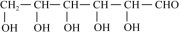 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 ___________ 。
(4)红银矿NiAs晶体结构如图所示:___________ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和___________ 。
③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为___________ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
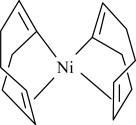
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(
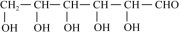 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 (4)红银矿NiAs晶体结构如图所示:
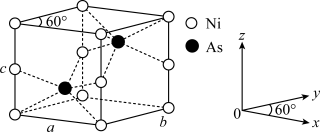
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
4 . 镁 可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:
可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:
(1)基态 原子的核外电子有
原子的核外电子有_______ 种空间运动状态,在元素周期表中, 和
和 均与
均与 相邻,这三种元素第一电离能由大到小的顺序是
相邻,这三种元素第一电离能由大到小的顺序是_______ 。
(2) 可用于
可用于 的冶炼:
的冶炼: ,基态
,基态 的价电子排布图(轨道表示式)为
的价电子排布图(轨道表示式)为_______ , 的熔点
的熔点 比
比 (714
(714 )低,其原因是
)低,其原因是_______ 。
(3)大黄素的分子结构如图所示,其中碳原子的杂化轨道类型是_______ ,分子中至少有_______ 个原子共平面,一定条件下,大黄素分子中的_______ 原子能提供孤对电子与 形成配位键。
形成配位键。 和
和 三种元素组成的晶体
三种元素组成的晶体 ,其立方晶胞如图,
,其立方晶胞如图, 与
与 的最小核间距大于
的最小核间距大于 与
与 的最小核间距,
的最小核间距, 与
与 为整数,则
为整数,则 在晶胞中的位置为
在晶胞中的位置为_______ , 的配位数是
的配位数是_______ ,若晶胞参数为 ,则晶体密度
,则晶体密度
_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:
可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:(1)基态
 原子的核外电子有
原子的核外电子有 和
和 均与
均与 相邻,这三种元素第一电离能由大到小的顺序是
相邻,这三种元素第一电离能由大到小的顺序是(2)
 可用于
可用于 的冶炼:
的冶炼: ,基态
,基态 的价电子排布图(轨道表示式)为
的价电子排布图(轨道表示式)为 的熔点
的熔点 比
比 (714
(714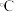 )低,其原因是
)低,其原因是(3)大黄素的分子结构如图所示,其中碳原子的杂化轨道类型是
 形成配位键。
形成配位键。
 和
和 三种元素组成的晶体
三种元素组成的晶体 ,其立方晶胞如图,
,其立方晶胞如图, 与
与 的最小核间距大于
的最小核间距大于 与
与 的最小核间距,
的最小核间距, 与
与 为整数,则
为整数,则 在晶胞中的位置为
在晶胞中的位置为 的配位数是
的配位数是 ,则晶体密度
,则晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
5 . 铁及其化合物在生产生活中应用广泛。回答下列问题:
(1)基态Fe原子的价电子排布式是___________ 。
(2) 溶液与KSCN溶液混合,溶液呈红色,常用于检验
溶液与KSCN溶液混合,溶液呈红色,常用于检验 。
。
①基态K、S、N原子第一电离能大小顺序是___________ , 的空间构型是
的空间构型是___________ 。
②从结构角度分析 易被氧化成
易被氧化成 的原因:
的原因:___________ 。
(3)邻二氮菲( )与
)与 形成图1所示的红色配合物离子,常用于测定
形成图1所示的红色配合物离子,常用于测定 的浓度。
的浓度。___________ 。
②与邻二氮菲相比,配合物离子中∠CNC较___________ (填“大”“小”或“相同”),原因是___________ 。
③测定 浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:
浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:___________ 。
(4)铁和碳能形成图2所示的晶胞。该晶胞可以看成是在铁晶胞中插入若干碳原子,但晶胞体积不变。铁碳晶体的化学式是___________ ,铁晶体转化为铁碳晶体时晶体密度净增___________ %(结果保留2位有效数字)。
(1)基态Fe原子的价电子排布式是
(2)
 溶液与KSCN溶液混合,溶液呈红色,常用于检验
溶液与KSCN溶液混合,溶液呈红色,常用于检验 。
。①基态K、S、N原子第一电离能大小顺序是
 的空间构型是
的空间构型是②从结构角度分析
 易被氧化成
易被氧化成 的原因:
的原因:(3)邻二氮菲(
 )与
)与 形成图1所示的红色配合物离子,常用于测定
形成图1所示的红色配合物离子,常用于测定 的浓度。
的浓度。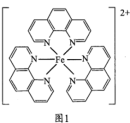
②与邻二氮菲相比,配合物离子中∠CNC较
③测定
 浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:
浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:(4)铁和碳能形成图2所示的晶胞。该晶胞可以看成是在铁晶胞中插入若干碳原子,但晶胞体积不变。铁碳晶体的化学式是

您最近一年使用:0次
解题方法
6 . 氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,形成的化合物有:N2F2、HBF4、 等。回答下列问题:
等。回答下列问题:
(1)氟元素基态原子最高能级电子的电子云形状为___________ ,下列为氟原子激发态的电子排布式的是___________ (填序号)。
A.1s22s22p43s1 B.1s22s22p6 C.1s22s22p5 D.1s22s12p6
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为___________ 。
②N2F2结构式为___________ ,其分子中 键与
键与 键的数目之比为
键的数目之比为___________ 。
(3)氟硼酸(HBF4,属于强酸)可由HF和BF3化合生成,常用于替代浓硫酸作铅蓄电池的电解质溶液,从化学键形成角度分析HF与BF3能化合的原因___________ 。
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性___________ (填“增强”或“减弱”), 中C-C键的键长比石墨中C-C键的
中C-C键的键长比石墨中C-C键的___________ (填“长”或“短”)。___________ ,设NA为阿伏加德罗常数的值则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
 等。回答下列问题:
等。回答下列问题:(1)氟元素基态原子最高能级电子的电子云形状为
A.1s22s22p43s1 B.1s22s22p6 C.1s22s22p5 D.1s22s12p6
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为
②N2F2结构式为
 键与
键与 键的数目之比为
键的数目之比为(3)氟硼酸(HBF4,属于强酸)可由HF和BF3化合生成,常用于替代浓硫酸作铅蓄电池的电解质溶液,从化学键形成角度分析HF与BF3能化合的原因
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物
 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性 中C-C键的键长比石墨中C-C键的
中C-C键的键长比石墨中C-C键的
 (列出计算式)。
(列出计算式)。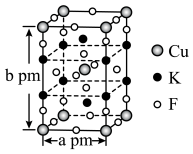
您最近一年使用:0次
解题方法
7 . 大多有机反应的速率较慢,实际反应中都需要加入一定量的催化剂,其中铜离子、冠醚都是有机反应中的催化剂。回答下列问题:
(1)基态 的价电子排布图为
的价电子排布图为_______ ;与基态 相比,失去1个电子所需能量较大的是
相比,失去1个电子所需能量较大的是_______ (填“ ”或“
”或“ ”),原因为
”),原因为_______ 。
(2)若将 转化为螯合物,会降低其催化效果。某
转化为螯合物,会降低其催化效果。某 螯合物的结构简式如图所示,其中
螯合物的结构简式如图所示,其中 的配位数为
的配位数为_______ ,碳原子的杂化方式为_______ 。 和
和 的混合溶液中将
的混合溶液中将 筛出(结构简式如图所示),其原理为
筛出(结构简式如图所示),其原理为_______ 。 轴投影图如图所示,已知晶胞参数为
轴投影图如图所示,已知晶胞参数为 ,铜原子半径为
,铜原子半径为 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。_______ 。
②该晶体的空间利用率为_______ (用含a、b的代数式表示);密度为_______ (用含 的代数式表示)
的代数式表示) 。
。
(1)基态
 的价电子排布图为
的价电子排布图为 相比,失去1个电子所需能量较大的是
相比,失去1个电子所需能量较大的是 ”或“
”或“ ”),原因为
”),原因为(2)若将
 转化为螯合物,会降低其催化效果。某
转化为螯合物,会降低其催化效果。某 螯合物的结构简式如图所示,其中
螯合物的结构简式如图所示,其中 的配位数为
的配位数为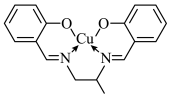
 和
和 的混合溶液中将
的混合溶液中将 筛出(结构简式如图所示),其原理为
筛出(结构简式如图所示),其原理为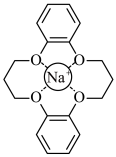
 轴投影图如图所示,已知晶胞参数为
轴投影图如图所示,已知晶胞参数为 ,铜原子半径为
,铜原子半径为 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。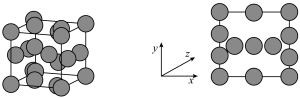
②该晶体的空间利用率为
 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
2024-04-16更新
|
135次组卷
|
2卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
名校
解题方法
8 . 已知A、B、C、D、E是周期表中前四周期原子序数依次增大的五种元素,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体;含E元素的硫酸盐溶液是制备波尔多液的原料之一,按要求回答下列问题:
(1)五种元素中第一电离能最大的是___________ ,电负性最大的是___________ 。(以上两空均填元素名称)
(2)E元素所在周期中基态原子的单电子数最多的元素是___________ 。(填元素符号)
(3)M分子中B原子的轨道杂化类型为___________ ,M分子中两种键角的大小关系是___________ 。(用∠XYZ表示,X、Y、Z代表元素符号)
(4)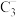 的空间构型为
的空间构型为___________ ;化合物CA3的沸点比BA4的高,其主要原因是___________ 。
(5)向E元素的硫酸盐溶液中通入过量的CA3,得到深蓝色的透明溶液,在此溶液中加入乙醇,析出深蓝色的晶体,此晶体中存在的化学键类型有___________ 。(填代号)
A.离子键 B.σ键 C.非极性共价键 D.配位键 E.金属键 F.氢键
(6)如图是D、E两种元素形成的化合物的晶胞结构示意图,D的配位数为___________ ,已知晶胞中最近两个D原子间距离为a nm,阿伏加德罗常数用NA表示,则该晶体的密度为___________ g/cm3。(用含a、NA的表达式表示)
(1)五种元素中第一电离能最大的是
(2)E元素所在周期中基态原子的单电子数最多的元素是
(3)M分子中B原子的轨道杂化类型为
(4)
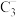 的空间构型为
的空间构型为(5)向E元素的硫酸盐溶液中通入过量的CA3,得到深蓝色的透明溶液,在此溶液中加入乙醇,析出深蓝色的晶体,此晶体中存在的化学键类型有
A.离子键 B.σ键 C.非极性共价键 D.配位键 E.金属键 F.氢键
(6)如图是D、E两种元素形成的化合物的晶胞结构示意图,D的配位数为

您最近一年使用:0次
2024-04-14更新
|
93次组卷
|
2卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
名校
解题方法
9 . 钴及其化合物在工业生产中具有广泛的用途,特别是作为工业生产的催化剂,钴及其化合物发挥了重要的作用。请回答下列问题:
(1)钴及其化合物广泛用作催化剂,说明钴元素在元素周期表中的位置为_______(填字母)。
(2)中国科学院院士、大连化学物理研究所研究员张涛及其团队开发出新型双原子催化剂(DACs),在丙烷脱氢性能上,该新型双原子催化剂优于单原子催化剂,其催化原理如图所示:_______ ,N原子为 杂化,未杂化的p轨道中容纳的电子数为
杂化,未杂化的p轨道中容纳的电子数为_______ 个;Zn或Co与N原子形成配位键时,提供孤电子对的原子是_______ (填元素符号);丙烷分解为丙烯的过程中,形成的化学键有_______ (填字母)。
A. 键 B.σ键 C.π键
键 B.σ键 C.π键
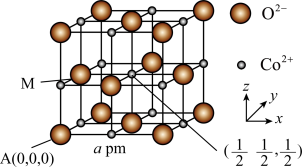
(3)CoO是石油化工中的一种催化剂,一种CoO的晶胞结构如图所示,该立方晶胞边长为a pm,设阿伏加德罗常数的值为 。
。 的分数坐标为
的分数坐标为_______ ;每个 周围与其距离最近且相等的
周围与其距离最近且相等的 共有
共有_______ 个;该CoO晶体的密度是_______ g⋅cm (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)钴及其化合物广泛用作催化剂,说明钴元素在元素周期表中的位置为_______(填字母)。
| A.主族元素 | B.金属与非金属分界线 |
| C.稀土元素 | D.过渡金属元素 |
(2)中国科学院院士、大连化学物理研究所研究员张涛及其团队开发出新型双原子催化剂(DACs),在丙烷脱氢性能上,该新型双原子催化剂优于单原子催化剂,其催化原理如图所示:

 杂化,未杂化的p轨道中容纳的电子数为
杂化,未杂化的p轨道中容纳的电子数为A.
 键 B.σ键 C.π键
键 B.σ键 C.π键(3)CoO是石油化工中的一种催化剂,一种CoO的晶胞结构如图所示,该立方晶胞边长为a pm,设阿伏加德罗常数的值为
 。
。
 的分数坐标为
的分数坐标为 周围与其距离最近且相等的
周围与其距离最近且相等的 共有
共有 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-04-11更新
|
140次组卷
|
3卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
名校
解题方法
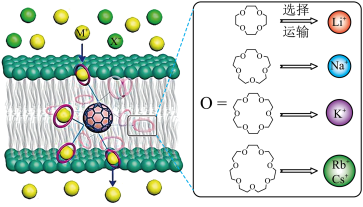
10 . 科学家借用 核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。图甲中的有机物为“冠醚”命名规则是“环上原子的个数-冠(醚)-氧原子的个数”。几种冠醚与识别的碱金属离子的有关数据如下表所示。回答下列问题:
核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。图甲中的有机物为“冠醚”命名规则是“环上原子的个数-冠(醚)-氧原子的个数”。几种冠醚与识别的碱金属离子的有关数据如下表所示。回答下列问题:
回答下列问题:
(1)基态 的最外层电子排布式为
的最外层电子排布式为_________ 。
(2)运输 的冠醚的名称是
的冠醚的名称是_________ 。冠醚与碱金属离子之间存在微弱的配位键,配位原子的杂化轨道类型是_________ 。
(3)18-冠-6不能识别和运输 和
和 的原因是
的原因是_________ 。图甲中冠醚不能识别和运输X-的主要原因可能是_________ 。
(4) 的结构如图乙所示。1mol
的结构如图乙所示。1mol 含
含_________ mol  键。
键。

(5) 铷晶胞为体心立方堆积,其原子的空间利用率为_________ (用含π的式子表示)。晶胞参数为a pm,设NA为阿伏加德罗常数的值,则物的密度为_________ 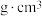 (列计算表达式)。
(列计算表达式)。
 核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。图甲中的有机物为“冠醚”命名规则是“环上原子的个数-冠(醚)-氧原子的个数”。几种冠醚与识别的碱金属离子的有关数据如下表所示。回答下列问题:
核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。图甲中的有机物为“冠醚”命名规则是“环上原子的个数-冠(醚)-氧原子的个数”。几种冠醚与识别的碱金属离子的有关数据如下表所示。回答下列问题:
甲
| 冠醚 | 冠醚空腔的直径/pm | 适合的粒子(直径)/pm |
| 12-冠-4 | 120~150 |  (152) (152) |
| 15-冠-5 | 170~220 |  (204) (204) |
| 18-冠-6 | 260~320 |  (276) (276) |
| _______ | 340~430 | 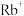 (304) (304) |
 (334) (334) |
(1)基态
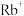 的最外层电子排布式为
的最外层电子排布式为(2)运输
 的冠醚的名称是
的冠醚的名称是(3)18-冠-6不能识别和运输
 和
和 的原因是
的原因是(4)
 的结构如图乙所示。1mol
的结构如图乙所示。1mol 含
含 键。
键。
(5) 铷晶胞为体心立方堆积,其原子的空间利用率为
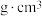 (列计算表达式)。
(列计算表达式)。
您最近一年使用:0次



