1 . 铁及其化合物在生产生活中应用广泛。回答下列问题:
(1)基态Fe原子的价电子排布式是___________ 。
(2) 溶液与KSCN溶液混合,溶液呈红色,常用于检验
溶液与KSCN溶液混合,溶液呈红色,常用于检验 。
。
①基态K、S、N原子第一电离能大小顺序是___________ , 的空间构型是
的空间构型是___________ 。
②从结构角度分析 易被氧化成
易被氧化成 的原因:
的原因:___________ 。
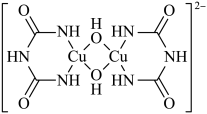
(3)邻二氮菲( )与
)与 形成图1所示的红色配合物离子,常用于测定
形成图1所示的红色配合物离子,常用于测定 的浓度。
的浓度。___________ 。
②与邻二氮菲相比,配合物离子中∠CNC较___________ (填“大”“小”或“相同”),原因是___________ 。
③测定 浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:
浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:___________ 。
(4)铁和碳能形成图2所示的晶胞。该晶胞可以看成是在铁晶胞中插入若干碳原子,但晶胞体积不变。铁碳晶体的化学式是___________ ,铁晶体转化为铁碳晶体时晶体密度净增___________ %(结果保留2位有效数字)。
(1)基态Fe原子的价电子排布式是
(2)
 溶液与KSCN溶液混合,溶液呈红色,常用于检验
溶液与KSCN溶液混合,溶液呈红色,常用于检验 。
。①基态K、S、N原子第一电离能大小顺序是
 的空间构型是
的空间构型是②从结构角度分析
 易被氧化成
易被氧化成 的原因:
的原因:(3)邻二氮菲(
 )与
)与 形成图1所示的红色配合物离子,常用于测定
形成图1所示的红色配合物离子,常用于测定 的浓度。
的浓度。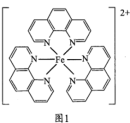
②与邻二氮菲相比,配合物离子中∠CNC较
③测定
 浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:
浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:(4)铁和碳能形成图2所示的晶胞。该晶胞可以看成是在铁晶胞中插入若干碳原子,但晶胞体积不变。铁碳晶体的化学式是

您最近一年使用:0次
解题方法
2 . 氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,形成的化合物有:N2F2、HBF4、 等。回答下列问题:
等。回答下列问题:
(1)氟元素基态原子最高能级电子的电子云形状为___________ ,下列为氟原子激发态的电子排布式的是___________ (填序号)。
A.1s22s22p43s1 B.1s22s22p6 C.1s22s22p5 D.1s22s12p6
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为___________ 。
②N2F2结构式为___________ ,其分子中 键与
键与 键的数目之比为
键的数目之比为___________ 。
(3)氟硼酸(HBF4,属于强酸)可由HF和BF3化合生成,常用于替代浓硫酸作铅蓄电池的电解质溶液,从化学键形成角度分析HF与BF3能化合的原因___________ 。
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性___________ (填“增强”或“减弱”), 中C-C键的键长比石墨中C-C键的
中C-C键的键长比石墨中C-C键的___________ (填“长”或“短”)。___________ ,设NA为阿伏加德罗常数的值则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
 等。回答下列问题:
等。回答下列问题:(1)氟元素基态原子最高能级电子的电子云形状为
A.1s22s22p43s1 B.1s22s22p6 C.1s22s22p5 D.1s22s12p6
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为
②N2F2结构式为
 键与
键与 键的数目之比为
键的数目之比为(3)氟硼酸(HBF4,属于强酸)可由HF和BF3化合生成,常用于替代浓硫酸作铅蓄电池的电解质溶液,从化学键形成角度分析HF与BF3能化合的原因
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物
 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性 中C-C键的键长比石墨中C-C键的
中C-C键的键长比石墨中C-C键的
 (列出计算式)。
(列出计算式)。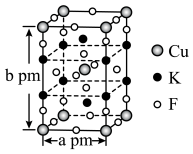
您最近一年使用:0次
3 .  是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
(1)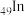 的价层电子排布式为
的价层电子排布式为_______ 。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋量子数,对于基态S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数,对于基态S原子,其价电子自旋磁量子数的代数和为_______ 。S可以形成两种常见含氧酸,其通式为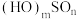 ,解释
,解释 酸性更强的原因
酸性更强的原因_______ 。
(3)矾土含 ,《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的
,《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。_______ 。
②X中C的杂化轨道类型是_______ ,X中不存在的作用力有_______ (填标号)。
A.配位键 B.离子键 C.共价键 D.氢键 F.范德华力
③茜素水溶性较好的原因是_______ 。
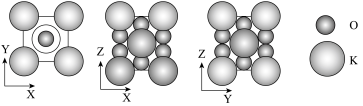
(4) (相对分子质量为Mr)的晶胞结构如图a所示,阿伏加德罗常数为
(相对分子质量为Mr)的晶胞结构如图a所示,阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为_______  (列计算式),图b为Cu原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置
(列计算式),图b为Cu原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置_______ (用“ ”表示S原子)。
”表示S原子)。
 是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:(1)
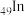 的价层电子排布式为
的价层电子排布式为(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋量子数,对于基态S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数,对于基态S原子,其价电子自旋磁量子数的代数和为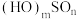 ,解释
,解释 酸性更强的原因
酸性更强的原因(3)矾土含
 ,《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的
,《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。
②X中C的杂化轨道类型是
A.配位键 B.离子键 C.共价键 D.氢键 F.范德华力
③茜素水溶性较好的原因是
(4)
 (相对分子质量为Mr)的晶胞结构如图a所示,阿伏加德罗常数为
(相对分子质量为Mr)的晶胞结构如图a所示,阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为 (列计算式),图b为Cu原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置
(列计算式),图b为Cu原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置 ”表示S原子)。
”表示S原子)。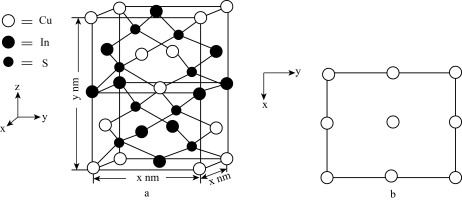
您最近一年使用:0次
4 . 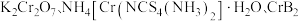 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: 原子有
原子有___________ 种能量不同的电子,价电子排布式为___________ 。
(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量, 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为___________  ;
;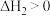 ,其原因是
,其原因是___________ 。
(3)雷氏盐的化学式为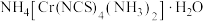 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为___________ 。
②雷氏盐中所含化学键类型___________ 。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一 分子的
分子的 模型名称为
模型名称为___________ ,与配体 互为等电子体的分子和离子有
互为等电子体的分子和离子有___________ 、___________ (各写1种)。
(4)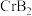 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
___________ (列出计算式)。
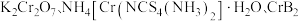 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: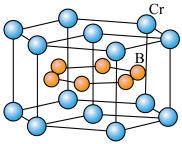
 原子有
原子有(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为 ;
; ,其原因是
,其原因是(3)雷氏盐的化学式为
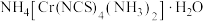 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②雷氏盐中所含化学键类型
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一
 分子的
分子的 模型名称为
模型名称为 互为等电子体的分子和离子有
互为等电子体的分子和离子有(4)
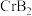 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
您最近一年使用:0次
5 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是_____ ;基态Se原子的价电子运动状态有_____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: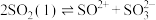 。
。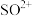 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为__ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和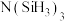 的结构如图所示,
的结构如图所示,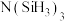 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为_______ ,二者中更易与 形成配位键的是
形成配位键的是_______ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是_______ 。
(5) -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。_______ 。晶胞中含有Se原子的数目为_______ ;则 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为______  (列出算式)。
(列出算式)。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
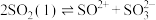 。
。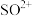 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和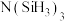 的结构如图所示,
的结构如图所示,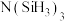 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是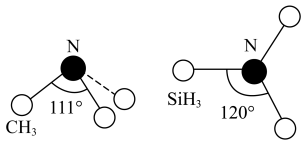
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)
 -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。
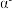 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为 (列出算式)。
(列出算式)。
您最近一年使用:0次
名校
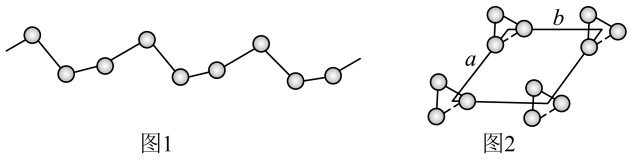
6 . 学习结构化学,有助于洞悉物质内部奥秘。回答下列问题:
(1)下图分别是2种不同形式元素周期表的局部区域。
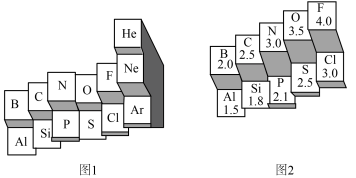
①根据图1预测,1~18号元素中位置最低的元素的基态原子核外电子排布式为___________ 。
②根据图2信息, 与水反应的化学方程式为
与水反应的化学方程式为___________ 。
③元素周期表中,Li-Mg、Be-Al、B-Si处于对角线位置,其单质与化合物的性质相似。下列说法正确的是___________ (填标号)。
A.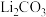 受热不易分解 B.单质锂不能与
受热不易分解 B.单质锂不能与 反应
反应
C.BeO熔点高 D.晶体硼为共价晶体
(2)分子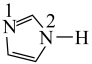 中大π键可表示为
中大π键可表示为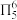 ,氮原子的杂化方式为
,氮原子的杂化方式为___________ ,p轨道提供2个电子形成大π键的N原子是___________ (填“1”或“2”)号N原子。
(3)① 在碱性条件下加入双缩脲[HN(CONH2)2]生成紫色物质,其结构如图所示。0.2mol该离子含有配位键的数目为
在碱性条件下加入双缩脲[HN(CONH2)2]生成紫色物质,其结构如图所示。0.2mol该离子含有配位键的数目为___________  。
。
②已知 具有对称的空间构型,
具有对称的空间构型, 中的两个
中的两个 被
被 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为___________ 。
(4)钾元素与氧元素形成的某些化合物可以作为宇宙飞船的供氧剂。其中一种化合物的晶胞在XY平面、XZ平面、YZ平面上的投影如图所示,钾元素和氧元素形成的化合物的化学式为___________ ,其晶胞参数为apm, 为阿伏加德罗常数的值,该晶胞的密度ρ=
为阿伏加德罗常数的值,该晶胞的密度ρ=___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)下图分别是2种不同形式元素周期表的局部区域。

①根据图1预测,1~18号元素中位置最低的元素的基态原子核外电子排布式为
②根据图2信息,
 与水反应的化学方程式为
与水反应的化学方程式为③元素周期表中,Li-Mg、Be-Al、B-Si处于对角线位置,其单质与化合物的性质相似。下列说法正确的是
A.
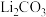 受热不易分解 B.单质锂不能与
受热不易分解 B.单质锂不能与 反应
反应C.BeO熔点高 D.晶体硼为共价晶体
(2)分子
 中大π键可表示为
中大π键可表示为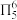 ,氮原子的杂化方式为
,氮原子的杂化方式为(3)①
 在碱性条件下加入双缩脲[HN(CONH2)2]生成紫色物质,其结构如图所示。0.2mol该离子含有配位键的数目为
在碱性条件下加入双缩脲[HN(CONH2)2]生成紫色物质,其结构如图所示。0.2mol该离子含有配位键的数目为 。
。
②已知
 具有对称的空间构型,
具有对称的空间构型, 中的两个
中的两个 被
被 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为(4)钾元素与氧元素形成的某些化合物可以作为宇宙飞船的供氧剂。其中一种化合物的晶胞在XY平面、XZ平面、YZ平面上的投影如图所示,钾元素和氧元素形成的化合物的化学式为
 为阿伏加德罗常数的值,该晶胞的密度ρ=
为阿伏加德罗常数的值,该晶胞的密度ρ= (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
7 . 短周期主族元素 和
和 的原子序数依次增大,其形成的化合物
的原子序数依次增大,其形成的化合物 和
和 常作非水系氧化还原液流电池的电解液,其结构如下图所示,下列说法正确的是
常作非水系氧化还原液流电池的电解液,其结构如下图所示,下列说法正确的是
 和
和 的原子序数依次增大,其形成的化合物
的原子序数依次增大,其形成的化合物 和
和 常作非水系氧化还原液流电池的电解液,其结构如下图所示,下列说法正确的是
常作非水系氧化还原液流电池的电解液,其结构如下图所示,下列说法正确的是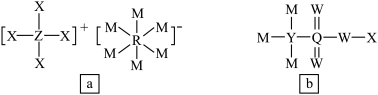
A.简单离子半径: |
B.最高价氧化物对应水化物的酸性: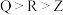 |
C.与 形成简单化合物的沸点: 形成简单化合物的沸点: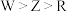 |
D.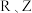 分别和 分别和 形成简单化合物的键角后者小 形成简单化合物的键角后者小 |
您最近一年使用:0次
2024-02-26更新
|
236次组卷
|
3卷引用:T11-元素周期表与元素周期律
名校
8 . 铁、铜、锌是形成许多金属材料和有机材料的重要组成元素。回答下列问题:
(1)金属铜在元素周期表_______ 区。
(2)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌: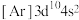 、②锌:
、②锌: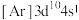 、③铜:
、③铜: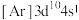 、④铜:
、④铜: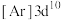 ,失去1个电子需要的能量由大到小排序是
,失去1个电子需要的能量由大到小排序是_______ 。
(3)向 溶液中滴加氨水可以得到
溶液中滴加氨水可以得到 型离子化合物,其阳离子结构如图所示。
型离子化合物,其阳离子结构如图所示。_______ 。
A.该阳离子中存在的化学键有极性共价键、配位键和氢键
B.溶液中的阴离子为正四面体结构
C.电负性大小:
D.往该溶液中继续加95%乙醇,并用玻璃棒摩擦试管壁,析出深蓝色晶体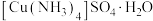
②该化合物加热时首先失去的组分是 ,原因是
,原因是_______ 。
(4)铁及其化合物在生产、生活中有重要应用。
①改性 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置
所在晶胞的位置_______ (填a或b或c)。 。铁-氰骨架组成小立方体,Fe粒子在顶点,
。铁-氰骨架组成小立方体,Fe粒子在顶点, 在棱上,两端均与Fe相连,立方体中心空隙可容纳
在棱上,两端均与Fe相连,立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。普鲁士蓝中
在图中省略)。普鲁士蓝中 与
与 个数之比为
个数之比为_______ ;该晶胞的化学式为_______ 。
(1)金属铜在元素周期表
(2)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:
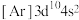 、②锌:
、②锌: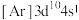 、③铜:
、③铜: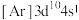 、④铜:
、④铜: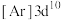 ,失去1个电子需要的能量由大到小排序是
,失去1个电子需要的能量由大到小排序是(3)向
 溶液中滴加氨水可以得到
溶液中滴加氨水可以得到 型离子化合物,其阳离子结构如图所示。
型离子化合物,其阳离子结构如图所示。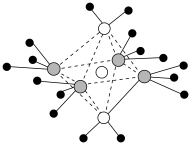
A.该阳离子中存在的化学键有极性共价键、配位键和氢键
B.溶液中的阴离子为正四面体结构
C.电负性大小:

D.往该溶液中继续加95%乙醇,并用玻璃棒摩擦试管壁,析出深蓝色晶体
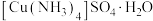
②该化合物加热时首先失去的组分是
 ,原因是
,原因是(4)铁及其化合物在生产、生活中有重要应用。
①改性
 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置
所在晶胞的位置
 。铁-氰骨架组成小立方体,Fe粒子在顶点,
。铁-氰骨架组成小立方体,Fe粒子在顶点, 在棱上,两端均与Fe相连,立方体中心空隙可容纳
在棱上,两端均与Fe相连,立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。普鲁士蓝中
在图中省略)。普鲁士蓝中 与
与 个数之比为
个数之比为
您最近一年使用:0次
9 . 含硅和硫元素的化合物种类繁多,应用广泛。请回答:
Ⅰ. 是生产多晶硅的副产物。
是生产多晶硅的副产物。
(1)基态硅原子的价层电子排布式为___________ 。
(2)已知 比
比 更易水解,导致
更易水解,导致 更易水解的因素有
更易水解的因素有___________ (填标号)。
a. 键极性更大 b.
键极性更大 b. 的原子半径更大
的原子半径更大
c. 键键能更大 d.
键键能更大 d. 有更多的价层轨道
有更多的价层轨道
Ⅱ.硫代硫酸盐可用在银盐照相中做定影液。
已知硫代硫酸根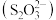 可看作是
可看作是 中的一个原子被
中的一个原子被 原子取代的产物。
原子取代的产物。
(3)基态 原子的价层电子排布式不能表示为
原子的价层电子排布式不能表示为 ,因为违背了
,因为违背了___________
(4)能确定晶体中各原子的位置(坐标),从而得出分子空间结构的一种方法是___________ 。
a.质谱法 b. 射线衍射 c.核磁共振氢谱 d.红外光谱
射线衍射 c.核磁共振氢谱 d.红外光谱
(5)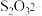 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成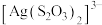 。分析判断
。分析判断 中的中心
中的中心 原子和端基
原子和端基 原子能否做配位原子并说明理由:
原子能否做配位原子并说明理由:___________ 。
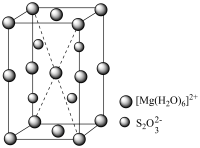
(6)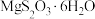 的晶胞如图,该晶胞中
的晶胞如图,该晶胞中 个数为
个数为___________ 。假设晶胞边长分别为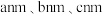 ,其摩尔质量为
,其摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为___________  (用相应字母表示)。
(用相应字母表示)。
Ⅰ.
 是生产多晶硅的副产物。
是生产多晶硅的副产物。(1)基态硅原子的价层电子排布式为
(2)已知
 比
比 更易水解,导致
更易水解,导致 更易水解的因素有
更易水解的因素有a.
 键极性更大 b.
键极性更大 b. 的原子半径更大
的原子半径更大c.
 键键能更大 d.
键键能更大 d. 有更多的价层轨道
有更多的价层轨道Ⅱ.硫代硫酸盐可用在银盐照相中做定影液。
已知硫代硫酸根
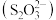 可看作是
可看作是 中的一个原子被
中的一个原子被 原子取代的产物。
原子取代的产物。(3)基态
 原子的价层电子排布式不能表示为
原子的价层电子排布式不能表示为 ,因为违背了
,因为违背了(4)能确定晶体中各原子的位置(坐标),从而得出分子空间结构的一种方法是
a.质谱法 b.
 射线衍射 c.核磁共振氢谱 d.红外光谱
射线衍射 c.核磁共振氢谱 d.红外光谱(5)
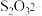 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成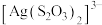 。分析判断
。分析判断 中的中心
中的中心 原子和端基
原子和端基 原子能否做配位原子并说明理由:
原子能否做配位原子并说明理由:(6)
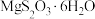 的晶胞如图,该晶胞中
的晶胞如图,该晶胞中 个数为
个数为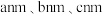 ,其摩尔质量为
,其摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为 (用相应字母表示)。
(用相应字母表示)。
您最近一年使用:0次
2023-10-09更新
|
278次组卷
|
6卷引用:T35-物质结构与性质
(已下线)T35-物质结构与性质(已下线)压轴题10 物质结构与性质综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)(已下线)T17-结构与性质浙江省强基联盟2023-2024学年高三上学期10月联考化学试题浙江强基联盟2023-2024学年第一学期高三年级10月联考 化学(已下线)专题04 物质结构与性质(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
名校
解题方法
10 . 金粉溶于过氧化氢-浓盐酸可以安全环保的制备氯金酸(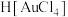 ),其化学方程式为:
),其化学方程式为: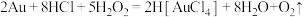 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
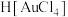 ),其化学方程式为:
),其化学方程式为: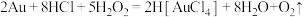 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.消耗1molAu,反应转移的电子数为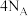 |
B.消耗2molHCl生成的 分子数为 分子数为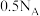 |
C.消耗85g ,产物中形成的配位键数目为 ,产物中形成的配位键数目为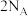 |
D.2mol液态水中含有的氢键数目为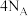 |
您最近一年使用:0次
2023-05-31更新
|
2007次组卷
|
7卷引用:阿伏伽德罗常数的应用
(已下线)阿伏伽德罗常数的应用(已下线)第9讲 物质的量浓度(已下线)选择题1-5(已下线)热点04 有关阿伏加德罗常数的正误判断重庆市南开中学高2023届高三下学期第十次质量检测化学试题化学02(15+4模式)2024年1月“九省联考”考前化学猜想卷2024届湖南省长沙市第一中高三下学期高考适应性演练(一)化学试题



