名校
1 . X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两对成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物。W是第三周期中原子半径最小的元素,N的核电荷数是W与Z的核电荷数之和。NW3能与Z,Q的氢化物形成六配位的配合物,其中两种配体的个数比为2:1,三个W离子位于外界。请回答下列问题:
(1)X、Z、N的元素符号为___________ ,___________ ,___________ 。
(2)比较Y、Z、Q的电负性大小___________ 。
(3)X2Q与ZX3分别为___________ 、___________ (填“极性分子”或“非极性分子”)。
(4)Z、W的最高价含氧酸的酸根的空间构型分别为___________ 、___________ 。
(5)N的价电子排布式___________ ,NW3与Z,Q的氢化物形成六配位的配合物化学式为___________ 。
(1)X、Z、N的元素符号为
(2)比较Y、Z、Q的电负性大小
(3)X2Q与ZX3分别为
(4)Z、W的最高价含氧酸的酸根的空间构型分别为
(5)N的价电子排布式
您最近一年使用:0次
名校
2 . 某纯碱工业的生产流程图如下

(1)该过程是___________ 由提出的(选填“索尔维”或“侯德榜”),写出Z物质的电子式___________
(2)①将原理中涉及到的第二周期的原子的半径按由大到小的顺序排列___________
②例举一个事实证明N的非金属性大于C___________
(3)先吸氨,后碳酸化的根本原因在于___________
a. 和
和 的极性不同
的极性不同
b. 和
和 的沸点不同
的沸点不同
c. 和
和 溶于水后,溶液的酸碱性不同
溶于水后,溶液的酸碱性不同
(4)析出Z之前通 的目的是
的目的是___________
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的 和
和 等气体。铜液吸收
等气体。铜液吸收 的反应是放热反应,其反应方程式为:
的反应是放热反应,其反应方程式为:
则铜液吸收CO的条件___________ (选填编号,下同),铜液再生条件___________
a.高压 b.低压 c.高温 d.低温

(1)该过程是
(2)①将原理中涉及到的第二周期的原子的半径按由大到小的顺序排列
②例举一个事实证明N的非金属性大于C
(3)先吸氨,后碳酸化的根本原因在于
a.
 和
和 的极性不同
的极性不同b.
 和
和 的沸点不同
的沸点不同c.
 和
和 溶于水后,溶液的酸碱性不同
溶于水后,溶液的酸碱性不同(4)析出Z之前通
 的目的是
的目的是(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的
 和
和 等气体。铜液吸收
等气体。铜液吸收 的反应是放热反应,其反应方程式为:
的反应是放热反应,其反应方程式为:
则铜液吸收CO的条件
a.高压 b.低压 c.高温 d.低温
您最近一年使用:0次
2021-10-08更新
|
232次组卷
|
2卷引用:上海市上海交通大学附属中学2021届高三期中考试化学试题
解题方法
3 . 将氟气通入氢氧化钠溶液中,可得OF2。OF2是一种无色、几乎无味的剧毒气体,主要用于氧化氟化反应、火箭工程助燃剂等。请回答下列问题:
(1)OF2的中文名称是_______ ,OF2中O的化合价为_______ ,OF2中O原子的杂化轨道类型是_______ ,OF2分子的空间构型为_______ 。
(2)与H2O分子相比,OF2分子的键角更_______ (填“大”或“小”)。
(3)与H2O分子相比, OF2分子的极性更_______ (填“大” 或“小”),原因是_______ ;
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)_______ 。
(1)OF2的中文名称是
(2)与H2O分子相比,OF2分子的键角更
(3)与H2O分子相比, OF2分子的极性更
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)
您最近一年使用:0次
4 . 二氧化碳开关型溶剂是指在通入和排出二氧化碳后,其溶液性质能发生可逆变化的溶剂,目前是一个研究热点,下式表示的就是该类溶剂的一个例子,属于胺眯(胍)混合体系(-R为烃基):

请回答下列问题;
(1)在通入或者排出二氧化碳时,该溶剂的极性和粘度是否有变化_________ ?说明理由___________ 。
(2)举 一个例子来说明该溶剂的用途(例子中可以不指明具体的物质)______________________ 。

请回答下列问题;
(1)在通入或者排出二氧化碳时,该溶剂的极性和粘度是否有变化
(2)举 一个例子来说明该溶剂的用途(例子中可以不指明具体的物质)
您最近一年使用:0次
名校
解题方法
5 . 已知A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A的一种核素中子数是质子数的2倍;B含有3个能级,且每个能级所含的电子数相同;D原子基态核外电子运动状态共8种;E为VIII族元素,基态E原子中有4个未成对电子且全在同一能级;E、F原子序数相差3。
(1)写出阳离子E2+的核外电子排布式_______ 。
(2)B、C、D简单气态氢化物的稳定性由小到大的顺序是_______ 。(用化学式书写)
(3)由A、B、C、D构成的物质(ADBC)的结构式是_______ ,其中B原子的杂化方式是_______ ,根据等电子体原理,可推测BCD-离子的空间构型是_______ 。
(4)E元素与D元素形成的ED晶体与NaCl晶体晶胞结构相似,则ED晶体中E离子的配位数为___ 。
(5)B、C与A可以形成多种分子,有关说法不正确的是_______ 。
①B2A2分子中σ键与π键的个数比为3︰2
②CA3和BA4的VSEPR构型相同
③C2A4分子、CA3分子都可以做配体与某些金属离子形成配位键
④BA4是由非极性键构成的非极性分子
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞结构如图乙所示,原子之间相互位置关系的平面图如丙所示。
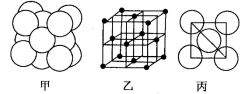
若F原子半径为acm,则F单质晶体的密度为_______ g·cm-3(只列出计算式,阿伏加德罗常数的值为NA)。
(1)写出阳离子E2+的核外电子排布式
(2)B、C、D简单气态氢化物的稳定性由小到大的顺序是
(3)由A、B、C、D构成的物质(ADBC)的结构式是
(4)E元素与D元素形成的ED晶体与NaCl晶体晶胞结构相似,则ED晶体中E离子的配位数为
(5)B、C与A可以形成多种分子,有关说法不正确的是
①B2A2分子中σ键与π键的个数比为3︰2
②CA3和BA4的VSEPR构型相同
③C2A4分子、CA3分子都可以做配体与某些金属离子形成配位键
④BA4是由非极性键构成的非极性分子
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞结构如图乙所示,原子之间相互位置关系的平面图如丙所示。

若F原子半径为acm,则F单质晶体的密度为
您最近一年使用:0次
2021-08-03更新
|
231次组卷
|
2卷引用:黑龙江省大庆市2020届高三第一次质量检测化学试题
6 . 肼(N2H4)的沸点为113°C,燃烧热为642kJ·mol-1,可作为碱性燃料电池的燃料。下列说法中,正确的是
| A.肼是由极性键和非极性键构成的非极性分子 |
| B.由肼的沸点较高可推测肼分子间能形成氢键 |
| C.肼碱性燃料电池中,正极的电极反应为:N2H4+4OH--4e-=N2+4H2O |
| D.肼燃烧的热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(g) ∆H=-642kJ·mol-1 |
您最近一年使用:0次



