1 . 按要求解答下列各题。
(1)黄铜是人类最早使用的合金之一,主要由 和
和 组成。基态
组成。基态 原子的核外价层电子排布图为
原子的核外价层电子排布图为_______ ;第二电离能
_______ (填“<”“>”或“=”)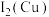 。
。
(2) 和
和 中
中 之间以双键结合,
之间以双键结合, 之间以单键结合。请你预测
之间以单键结合。请你预测 和
和 分子的空间结构为
分子的空间结构为_______ 。 分子中
分子中
_______  分子中
分子中 (选填“<”“>”或“=”)。
(选填“<”“>”或“=”)。
(3)甲醇的沸点(64.7℃)介于水和甲硫醇 ,其原因是
,其原因是_______ 。
(1)黄铜是人类最早使用的合金之一,主要由
 和
和 组成。基态
组成。基态 原子的核外价层电子排布图为
原子的核外价层电子排布图为
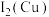 。
。(2)
 和
和 中
中 之间以双键结合,
之间以双键结合, 之间以单键结合。请你预测
之间以单键结合。请你预测 和
和 分子的空间结构为
分子的空间结构为 分子中
分子中
 分子中
分子中 (选填“<”“>”或“=”)。
(选填“<”“>”或“=”)。(3)甲醇的沸点(64.7℃)介于水和甲硫醇
 ,其原因是
,其原因是
您最近一年使用:0次
解题方法
2 . 按要求回答下列问题:
(1)前三周期元素中,基态原子核外有7组成对电子的原子,其价层电子的轨道表示式为___________ 。
(2)已知H2O2的沸点为152℃,H2S的沸点-60.4℃。请解释两者沸点差异的原因___________ 。
(3)BF3和NaBF4是硼的重要化合物,微粒中F-B-F键角:BF3___________  (填“>”、“<”或“=” )。理由是
(填“>”、“<”或“=” )。理由是___________ 。
(4)将CH3COOH、FCH2COOH、CH3CH2COOH的酸性由强到弱排序___________ ,并解释原因___________ 。
(1)前三周期元素中,基态原子核外有7组成对电子的原子,其价层电子的轨道表示式为
(2)已知H2O2的沸点为152℃,H2S的沸点-60.4℃。请解释两者沸点差异的原因
(3)BF3和NaBF4是硼的重要化合物,微粒中F-B-F键角:BF3
 (填“>”、“<”或“=” )。理由是
(填“>”、“<”或“=” )。理由是(4)将CH3COOH、FCH2COOH、CH3CH2COOH的酸性由强到弱排序
您最近一年使用:0次
3 . 茶文化是中国人民对世界饮食文化的一大贡献,茶叶中含有少量的咖啡因(结构简式如图)。下列关于咖啡因的说法正确的是
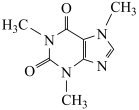

| A.咖啡因的分子式为C8H9N4O2 |
| B.咖啡因分子中sp2与 sp3杂化的C原子个数之比为5∶3 |
| C.咖啡因分子的一氯取代物只有3种 |
| D.咖啡因分子间存在氢键 |
您最近一年使用:0次
解题方法
4 . A、B、C、D、E为20号以前的元素,原子序数逐渐增大。A元素的原子最外层电子排布式为nsnnpn;A与C同一周期,基态C原子的s轨道与p轨道电子数相等;D、E元素的基态原子都只有一个未成对电子,它们相互作用形成的离子的电子层结构相同,并且离子最高能级的电子对数等于其最高能层的电子层数。下列说法正确的是
A.简单氢化物的沸点: |
| B.同周期元素第一电离能小于C的有5种 |
C.氧化物对应水化物的酸性: |
| D.A、D和C、E形成的化合物中可能均含有非极性共价键 |
您最近一年使用:0次
名校
解题方法
5 . 下列说法正确的是
| A.由于固态水中水分子以氢键结合成排列规整的晶体,所以冰的密度比水小 |
| B.N、H、O三种元素组成的化合物一定只含共价键 |
C.NaOH和 中的化学键类型完全相同,都属于离子化合物 中的化学键类型完全相同,都属于离子化合物 |
D. 和 和 分子中,各原子均满足最外层8电子的稳定结构 分子中,各原子均满足最外层8电子的稳定结构 |
您最近一年使用:0次
2024-03-08更新
|
117次组卷
|
3卷引用:浙江省杭州市长河高级中学2023-2024学年高一上学期期末考试化学试题
名校
6 . 下列对分子性质的解释中,不正确 的是

| A.水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键 |
| B.碘易溶于四氯化碳、甲烷难溶于水都可用“相似相溶”规律解释 |
| C.过氧化氢是含有极性键和非极性键的极性分子 |
D.青蒿素的分子式为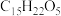 ,结构如图所示,该分子中包含7个手性碳原子 ,结构如图所示,该分子中包含7个手性碳原子 |
您最近一年使用:0次
2024-03-05更新
|
321次组卷
|
2卷引用:浙江省湖州市德清县求是高级中学有限公司2023-2024学年高二上学期期末考试化学试题
名校
7 . 过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是___________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是___________ ,中心离子的配位数为___________ 。
(3) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。 中P的杂化类型是
中P的杂化类型是___________ 。 的沸点比
的沸点比 的
的___________ 。(填“高”或“低”或“相同”)
 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(3)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。 中P的杂化类型是
中P的杂化类型是 的沸点比
的沸点比 的
的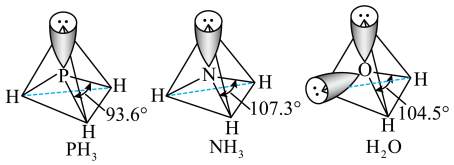
您最近一年使用:0次
2024-03-05更新
|
224次组卷
|
2卷引用:浙江省绍兴市诸暨中学暨阳分校2023-2024学年高二上学期期中考试化学试题
8 . 下列说法不正确 的是
| A.生铁硬度比钢大 | B.K的原子半径比Na大 |
| C.H2O的沸点比H2S高 | D.HBr的稳定性比HCl大 |
您最近一年使用:0次
名校
解题方法
9 . 碳、氮和氧是构建化合物的常见元素。请回答:
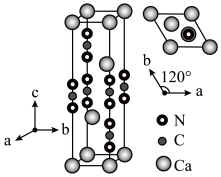
(1)某化合物的晶胞如图,其化学式是___________ ,晶体类型是___________ 。
(3)①聚吡咯作柔性电极材料,其单体为吡咯(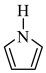 )。吡咯、呋喃(
)。吡咯、呋喃(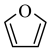 )、噻吩(
)、噻吩(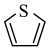 )都是平面杂环化合物,均存在共轭大π键,其中吡咯的N原子杂化方式为
)都是平面杂环化合物,均存在共轭大π键,其中吡咯的N原子杂化方式为___________ ;比较沸点:吡咯___________ 噻吩___________ 呋喃(填“>”、“<”或“=”),请说明理由___________ 。
②同位素示踪实验可证实S2O 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为 。过程ii中,
。过程ii中,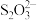 断裂的只有硫硫键,若过程i所用试剂是Na232SO3和35S,过程ii含硫产物是
断裂的只有硫硫键,若过程i所用试剂是Na232SO3和35S,过程ii含硫产物是___________ 。
(1)某化合物的晶胞如图,其化学式是
| A.电负性:B>N>O | B.离子半径:K+<S2−<Cl− |
| C.第一电离能:Ge<As<Se | D.基态Fe2+的简化电子排布式:[Ar]3d6 |
(3)①聚吡咯作柔性电极材料,其单体为吡咯(
 )。吡咯、呋喃(
)。吡咯、呋喃( )、噻吩(
)、噻吩( )都是平面杂环化合物,均存在共轭大π键,其中吡咯的N原子杂化方式为
)都是平面杂环化合物,均存在共轭大π键,其中吡咯的N原子杂化方式为②同位素示踪实验可证实S2O
 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为 。过程ii中,
。过程ii中,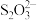 断裂的只有硫硫键,若过程i所用试剂是Na232SO3和35S,过程ii含硫产物是
断裂的只有硫硫键,若过程i所用试剂是Na232SO3和35S,过程ii含硫产物是
您最近一年使用:0次
2024-02-11更新
|
350次组卷
|
3卷引用:浙江省2023-2024学年高三上学期2月 模拟选考化学试题
浙江省2023-2024学年高三上学期2月 模拟选考化学试题浙江省余姚中学2023-2024学年高二下学期3月质量检测化学试题(已下线)压轴题10 物质结构与性质综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
10 . 回答下列问题
(1)①HClO的结构式为___________ ;
②水分子的空间构型___________ ;
③铁红的化学式___________ ;
(2)相同条件下,冰的密度比水小的原因是___________ ;
(3)氧元素的一种核素,核内有10个中子,该核素的符号可表示为___________ ;
(4)用氯气制备“84”消毒液的离子方程式为___________ ,消毒液消毒衣服时要先用温水稀释后再浸泡一段时间,但温度不能高于50℃。则温度不宜过高的原因是___________ ;
(5)写出铝粉与氢氧化钠溶液的反应的化学方程式,并用单线桥表示电子转移的方向和数目___________ 。
(6) 遇水产生氢气,该反应的化学方程式
遇水产生氢气,该反应的化学方程式___________ 。
(1)①HClO的结构式为
②水分子的空间构型
③铁红的化学式
(2)相同条件下,冰的密度比水小的原因是
(3)氧元素的一种核素,核内有10个中子,该核素的符号可表示为
(4)用氯气制备“84”消毒液的离子方程式为
(5)写出铝粉与氢氧化钠溶液的反应的化学方程式,并用单线桥表示电子转移的方向和数目
(6)
 遇水产生氢气,该反应的化学方程式
遇水产生氢气,该反应的化学方程式
您最近一年使用:0次



