2023高三·全国·专题练习
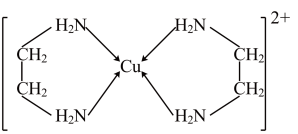
1 . 铜盐中毒可用青霉胺解毒,解毒原理如下: 能与青霉胺形成环状络合物,其结构如图所示。该环状络合物无毒、易溶于水,可经尿液排出。下列说法错误的是
能与青霉胺形成环状络合物,其结构如图所示。该环状络合物无毒、易溶于水,可经尿液排出。下列说法错误的是
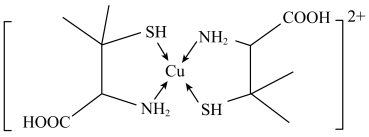
 能与青霉胺形成环状络合物,其结构如图所示。该环状络合物无毒、易溶于水,可经尿液排出。下列说法错误的是
能与青霉胺形成环状络合物,其结构如图所示。该环状络合物无毒、易溶于水,可经尿液排出。下列说法错误的是
A.比较硫化氢与氨气键角的大小: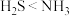 |
| B.第二周期元素中,第一电离能大于N的元素有1种 |
| C.该环状络合物易溶于水的主要原因是其与水可形成分子间氢键 |
| D.该环状络合物中,VSEPR模型为四面体或正四面体的非金属原子共有14个 |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
2 . 乙二胺 和三甲胺
和三甲胺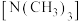 均为有机化合物,已知:乙二胺能与
均为有机化合物,已知:乙二胺能与 、
、 等溶液中的金属离子形成相对稳定的配离子,如
等溶液中的金属离子形成相对稳定的配离子,如 (
(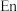 是乙二胺的简写),结构如图所示,下列说法正确的是
是乙二胺的简写),结构如图所示,下列说法正确的是
 和三甲胺
和三甲胺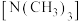 均为有机化合物,已知:乙二胺能与
均为有机化合物,已知:乙二胺能与 、
、 等溶液中的金属离子形成相对稳定的配离子,如
等溶液中的金属离子形成相对稳定的配离子,如 (
(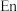 是乙二胺的简写),结构如图所示,下列说法正确的是
是乙二胺的简写),结构如图所示,下列说法正确的是
| A.乙二胺的沸点比三甲胺的高 | B.三甲胺分子中N的杂化方式为 |
C. 配离子的配位数为2 配离子的配位数为2 | D.三甲胺作为配体提供孤电子对 |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 硼及其化合物在储能材料、有机合成、医疗中具有广泛的应用价值。回答下列问题:
(1)无机苯(B3N3H6)在空气中较稳定,在150℃下分解为硼氮烷与氢,加氢成氨硼烷(NH3•BH3),NH3•BH3是目前最具潜力的储氢材料之一。
①NH3•BH3分子中存在配位键,___________ 原子提供孤对电子。
②元素的部分性质见表:
NH3•BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),它们之间存在静电相互吸引作用,称为“双氢键”,判断以下物质中的H呈现负电性的是___________ (填标号)。
A.N2H4 B.CH4 C.SiH4 D.AsH3
③NH3•BH3熔点104℃,苯熔点5.5℃,解释两者熔点差异的原因是___________ 。
④无机苯(B3N3H6)结构如图所示,分子中参与sp2杂化的原子有___________ ,形成大π键的电子由___________ 原子提供。
(2)NaBH4是有机合成中常用的还原剂,其阴离子空间构型是___________ ;NaBH4中存在___________ (填标号)。
A.离子键 B.非极性共价键 C.σ键 D.π键 E.氢键
(1)无机苯(B3N3H6)在空气中较稳定,在150℃下分解为硼氮烷与氢,加氢成氨硼烷(NH3•BH3),NH3•BH3是目前最具潜力的储氢材料之一。
①NH3•BH3分子中存在配位键,
②元素的部分性质见表:
| 元素 | H | B | C | N | Si | As |
| x(电负性) | 2.1 | 2.0 | 2.5 | 3.0 | 1.8 | 2.0 |
A.N2H4 B.CH4 C.SiH4 D.AsH3
③NH3•BH3熔点104℃,苯熔点5.5℃,解释两者熔点差异的原因是
④无机苯(B3N3H6)结构如图所示,分子中参与sp2杂化的原子有

(2)NaBH4是有机合成中常用的还原剂,其阴离子空间构型是
A.离子键 B.非极性共价键 C.σ键 D.π键 E.氢键
您最近一年使用:0次
2023高三·全国·专题练习
4 . 一种可吸附甲醇的材料,其化学式为 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 为平面结构。
为平面结构。

下列说法正确的是
 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 为平面结构。
为平面结构。
下列说法正确的是
| A.该晶体中无氢键 |
B.基态原子的第一电离能: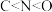 |
C.基态原子未成对电子数: |
| D.晶体中B、N和O原子轨道的杂化类型不同 |
您最近一年使用:0次
解题方法
5 . 近年来,光催化剂的研究是材料领域的热点方向。如图一种 配合物复合光催化剂,可将
配合物复合光催化剂,可将 转化为
转化为 。下列说法错误的是
。下列说法错误的是

 配合物复合光催化剂,可将
配合物复合光催化剂,可将 转化为
转化为 。下列说法错误的是
。下列说法错误的是
A.该配合物中 的配位数是6,中心离子为 的配位数是6,中心离子为 |
B. 配合物中第二周期元素的电负性由大到小的顺序为 配合物中第二周期元素的电负性由大到小的顺序为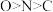 |
C.已知吡啶(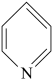 )中所有原子共平面,则吡啶中存在 )中所有原子共平面,则吡啶中存在 大π键 大π键 |
D. 的沸点比 的沸点比 高,主要原因是 高,主要原因是 分子间存在范德华力和氢键,而 分子间存在范德华力和氢键,而 分子间只有范德华力 分子间只有范德华力 |
您最近一年使用:0次
6 . 一种高分子材料G在生产、生活中用途广泛,其结构如图所示。合成G的两种单体为甲、乙,且甲的相对分子质量大于乙。下列叙述正确的是

| A.G只有1种官能团 | B.甲的沸点高于乙 |
| C.乙熔化时断裂共价键 | D.乙连续氧化不能生成甲 |
您最近一年使用:0次
2023高三·全国·专题练习
7 . 下列与分子性质有关的说法正确的是
A. 是非极性分子,Xe原子成键后不含孤电子对 是非极性分子,Xe原子成键后不含孤电子对 |
B.尿素 不溶于水,易溶于有机溶剂 不溶于水,易溶于有机溶剂 |
C.C的电负性强于Si,所以 的熔沸点高于 的熔沸点高于 |
D. 的酸性强于 的酸性强于 是因为F的电负性大,使 是因为F的电负性大,使 中O-H极性强 中O-H极性强 |
您最近一年使用:0次
2023高三·全国·专题练习
8 . 葡萄糖酸锌是一种常用的补锌剂,可由葡萄糖酸钙与硫酸锌直接反应制得: 。回答下列问题:
。回答下列问题:
(1) 与氨能形成稳定的
与氨能形成稳定的 ,Zn-N化学键称为
,Zn-N化学键称为_______ 键,其电子对由_______ (填元素符号)提供。
(2) 的空间构型为
的空间构型为_______ ,写出一种与其互为等电子体的分子:_______ (填化学式)。
(3)葡萄糖酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为_______ ,葡萄糖酸易溶于水的主要原因是_______ ; 中元素的电负性由大到小的顺序为
中元素的电负性由大到小的顺序为_______ 。

 。回答下列问题:
。回答下列问题:(1)
 与氨能形成稳定的
与氨能形成稳定的 ,Zn-N化学键称为
,Zn-N化学键称为(2)
 的空间构型为
的空间构型为(3)葡萄糖酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为
 中元素的电负性由大到小的顺序为
中元素的电负性由大到小的顺序为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
9 . 氮及其化合物在工业生产与生活中应用广泛。合成NH3实现了氮的人工固定,NH3在强碱条件下能被NaClO氧化生成N2H4,N2H4可被NaClO继续氧化生成N2,也可被HNO2氧化生成HN3,HN3是一种弱酸,酸性与醋酸相当。下列有关含氮化合物的性质与制备说法正确 的是
| A.分析结构可推得,N2H4可溶于水 |
| B.N2H4被NaClO氧化生成N2时,还原剂与氧化剂物质的量之比为2:1 |
| C.制备N2H4时应将NH3缓慢通入NaClO溶液中 |
| D.相同条件下溶液的碱性:NaHCO3弱于NaN3 |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
10 . 第二周期元素及其化合物应用广泛。锂可用作电极材料;铍和铝性质相似,BeO可用于制作坩埚;氨硼烷(NH3BH3)是一种固体储氢材料,可与水在催化剂作用下生成(NH4)3B3O6和H2,  的结构如图所示;碳能形成多种氧化物,金星大气层中含有的C2O3能与H2O反应生成H2C2O4,H2C2O4是二元弱酸,有还原性,可与多种金属离子形成沉淀或络合物;聚四氟乙烯材料可制作酸碱通用滴定管的活塞及化工反应器的内壁涂层。
的结构如图所示;碳能形成多种氧化物,金星大气层中含有的C2O3能与H2O反应生成H2C2O4,H2C2O4是二元弱酸,有还原性,可与多种金属离子形成沉淀或络合物;聚四氟乙烯材料可制作酸碱通用滴定管的活塞及化工反应器的内壁涂层。

下列有关物质结构与性质的说法正确的是
 的结构如图所示;碳能形成多种氧化物,金星大气层中含有的C2O3能与H2O反应生成H2C2O4,H2C2O4是二元弱酸,有还原性,可与多种金属离子形成沉淀或络合物;聚四氟乙烯材料可制作酸碱通用滴定管的活塞及化工反应器的内壁涂层。
的结构如图所示;碳能形成多种氧化物,金星大气层中含有的C2O3能与H2O反应生成H2C2O4,H2C2O4是二元弱酸,有还原性,可与多种金属离子形成沉淀或络合物;聚四氟乙烯材料可制作酸碱通用滴定管的活塞及化工反应器的内壁涂层。
下列有关物质结构与性质的说法正确的是
| A.NH3BH3分子中存在非极性共价键 |
B. 中B原子采用SP2杂化、O原子均采用sp3杂化 中B原子采用SP2杂化、O原子均采用sp3杂化 |
| C.NH3BH3中与氮原子相连的氢带部分负电荷,与硼原子相连的氢带部分正电荷 |
| D.CH3CH3与NH3BH3的原子总数、电子总数均相等,熔点比NH3BH3高 |
您最近一年使用:0次



