名校
1 . 已知 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是
 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是A.1 mol SiC晶体中含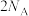 共价键 共价键 |
B.1 mol  和Fe(足量)充分反应后转移电子总数为 和Fe(足量)充分反应后转移电子总数为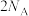 |
C.100 g质量分数为17%的 溶液中极性键数目为 溶液中极性键数目为 |
D.3.36 L  中含有σ键 中含有σ键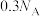 |
您最近一年使用:0次
名校
2 . “铜纳米催化剂室温催化氨硼烷产氢串联选择性还原催化3-硝基苯乙烯到3-氨基苯乙烯”在有机化学选择性加氢反应研究领域取得重要进展。
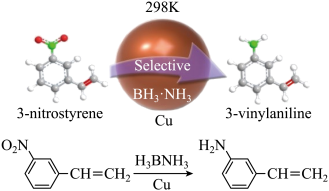
请回答下列问题:
(1)下列分别为B、C、N、Cu基态原子价电子排布图,其中正确的是_____(填标号)
(2)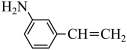 物质的沸点高于
物质的沸点高于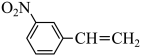 ,原因是
,原因是_____ ,硝基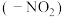 和氨基
和氨基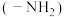 中N的杂化方式分别为
中N的杂化方式分别为_____ 。
(3)碳的第三种同素异形体——金刚石,其晶胞如图所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图_____(从A~D图中选填)。

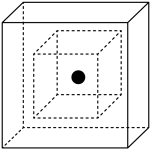
(4)SiC结构类似金刚石,则SiC为_____ 晶体。图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用●表示),其余Si原子位于大正方体的_____ 位置。
(5)科学研究表明, 是由
是由 、
、 、
、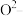 通过离子键而组成的复杂离子晶体。
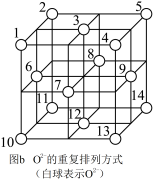
通过离子键而组成的复杂离子晶体。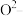 的重复排列方式如图b所示,
的重复排列方式如图b所示, 中有一半的
中有一半的 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半 和
和 地填充在正八面体空隙中,则
地填充在正八面体空隙中,则 晶体中,正四面体空隙数与
晶体中,正四面体空隙数与 数之比为
数之比为_____ ,其中有_____ %正四面体空隙填有 ,有
,有_____ %正八面体空隙没有被填充。

请回答下列问题:
(1)下列分别为B、C、N、Cu基态原子价电子排布图,其中正确的是_____(填标号)
A.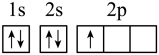 | B.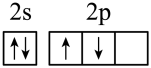 |
C.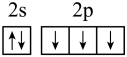 | D.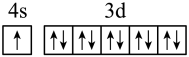 |
 物质的沸点高于
物质的沸点高于 ,原因是
,原因是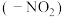 和氨基
和氨基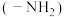 中N的杂化方式分别为
中N的杂化方式分别为(3)碳的第三种同素异形体——金刚石,其晶胞如图所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图_____(从A~D图中选填)。

A.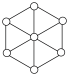 | B.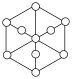 | C.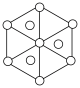 | D.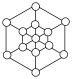 |


(5)科学研究表明,
 是由
是由 、
、 、
、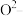 通过离子键而组成的复杂离子晶体。
通过离子键而组成的复杂离子晶体。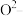 的重复排列方式如图b所示,
的重复排列方式如图b所示, 中有一半的
中有一半的 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半 和
和 地填充在正八面体空隙中,则
地填充在正八面体空隙中,则 晶体中,正四面体空隙数与
晶体中,正四面体空隙数与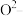 数之比为
数之比为 ,有
,有
您最近一年使用:0次
名校
解题方法
3 .  为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是A.3 g 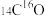 与 与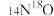 的混合气体,含有的中子数介于1.5 的混合气体,含有的中子数介于1.5 与1.6 与1.6 之间 之间 |
B.常温常压下,17 g  中含有的电子数为10 中含有的电子数为10 |
C.标准状况下,2.24 L  与1.12 L 与1.12 L  充分反应,生成的 充分反应,生成的 分子数目为0.1 分子数目为0.1 |
D.60 g  含有4 含有4 个Si-O键 个Si-O键 |
您最近一年使用:0次
名校
解题方法
4 . 下列说法正确的组合是
①组成分子晶体的粒子是原子
②在晶体中只要有阳离子就一定有阴离子
③晶体中分子间作用力越大,分子越稳定
④氯化钠熔化时离子键被破坏
⑤离子晶体中一定有离子键,分子晶体中肯定没有离子键
⑥ 晶体中每个硅原子与两个氧原子以共价键相结合
晶体中每个硅原子与两个氧原子以共价键相结合
①组成分子晶体的粒子是原子
②在晶体中只要有阳离子就一定有阴离子
③晶体中分子间作用力越大,分子越稳定
④氯化钠熔化时离子键被破坏
⑤离子晶体中一定有离子键,分子晶体中肯定没有离子键
⑥
 晶体中每个硅原子与两个氧原子以共价键相结合
晶体中每个硅原子与两个氧原子以共价键相结合| A.①②③ | B.①②④ | C.④⑤ | D.③⑤⑥ |
您最近一年使用:0次
2022-08-22更新
|
264次组卷
|
3卷引用:四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题
解题方法
5 . N、P、As及其化合物在工农业生产中用途非常广泛。回答下列问题:
(1)写出基态N原子的核外电子排布式___________ , 与N同周期的主族元素中,第一电离能比N大的元素是___________ (填元素符号) 。
(2)NH3是制造HNO3、化肥、炸药的重要原料,还可用于制冷。NH3的立体构型为___________ , 在工业合成NH3 (N2 + 3H2 2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为
2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为___________ , 原因是___________ 。
(3)H3PO2是一种重要的化工原料。已知:无机含氧酸分子中非羟基氧越多,酸性越强。1个非羟基氧是中强酸,2个非羟基氧是强酸。如H3PO4为中强酸,其结构简式为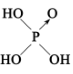 ;H3PO2也是一种中强酸,则H3PO2的结构简式为
;H3PO2也是一种中强酸,则H3PO2的结构简式为___________ ,写出H3PO2与足量NaOH溶液反应的化学方程式____________ 。
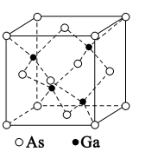
(4)GaAs 的熔点为1 238 °C,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为___________ 。已知:阿伏加德罗常数的值为NA,GaAs的摩尔质量为145g·mol-1,则GaAs的晶胞边长为___________ pm。
(1)写出基态N原子的核外电子排布式
(2)NH3是制造HNO3、化肥、炸药的重要原料,还可用于制冷。NH3的立体构型为
 2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为
2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为(3)H3PO2是一种重要的化工原料。已知:无机含氧酸分子中非羟基氧越多,酸性越强。1个非羟基氧是中强酸,2个非羟基氧是强酸。如H3PO4为中强酸,其结构简式为
 ;H3PO2也是一种中强酸,则H3PO2的结构简式为
;H3PO2也是一种中强酸,则H3PO2的结构简式为(4)GaAs 的熔点为1 238 °C,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为

您最近一年使用:0次
名校
解题方法
6 . NA为阿伏加德罗常数的值,下列说法错误的是
| A.3g14C16O与14N16O的混合气体,含有的中子数介于1.5NA与1.6NA之间 |
| B.常温常压下,17gNH3中含有的电子数为10NA |
| C.0.1mol乙烯与乙醇的混合物完全燃烧所消耗的O2分子数为0.3NA |
| D.60gSiO2和12g金刚石中各含有4NA个Si—O键和C—C键 |
您最近一年使用:0次
2022-05-29更新
|
398次组卷
|
2卷引用:四川省成都市2022届高三下学期第一次适应性考试理科综合化学试题
名校
解题方法
7 . 生命起源假说认为,在地球生命形成初期(约36亿年前),由NH3、CO、H2O、H2、H2S等小分子在放电条件下形成了多种氨基酸,继而合成了蛋白质而形成单细胞。
(1)写出基态S原子的价电子排布式____ ,其基态原子具有____ 种不同能量的电子。
(2)H2S的沸点低于H2O的沸点,其原因是____ 。
(3)NH3的VSEPR模型名称为____ ,H2O分子中孤对电子占据2个____ 杂化轨道。
(4)太阳能电池种类繁多,如铜铟镓硒镍薄膜太阳能电池等。1molNi(CO)4中π键与σ键的个数比为____ 。高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:____ 。
(5)①金刚石的晶胞如图,其中C原子的配位数是____ ;晶体硅、金刚砂(SiC)的结构与之相似,则金刚石、晶体硅、金刚砂的熔点由高到低的排列顺序是____ (用化学式表示);

②金刚石的晶胞参数为a pm。 1cm3晶体的平均质量为___ g(只要求列出算式,阿伏加德罗常数值为NA)
(1)写出基态S原子的价电子排布式
(2)H2S的沸点低于H2O的沸点,其原因是
(3)NH3的VSEPR模型名称为
(4)太阳能电池种类繁多,如铜铟镓硒镍薄膜太阳能电池等。1molNi(CO)4中π键与σ键的个数比为
(5)①金刚石的晶胞如图,其中C原子的配位数是

②金刚石的晶胞参数为a pm。 1cm3晶体的平均质量为
您最近一年使用:0次
2020-11-20更新
|
543次组卷
|
2卷引用:四川省遂宁市2021届高三零诊考试理综化学试题
名校
8 . 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均已单键结合,下列关于晶体说法正确的是
| A.C3N4晶体是分子晶体 |
| B.C3N4晶体中,C-N键的键长比金刚石中C-C键的键长要长 |
| C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 |
| D.C3N4晶体中微粒间通过离子键结合 |
您最近一年使用:0次
2020-03-23更新
|
191次组卷
|
20卷引用:四川省南充市阆中中学2020届高三化学《晶体类型与性质》专题练习
四川省南充市阆中中学2020届高三化学《晶体类型与性质》专题练习(已下线)上海市嘉定、黄浦区2010届高三第二次模拟考试化学试题(已下线)2012届浙江省杭州高中高三第二次月考化学试卷(已下线)2012届浙江省杭西高中高三上学期11月月考试卷2015-2016学年四川省南充高中高二下期末化学试卷2017届上海师范大学第二附属中学高三上学期期中考试化学试卷四川省棠湖中学2019-2020学年高二下学期期中考试化学试题四川省阿坝州九寨沟2019-2020学年高二上学期期末考试化学试题(已下线)2011-2012学年河南许昌鄢陵一高高二下学期期中考试化学试卷(已下线)2012-2013年湖北省仙桃市毛嘴高中高二上学期学业水平监测试化学卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷陕西省黄陵中学高新部2017-2018学年高二6月月考化学试题云南省楚雄州南华县民族中学2018-2019学年高二上学期期中考试化学试题贵州省剑河县二中2018-2019学年高二上学期期末考试化学试题云南省景东一中2018-2019学年高二下学期开学考试化学试题鲁科版高二化学物质结构与性质单元练习卷:第3章 物态的聚集状态与物质性质云南省新平县三中2019-2020学年高二上学期期中考试化学试题云南省开远市第二中学校2019-2020学年高二上学期期末考试化学试题上海市曹杨二中2016-2017学年高二下学期第一次考试化学(等级考)试题陕西省宝鸡市金台区2020-2021学年高二下学期期末考试化学试题
9 . 有关晶体的叙述中正确的是
| A.在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子 |
| B.在12 g金刚石中,含C—C共价键键数为4 NA |
| C.干冰晶体熔化只需克服分子间作用力 |
| D.金属晶体是由金属原子直接构成的 |
您最近一年使用:0次
2020-03-06更新
|
79次组卷
|
2卷引用:四川省南充市阆中中学高三化学《物质结构 元素周期律》测试题
名校
10 . 1999年美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰,下列判断中不正确的是
| A.原子晶体干冰有很高的熔沸点,有很大的硬度 |
| B.原子晶体干冰易气化,可用作制冷材料 |
| C.原子晶体干冰的硬度大,可用作耐磨材料 |
| D.每摩尔原子晶体干冰中含4mol C-O键 |
您最近一年使用:0次
2020-03-06更新
|
129次组卷
|
3卷引用:四川省南充市阆中中学2020届高三化学《晶体类型与性质》专题练习
四川省南充市阆中中学2020届高三化学《晶体类型与性质》专题练习【全国百强校】宁夏银川一中2017-2018学年高二下学期期末考试化学试题(已下线)3.2.2 共价晶体与分子晶体及晶体结构的复杂性-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)



