1 . A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如表①所示,只有E元素的单质能与水反应生成两种酸,甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素:W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
表①
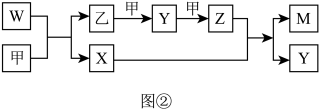
请回答下列问题:
(1)Z的化学式为___________ ;X分子的空间构型为___________ 。
(2)E的单质与水反应的离子方程式为___________ 。 D、E元素可分别与硅(Si)、钛(Ti)元素形成化合物,其中SiD2的熔点为1723℃,沸点2230℃,TiE4的熔点为-24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是___________ 。
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为___________ 。
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为___________ ,该温度下的平衡常数为___________ 。
表①
| B | D | |
| E |

请回答下列问题:
(1)Z的化学式为
(2)E的单质与水反应的离子方程式为
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为
您最近一年使用:0次
解题方法
2 . A、B、C、D、E、F六种元素均位于元素周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子占据四个原子轨道;D元素原子的成对电子总数是未成对电子总数的3倍;E与D位于同一主族;F位于第Ⅷ族,在地壳中含量排金属中第二位。
(1)F2+的价电子排布图为_______ 。
(2)B、C、D元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(3)B、C、D的某些氢化物的分子中都含有18个电子,B的这种氢化物的中心原子杂化方式为_______ ,等物质的量B、C、D的这种氢化物的分子中含有σ键的个数之比为_______ 。
(4)D常见的两种单质D2和D3,其中_______ (填化学式)在水中的溶解度更大。
(5)B、E可形成分子式为BE2的化合物,其电子式为_______ 。
(6)实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构,其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为_______ , 预测该化合物熔点_______ 金刚石(填“高于”或“低于”)。
(1)F2+的价电子排布图为
(2)B、C、D元素的第一电离能由大到小的顺序是
(3)B、C、D的某些氢化物的分子中都含有18个电子,B的这种氢化物的中心原子杂化方式为
(4)D常见的两种单质D2和D3,其中
(5)B、E可形成分子式为BE2的化合物,其电子式为
(6)实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构,其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为
您最近一年使用:0次
名校
解题方法
3 . 现有A、B、C、D、E、F六种短周期元素,其相关性质信息如下。请回答下列问题:
(1)元素B在周期表中的位置为_______ ;D与F原子按个数比为1:1形成物质的结构式为_______
(2)A、C、D对应的简单离子的半径由大到小的排序是_______ (用离子符号表示)。
(3)B元素和A元素能够形成一种超硬物质,沸点为2249℃。该化合物的晶体类型为_______ ;若将C元素最高价氧化物的水化物溶于水,需要破坏的作用力为_______ 。
(4)在含有A的氯化物溶液中滴加过量氨水的离子方程式为_______ 。
(5)用电子式表示化合物FE的形成过程_______ 。
(6)已知CED2是一种强氧化性漂白剂。请写出在碱性条件下,CED2和BD2反应的离子方程式_______ 。
| 元素 | 特征 | 元素 | 特征 |
| A | 常见金属,其最高价氧化物对应的水化物可以溶于强碱 | D | 在地壳中含量最多 |
| B | 常见化肥的主要元素,单质常温下呈气态 | E | 单质为黄绿色有毒气体 |
| C | 在短周期主族元素中,原子半径最大 | F | 原子的核外电子只有1个 |
(2)A、C、D对应的简单离子的半径由大到小的排序是
(3)B元素和A元素能够形成一种超硬物质,沸点为2249℃。该化合物的晶体类型为
(4)在含有A的氯化物溶液中滴加过量氨水的离子方程式为
(5)用电子式表示化合物FE的形成过程
(6)已知CED2是一种强氧化性漂白剂。请写出在碱性条件下,CED2和BD2反应的离子方程式
您最近一年使用:0次
名校
4 . A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)转化关系如图(反应条件略去),元素E形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
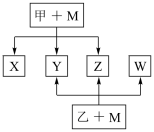
(1)写出M与甲的浓溶液加热时反应的化学方程式___________
(2)X、Y、Z、W属于同一类物质,这类化合物通常熔沸点较___________ (填“高”或“低”); X、Y、W都能与Z反应,则Z的结构式为___________
(3)将X、W与D2按1∶1∶n的物质的量之比通入Z中,充分反应后无气体剩余或生成,则n=___________ ,写出反应的化学方程式___________
(4)化合物ED2与元素B形成的某种单质能在高温下能发生置换反应,若反应中有1mol电子发生了转移,则参加反应的化合物ED2的质量为___________ g。
(5)元素B的另一种单质能导电,具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12g该单质中含有___________ NA个正六边形。

(1)写出M与甲的浓溶液加热时反应的化学方程式
(2)X、Y、Z、W属于同一类物质,这类化合物通常熔沸点较
(3)将X、W与D2按1∶1∶n的物质的量之比通入Z中,充分反应后无气体剩余或生成,则n=
(4)化合物ED2与元素B形成的某种单质能在高温下能发生置换反应,若反应中有1mol电子发生了转移,则参加反应的化合物ED2的质量为
(5)元素B的另一种单质能导电,具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12g该单质中含有
您最近一年使用:0次
5 . 在短周期主族元素中:
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是________ (填元素名称)。
(2)铝是活泼的金属元素,单质铝由于___________ ,而具有良好的抗腐蚀能力,美国化学家发现铝的“原子群”(如Al13、Al14、Al37)各具有与某种元素相似的化学性质,并符合元素周期律中的某些规律。例如:Al13与卤素具有相似的化学性质,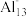 离子具有惰性气体元素的性质,可推测Al14的化学性质与
离子具有惰性气体元素的性质,可推测Al14的化学性质与________ 族元素相似。
(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
①写出甲元素的电子排布式____________ ,乙元素的原子结构示意图________________ 。
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于____________ 晶体,其化学式为_______________ 。
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是
(2)铝是活泼的金属元素,单质铝由于
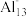 离子具有惰性气体元素的性质,可推测Al14的化学性质与
离子具有惰性气体元素的性质,可推测Al14的化学性质与(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
①写出甲元素的电子排布式
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于
您最近一年使用:0次
名校
解题方法
6 . 四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是________ 、________ ;杂化轨道分别是________ 、________ ;a分子的立体结构是________ 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________ 晶体、________ 晶体。
(3)Y与Z比较,电负性较大的是________ ,W2+离子的核外电子排布式是________ 。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
(3)Y与Z比较,电负性较大的是
您最近一年使用:0次
解题方法
7 . X、Y、Z、P、Q、W、R、T是元素周期表短周期中最常见的主族元素,且原子序数依次增大,其相关信息如下表:
(1)W元素在周期表的位置_____ ;T离子的结构示意图为____ 。
(2)将Q、Z、R的简单离子的半径从大到小排序____ (用离子符号表示);
R、T两种元素的最高价氧化物对应水化物的酸性较强的是____ (用化学式表示)。
(3)X、Y、Z三种元素的简单氢化物中,稳定性最强的化合物的电子式为____ ;化合物P2R溶液在空气中长期放置,会和氧气反应生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为____ 。
(4)根据下表中的信息,判断下列化合物固态时的晶体类型(填“离子晶体”…等)。
(5)分别写出Y、R最高价氧化物对应水化物的化学式____ 、____ ,铜能和这两种物质的浓溶液发生反应,请写出两个反应的化学方程式:_____ ;___________ ;
(6)P和Z能形成一种白色的固体,请用电子式表示该物质的形成过程:______ ;
| 元素 | 相关信息 |
| X | 其某一种同位素,被用作相对原子质量的标准 |
| Y | 其最高价氧化物对应水化物能与其气态氢化物发生化合反应 |
| P | 是短周期中(除稀有气体外)原子半径最大的元素 |
| Q | 存在质量数为25、中子数为13的核素 |
| W | 位于周期表第13列 |
| R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(2)将Q、Z、R的简单离子的半径从大到小排序
R、T两种元素的最高价氧化物对应水化物的酸性较强的是
(3)X、Y、Z三种元素的简单氢化物中,稳定性最强的化合物的电子式为
(4)根据下表中的信息,判断下列化合物固态时的晶体类型(填“离子晶体”…等)。
| 化合物 | X3Y4 | R2T2 |
| 主要物理性质 | 硬度可以和金刚石相媲美,熔点>3600°C | 常温下是一种橙黄色液体,熔点为﹣76°C |
| 晶体类型 |
(6)P和Z能形成一种白色的固体,请用电子式表示该物质的形成过程:
您最近一年使用:0次
2011·上海虹口·一模
8 . 能源材料已成为当今科学研究的热点。请回答下列问题:
(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示,某同学推断A的核外电子排布为:1s22s22p63s13p1,该电子排布式违背了__ ;若该原子核外电子确有三层,则该元素位于周期表__ 族,写出A燃烧后形成的氧化物的电子式:__ 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是__ (填序号)。
a.C60、Si60、N60都属于新型化合物
b.C60、Si60、N60互为同分异构体
c.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d.已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
(3)超导材料在节能、储能方面的应用。如图是超导材料元素在周期表中的分布,其中短周期元素中原子半径最大的是__ (填元素符号),其原子最外层有__ 种运动状态不同的电子,写出其最高价氧化物对应水化物的电离方程式:__ 。

(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示,某同学推断A的核外电子排布为:1s22s22p63s13p1,该电子排布式违背了
| I1 | I2 | I3 | I4 | …… | |
| 电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | …… |
a.C60、Si60、N60都属于新型化合物
b.C60、Si60、N60互为同分异构体
c.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d.已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
(3)超导材料在节能、储能方面的应用。如图是超导材料元素在周期表中的分布,其中短周期元素中原子半径最大的是

您最近一年使用:0次
9 . Ⅰ.有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为_________ ,其晶体属于________ 晶体
(2)乙的水溶液可以用来做__________________ (写出一种用途)
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则丁的电子式为_____________ 。
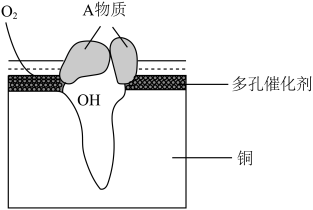
Ⅱ.某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入AgNO3溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含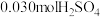 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
(1)该粉状锈中除了铜元素外还含有(写元素符号)_____ 元素.
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____ 。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为_____ 。
(1)甲的化学式为
(2)乙的水溶液可以用来做
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则丁的电子式为
Ⅱ.某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入AgNO3溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含
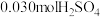 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
(1)该粉状锈中除了铜元素外还含有(写元素符号)
(2)写出该粉状锈溶于稀硫酸反应的离子方程式
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为
您最近一年使用:0次
10 . 下表为元素周期表的一部分。
回答下列问题:
(1)氮原子的电子排布式为_______________ ,Z元素在周期表中的位置为______________ 。
(2)上表中原子半径最大的元素是(写元素符号)_____________ ,该原子的核外最外层电子占有________ 个轨道。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是______ 。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1mol S单质得电子多
c.Y的气态氢化物比S的气态氢化物沸点高
(4)X与Z两元素的单质反应生成0.1mol X 的最高价化合物,恢复至室温,放热68.7kJ,已知该化合物的熔、沸点分别为−69℃和58℃,写出该反应的热化学方程式:_______________ 。
(5)简述碳的同素异形体中某种单质的用途,并从晶体类型角度分析原因__________________________ 。
| 氮 | Y | ||
| X | 硫 | Z |
(1)氮原子的电子排布式为
(2)上表中原子半径最大的元素是(写元素符号)
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1mol S单质得电子多
c.Y的气态氢化物比S的气态氢化物沸点高
(4)X与Z两元素的单质反应生成0.1mol X 的最高价化合物,恢复至室温,放热68.7kJ,已知该化合物的熔、沸点分别为−69℃和58℃,写出该反应的热化学方程式:
(5)简述碳的同素异形体中某种单质的用途,并从晶体类型角度分析原因
您最近一年使用:0次



