名校
解题方法
1 . 将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
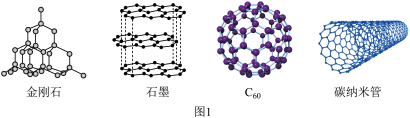
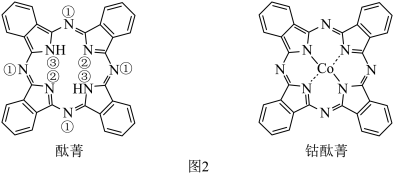
(1)如图1所示的几种碳单质,它们互为___________ ,其中属于原子晶体的是___________ ,C60间的作用力是___________ 。___________ (填图2酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为___________ ,氮原子提供孤对电子与钴离子形成___________ 键。___________ 。
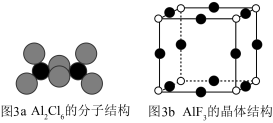
②AlF3的熔点为1090℃,远高于AlCl3的192℃,原因为___________ 。
③AlF3结构属立方晶系,晶胞如图3b所示,F-的配位数为___________ 。若晶胞参数为apm,晶体密度ρ=___________ g/cm3(列出计算式,阿伏加德罗常数的值为NA)。___________ ;钛原子和镍原子的半径分别为r1和r2,该晶体的空间利用率为___________ (用含r的代数式表示,不必化简﹐空间利用率= ×100%)。
×100%)。
(1)如图1所示的几种碳单质,它们互为
②AlF3的熔点为1090℃,远高于AlCl3的192℃,原因为
③AlF3结构属立方晶系,晶胞如图3b所示,F-的配位数为
 ×100%)。
×100%)。
您最近一年使用:0次
2 . 新型SiC增强铝基复合材料,可展开柔性砷化镓太阳能电池系统,助力“天问一号”开展火星探测。回答下列问题:
(1)基态Si原子中,电子占据的最高能级符号为_______ ,Ga的基态原子的价电子排布式是_______ 。
(2)第三周期元素中,第一电离能介于铝和磷之间的元素除硅外,还有_______ (填元素符号)
(3)碳化硅和硅晶体都具有金刚石型结构,碳化硅熔点高于硅的原因是_______ 。
(4)GaAs的晶胞如图所示。
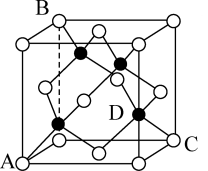
①GaAs的熔点为1238℃,该晶体的类型为_______ 。
②下列说法正确的是_______ (填字母)
A.砷化镓晶胞结构与NaCl相同 B.GaP与GaAs互为等电子体
C.电负性:As<Ga D.砷化镓晶体中含有配位键
(5)原子坐标参数表示晶胞内部各原子的相对位置。图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为_______ 。
(1)基态Si原子中,电子占据的最高能级符号为
(2)第三周期元素中,第一电离能介于铝和磷之间的元素除硅外,还有
(3)碳化硅和硅晶体都具有金刚石型结构,碳化硅熔点高于硅的原因是
(4)GaAs的晶胞如图所示。

①GaAs的熔点为1238℃,该晶体的类型为
②下列说法正确的是
A.砷化镓晶胞结构与NaCl相同 B.GaP与GaAs互为等电子体
C.电负性:As<Ga D.砷化镓晶体中含有配位键
(5)原子坐标参数表示晶胞内部各原子的相对位置。图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为

您最近一年使用:0次
3 . 如图为几种晶体或晶胞的结构示意图。
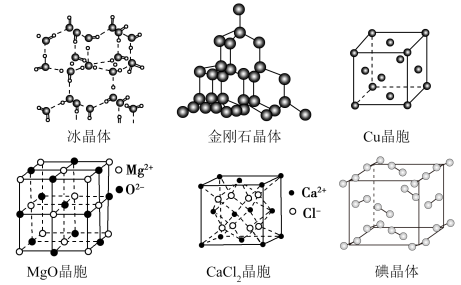
请回答下列问题:
(1)金刚石属于___________ 晶体,其中每个碳原子与___________ 个碳原子距离最近且相等;
(2)碘晶体属于___________ 晶体,每个碘晶胞中实际占有___________ 个碘分子。
(3)冰、金刚石、碘单质三种晶体的熔点由高到低的顺序为___________ 。
(4)假设碘晶胞中立方体的边长为acm,阿伏加德罗常数的值为 ,则碘晶体的密度为
,则碘晶体的密度为___________  。
。

请回答下列问题:
(1)金刚石属于
(2)碘晶体属于
(3)冰、金刚石、碘单质三种晶体的熔点由高到低的顺序为
(4)假设碘晶胞中立方体的边长为acm,阿伏加德罗常数的值为
 ,则碘晶体的密度为
,则碘晶体的密度为 。
。
您最近一年使用:0次
4 . A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如表①所示,只有E元素的单质能与水反应生成两种酸,甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素:W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
表①
请回答下列问题:
(1)Z的化学式为___________ ;X分子的空间构型为___________ 。
(2)E的单质与水反应的离子方程式为___________ 。 D、E元素可分别与硅(Si)、钛(Ti)元素形成化合物,其中SiD2的熔点为1723℃,沸点2230℃,TiE4的熔点为-24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是___________ 。
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为___________ 。
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为___________ ,该温度下的平衡常数为___________ 。
表①
| B | D | |
| E |

请回答下列问题:
(1)Z的化学式为
(2)E的单质与水反应的离子方程式为
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为
您最近一年使用:0次
解题方法
5 . 短周期元素X、Y、Z、W中,X元素的原子最外层电子排布为ns1,Y元素的原子价电子排布为ns2np2,Z元素的最外层电子数是其电子层数的3倍,W元素原子的M电子层的p能级中有3个未成对电子。
(1)Z原子的电子排布式为___________ ,若X为非金属元素,则按原子轨道的重叠方式,X与Z形成的化合物中的共价键属于___________ 键(填“σ”或“π”)。
(2)当n=2时,Y在元素周期表的位置为___________ ,YZ2属于___________ 分子(填“极性”或“非极性”)。
(3)当n=3时,YZ2晶体属于___________ 晶体;YZ2晶体中Y原子与Y-Z键的数目之比为___________ 。
(4)若X元素的原子最外层电子排布为2s1,Y元素的原子价电子排布为3s23p2,X、Y、Z、W四种元素的第一电离能由大到小的顺序是___________ (用元素符号表示)。
(1)Z原子的电子排布式为
(2)当n=2时,Y在元素周期表的位置为
(3)当n=3时,YZ2晶体属于
(4)若X元素的原子最外层电子排布为2s1,Y元素的原子价电子排布为3s23p2,X、Y、Z、W四种元素的第一电离能由大到小的顺序是
您最近一年使用:0次
名校
解题方法
6 . 硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出R原子核外能量最高的电子的电子排布式:___________ 。
②常温下,不能与R单质发生反应的是___________ (选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高,不溶于水。可由下列反应制得:SiO2+C+N2 Si3N4+CO
Si3N4+CO
①C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:___________ 。
②配平上述反应的化学方程式:___________ 。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:
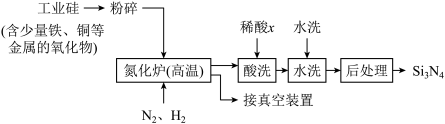
适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。x可能是___________ (选填:“盐酸”“硝酸”或“硫酸”),理由是___________ 。
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出R原子核外能量最高的电子的电子排布式:
②常温下,不能与R单质发生反应的是
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高,不溶于水。可由下列反应制得:SiO2+C+N2
 Si3N4+CO
Si3N4+CO①C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:
②配平上述反应的化学方程式:
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:

适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。x可能是
您最近一年使用:0次
7 . 下列为几种晶体或晶胞的示意图:


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成晶体的是_______ 。
(2)冰、金刚石、干冰3种晶体的熔点由高到低的顺序为_______ 。晶体硅的结构与金刚石非常相似。金刚石、晶体硅和金刚砂(碳化硅)的熔点由高到低的顺序为_______ (填化学式)。
(3)每个Cu晶胞中实际占有_______ 个 Cu原子,1 mol金刚石中含有C-C单键的数目约是_______ NA。
(4)观察干冰晶胞结构,每个CO2分子周围有_______ 个与之紧邻且等距的CO2分子;金刚石晶体中,碳原子的杂化类型为_______ 。
(5)若干冰分子的摩尔质量为M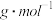 ,晶体的密度为
,晶体的密度为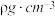 ,阿伏加德罗常数为
,阿伏加德罗常数为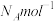 ,则该晶体晶胞的边长为
,则该晶体晶胞的边长为_______ cm。


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成晶体的是
(2)冰、金刚石、干冰3种晶体的熔点由高到低的顺序为
(3)每个Cu晶胞中实际占有
(4)观察干冰晶胞结构,每个CO2分子周围有
(5)若干冰分子的摩尔质量为M
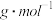 ,晶体的密度为
,晶体的密度为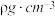 ,阿伏加德罗常数为
,阿伏加德罗常数为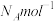 ,则该晶体晶胞的边长为
,则该晶体晶胞的边长为
您最近一年使用:0次
8 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
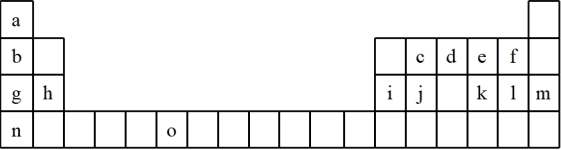
(1)请写出元素“o”的基态原子的价电子排布式_______ 。
(2)k在空气中燃烧产物的分子构型为_______ ,中心原子的杂化形式为_______ ,该分子是_______ (填“极性”或“非极性”)分子。
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是(写化学式)_______ ,试从结构角度加以解释_______ 。
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为_______ 。
②该晶体的密度为_______ g/cm3。

(1)请写出元素“o”的基态原子的价电子排布式
(2)k在空气中燃烧产物的分子构型为
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是(写化学式)
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为
②该晶体的密度为
您最近一年使用:0次
名校
9 . 回答下列问题:
(1)SiC晶体结构同金刚石相似,SiC晶体熔点_______ (填“高于”或“低于”)金刚石熔点,SiC晶体中最小环上有_______ 个C原子。
(2)PCl3分子的空间构型为_______ ,其中心原子的杂化方式为_______ 。
(3)用一种试剂鉴别苯酚溶液、乙醛溶液、己烷、己烯四种无色液体,该试剂为_______ (填名称)。
(4)短周期元素X、Y、Z原子序数依次增大。X是周期表中原子半径最小的元素。Y原子核外电子有六种不同的运动状态。Z基态原子核外L层有2个未成对的电子,则由X、Y、Z能组成的化合物可能为_______。
(5) 的结构如图:
的结构如图:

① 中S—O—O
中S—O—O_______ (填“是”或“不是”)在一条直线上。
② 中的O—O比H2O2中的更
中的O—O比H2O2中的更_______ (填“难”或“易”)断裂。
(1)SiC晶体结构同金刚石相似,SiC晶体熔点
(2)PCl3分子的空间构型为
(3)用一种试剂鉴别苯酚溶液、乙醛溶液、己烷、己烯四种无色液体,该试剂为
(4)短周期元素X、Y、Z原子序数依次增大。X是周期表中原子半径最小的元素。Y原子核外电子有六种不同的运动状态。Z基态原子核外L层有2个未成对的电子,则由X、Y、Z能组成的化合物可能为_______。
| A.X2YZ | B.X2YZ4 | C.X2Y2Z4 | D.XYZ3 |
 的结构如图:
的结构如图:
①
 中S—O—O
中S—O—O②
 中的O—O比H2O2中的更
中的O—O比H2O2中的更
您最近一年使用:0次
10 . 硅烷 可用于制造高纯硅。采用硅化镁法制备
可用于制造高纯硅。采用硅化镁法制备 的化学方程式:
的化学方程式:
(1)硅在元素周期表中的位置是_______ ,硅原子电子排布式为_______ 。
(2)① 的电子式是
的电子式是_______ 。
② 的沸点比
的沸点比 的
的_______ (填“高”或“低”),原因是_______ 。
(3)晶体 属于
属于_______ 晶体(填晶体类型),一种 晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是_______ 。

(4)硅化镁晶体的晶胞示意图如下,则其化学式为_______ 。已知该晶胞边长为acm,阿伏加德罗常数的值为NA,摩尔质量为M,则该晶体的密度为_______ g/cm3。

 可用于制造高纯硅。采用硅化镁法制备
可用于制造高纯硅。采用硅化镁法制备 的化学方程式:
的化学方程式:
(1)硅在元素周期表中的位置是
(2)①
 的电子式是
的电子式是②
 的沸点比
的沸点比 的
的(3)晶体
 属于
属于 晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
(4)硅化镁晶体的晶胞示意图如下,则其化学式为

您最近一年使用:0次



