名校
解题方法
1 . 自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
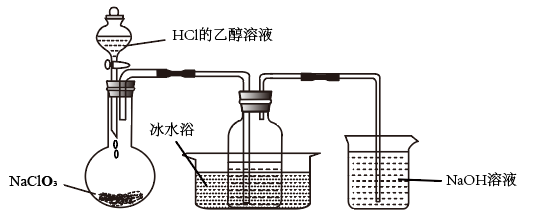
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaCIO3和HCl的乙醇溶液为原料制备ClO2的反应为:2NaCIO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O冰水浴的作用是__________________________________ 。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到____ ,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-),需将其转化为Cl-除去。下列试剂中,可将ClO2-转化为Cl-的是________ (填字母序号)。
a.FeSO4 b. O3 c.KMnO4 d.SO2
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭性能为一体。实验室制备K2FeO4方法如下:在冰水浴中,向 KClO和 KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①上述制备K2FeO4反应的离子方程式为______________________________ 。
②若用24.2g硝酸铁,制得K2FeO418.8g,则产率为_________ (保留1位小数)
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。

资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaCIO3和HCl的乙醇溶液为原料制备ClO2的反应为:2NaCIO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O冰水浴的作用是
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-),需将其转化为Cl-除去。下列试剂中,可将ClO2-转化为Cl-的是
a.FeSO4 b. O3 c.KMnO4 d.SO2
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭性能为一体。实验室制备K2FeO4方法如下:在冰水浴中,向 KClO和 KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①上述制备K2FeO4反应的离子方程式为
②若用24.2g硝酸铁,制得K2FeO418.8g,则产率为
您最近一年使用:0次
名校
2 . 下列实验能达到预期目的的是
A. 蒸发溴水获取溴单质 蒸发溴水获取溴单质 |
B. 证明碳酸酸性强于硅酸 证明碳酸酸性强于硅酸 |
C. 比较NaHCO3和Na2CO3的热稳定性 比较NaHCO3和Na2CO3的热稳定性 |
D. 除去氯气中的HCl杂质 除去氯气中的HCl杂质 |
您最近一年使用:0次
2019-07-09更新
|
382次组卷
|
5卷引用:河南省驻马店市第二高级中学2019-2020学年高二下学期期末考试化学试题
名校
3 . 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____ 与盐酸反应最剧烈;____ 与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____ 。
(3)用电子式表示次氯酸形成过程______ 。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
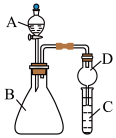
(1)仪器D的名称为_____ ,其作用为___ 。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液____ (填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,用离子方程式表示该尾气吸收原理______ 。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_____ (填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有____ 的洗气瓶。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
(3)用电子式表示次氯酸形成过程
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器D的名称为
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液
您最近一年使用:0次
名校
4 . 实验是研究化学的基础。化学实验的基本操作、气体的制备、离子的检验、物质性质的探究等内容是化学实验中的重要内容。请回答下列问题:
(1)下列实验操作的装置正确的是____ (填标号)。指出不正确装置中的一处错误____ 。

A B C D
(2)实验室常用浓盐酸制取Cl2,制取时,需要加入具有___________ 性的物质(填:氧化性、还原性、酸性、碱性)。若制取氯气反应为6HCl(浓)+KClO3=3Cl2↑+KCl+3H2O,该反应中的还原产物为____ ;还原产物与氧化产物的物质的量之比为_____ 。
(3)氯气溶于水可制得氯水,氯水的成分比较复杂。
①取新制的氯水加入硝酸酸化的AgNO3溶液出现白色沉淀,证明有Cl-存在,反应的离子方程式为________ 。
②取新制的氯水加入试剂______ ,现象为___________ ,证明溶液中含有H+;
③取新制的氯水,加入几滴紫色的石蕊试液,溶液先变红后褪色,原因是______ 。
(1)下列实验操作的装置正确的是

A B C D
(2)实验室常用浓盐酸制取Cl2,制取时,需要加入具有
(3)氯气溶于水可制得氯水,氯水的成分比较复杂。
①取新制的氯水加入硝酸酸化的AgNO3溶液出现白色沉淀,证明有Cl-存在,反应的离子方程式为
②取新制的氯水加入试剂
③取新制的氯水,加入几滴紫色的石蕊试液,溶液先变红后褪色,原因是
您最近一年使用:0次
2017-11-29更新
|
147次组卷
|
2卷引用:河南省漯河市临颍县南街高级中学2020-2021学年高一10月质量检测化学试题
解题方法
5 . 以铬铁合金(含少量Co、Ni、C等元素)为原料制备Cr2O3并获得副产品FeC2O4·2H2O的工艺流程如下:
(1)工业上酸溶时通常用硫酸而不用盐酸的原因是_________
(2)已知滤渣2的主要成分是CoS 和NiS,则滤渣l的主要成分是_________ (填化学式)。
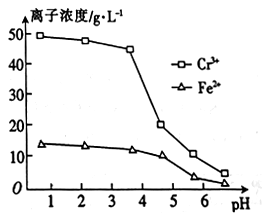
(3)在加入Na2S 除杂前需将溶液pH 调到4左右,Cr3+、Fe2+浓度与溶液pH之间的关系如图,分析pH调至4 左右的原因:pH过小,加入Na2S 后会产生H2S并逸出;___________ 。
(4)Fe3+易与C2O42-形成配合物的滤液中。检验过滤2的滤液是否存在Fe3+的试剂为_______ .
(5) FeC2O4·2H2O 与LiH2PO4混合煅烧,可制得锂电池的电极材料LiFePO4,其他产物以气体形式放出。该反应的化学方程式为____________ 。
(6)已知Cr(OH)3是两性氢氧化物,若沉铬时pH 过大,则Cr(OH)3会转化为CrO2-,该反应的离子方程式为________ ;证明Cr(OH)3沉淀洗涤干净的方法是________ 。
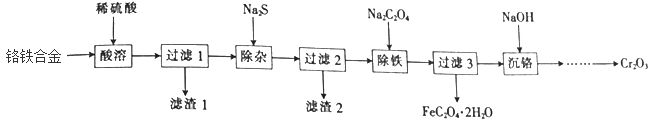
(1)工业上酸溶时通常用硫酸而不用盐酸的原因是
(2)已知滤渣2的主要成分是CoS 和NiS,则滤渣l的主要成分是
(3)在加入Na2S 除杂前需将溶液pH 调到4左右,Cr3+、Fe2+浓度与溶液pH之间的关系如图,分析pH调至4 左右的原因:pH过小,加入Na2S 后会产生H2S并逸出;
(4)Fe3+易与C2O42-形成配合物的滤液中。检验过滤2的滤液是否存在Fe3+的试剂为
(5) FeC2O4·2H2O 与LiH2PO4混合煅烧,可制得锂电池的电极材料LiFePO4,其他产物以气体形式放出。该反应的化学方程式为
(6)已知Cr(OH)3是两性氢氧化物,若沉铬时pH 过大,则Cr(OH)3会转化为CrO2-,该反应的离子方程式为
您最近一年使用:0次
6 . 下列实验过程中的现象及结论均正确的是
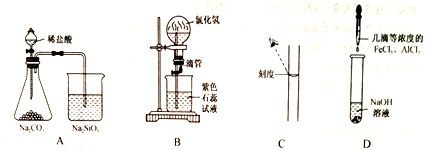

| A.锥形瓶中有气体产生,烧杯中液体变浑浊,证明非金属性:Cl>C>Si |
| B.形成美丽的红色喷泉,证明HCl极易溶于水 |
| C.配制一定物质的量浓度的NaOH溶液时,定容时如图观察使配制的NaOH 溶液浓度偏低 |
| D.只产生红褐色沉定,证明Ksp[Al(OH3)]>Ksp[Fe(OH)3] |
您最近一年使用:0次
名校
7 . 如图实验装置进行的相应实验,不能达到实验目的的是
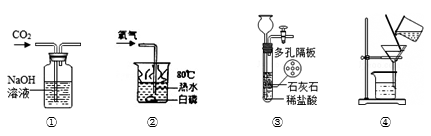

| A.用①所示装置除去 CO2 中含有的少量 HCl 气体 |
| B.用②所示的装置证明可燃物燃烧需要与氧气接触 |
| C.用③所示装置制取少量 CO2 气体 |
| D.在实验室中,用④所示装置除去少量池水中的泥沙 |
您最近一年使用:0次
2017-08-25更新
|
288次组卷
|
2卷引用:河南省漯河市临颍县南街高级中学2020-2021学年高一10月质量检测化学试题
8 . 某研究性学习小组的同学通过查阅资料得到如下信息:草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,受热脱水、升华,易溶于水,170℃以上分解可得到CO、CO2、H2O,H2C2O4难溶于水。他们欲利用如下装置验证上述产物(加热仪器、夹持仪器省略)。
(1)加热草酸晶体使其分解的装置是________ (从I、II、III中选取),验证其分解产物的装置依次是______ →A→尾气处理装置(用装置字母作答,装置可重复使用)。
(2)D中试剂是_________ ,证明有CO生成的现象是_______ 。
(3)实验中有两处需要加热,加热的顺序是_________ ,写出一种处理尾气的方法:_____________ 。
(4)若上述实验均产生了预期的现象,写出草酸分解的化学方程式:_________________ 。
(5)设计一种方案证明草酸是弱酸_________ 。
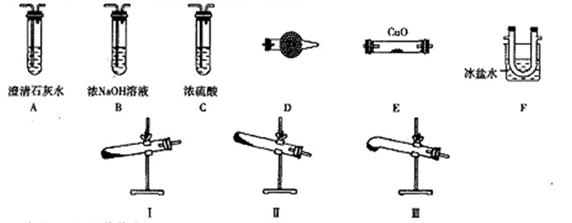
(1)加热草酸晶体使其分解的装置是
(2)D中试剂是
(3)实验中有两处需要加热,加热的顺序是
(4)若上述实验均产生了预期的现象,写出草酸分解的化学方程式:
(5)设计一种方案证明草酸是弱酸
您最近一年使用:0次
14-15高三上·黑龙江·期中
名校
9 . 下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是


| A.甲装置:可用来证明硫的非金属性比硅强 |
| B.乙装置:橡皮管的作用是能使水顺利流下 |
| C.丙装置:用图示的方法能检查此装置的气密性 |
| D.丁装置:可在瓶中先装入某种液体收集NO气体 |
您最近一年使用:0次
2016-12-09更新
|
327次组卷
|
13卷引用:2016届河南省洛阳市高三上学期期中考试化学试卷
2016届河南省洛阳市高三上学期期中考试化学试卷(已下线)2015届黑龙江省哈六中高三上学期期中考试化学试卷(已下线)2015届黑龙江省哈尔滨六中高三上学期期中化学试卷2016届福建省师大附中高三上学期期中考试化学试卷2016-2017学年广东省清远三中高二上学期第一次月考化学试卷2017届新疆生产建设兵团二中高三上第二次月考化学卷2017届福建省漳州市八校高三2月联考化学试卷2016-2017学年江西省宜春中学高一3月月考化学试卷陕西省榆林市2018届高三第三次模拟测试理综化学试题河北省石家庄第二中学2019届高三上学期9月月考化学试题天津市新华中学2019届高三下学期第八次模拟考试理科综合化学试题天津市和平区2022-2023学年高三上学期期末考试化学试题天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题
10 . 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
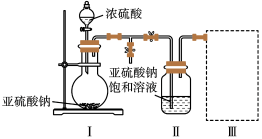
(1)装置I中产生气体的化学方程式为__________________ 。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________ 。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________ (填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________ 。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____ (填“偏高”“偏低”或“不变”)。
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
②在上述实验过程中,若有部分HI被空气氧化,则测得结果
您最近一年使用:0次
2016-12-09更新
|
3379次组卷
|
10卷引用:河南省林州市第一中学2018届高三8月调研考试化学试题
河南省林州市第一中学2018届高三8月调研考试化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷)2016届陕西西安第一中学高三上学期期中考试化学试卷辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题四川省遂宁市2018届高三第一次诊断考试理综化学试题【全国百强校】云南省玉溪市第一中学2018-2019学年高二上学期第二次月考化学试题山西省太原市六十六中2020届高三上学期第二次月考化学试题上海市六校联考2016届高考模拟试卷(3月份)化学试题(已下线)上海市格致中学2015届高三上学期摸底考试化学试题安徽省合肥一中2020-2021学年高一上学期第一次段考化学试题



