1 . 电解质在人体内的作用是十分重要的,当电解质紊乱时人体就会出现一系列不适症状,甚至危及生命。 固体④漂白粉粉末 ⑤熔融的
固体④漂白粉粉末 ⑤熔融的 ⑥
⑥ 溶液
溶液
(1)上述物质中,属于电解质的是___________ (填序号,下同),能导电的是___________ 。
(2)16.8g由 和
和 组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。
组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。
(3)将①投入⑥的溶液中产生气泡,写出离子方程式___________ 。
Ⅱ.完成下列问题
(4)配制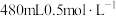 的
的 溶液。
溶液。
①配制时,用托盘天平称取 固体的质量为
固体的质量为___________ g
②其操作步骤如下图所示:___________ (填序号)操作之间。___________ (填字母序号)。
a.定容时俯视刻度线
b.溶解时,烧杯中有少量蒸馏水
c.加水时不慎超过了刻度线,立即用胶头滴管吸出
(5)从配制好的 溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中
溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中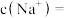
___________  。
。
 固体④漂白粉粉末 ⑤熔融的
固体④漂白粉粉末 ⑤熔融的 ⑥
⑥ 溶液
溶液(1)上述物质中,属于电解质的是
(2)16.8g由
 和
和 组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。
组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。| A.8g | B.15.5g | C.11.7g | D.23.4g |
(3)将①投入⑥的溶液中产生气泡,写出离子方程式
Ⅱ.完成下列问题
(4)配制
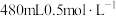 的
的 溶液。
溶液。①配制时,用托盘天平称取
 固体的质量为
固体的质量为②其操作步骤如下图所示:
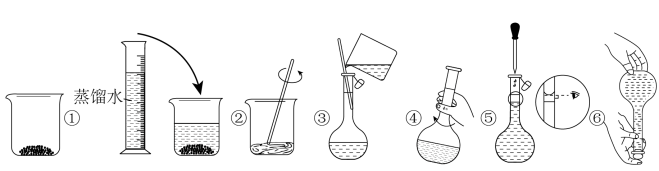
a.定容时俯视刻度线
b.溶解时,烧杯中有少量蒸馏水
c.加水时不慎超过了刻度线,立即用胶头滴管吸出
(5)从配制好的
 溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中
溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中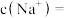
 。
。
您最近一年使用:0次
2023-12-24更新
|
77次组卷
|
2卷引用:江苏省“江南十校”2023-2024学年高一上学期分科诊断摸底联考化学试卷
解题方法
2 . Ⅰ.漂白液是一种常用的消毒剂,通常可将 通入
通入 溶液中制取,某化学兴趣小组想用下列装置制备漂白液并探究漂白液的化学性质。
溶液中制取,某化学兴趣小组想用下列装置制备漂白液并探究漂白液的化学性质。

(1)写出制取漂白液的化学反应方程式___________ ,为完成该制备实验请将上述装置的接口按照合理的顺序连接:___________ 。
(2)为了探究漂白液的性质,各取少量制备的漂白液于3支试管中,进行下列实验(已知淀粉遇碘变蓝),根据要求完善表格。
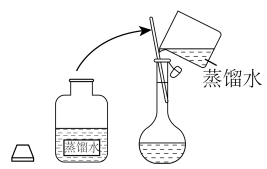
Ⅱ.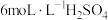 溶液的配制
溶液的配制
若实验室没有配制好的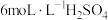 溶液,需要利用图片中的信息自行配制
溶液,需要利用图片中的信息自行配制
(3)该浓硫酸的物质的量浓度为___________ 。
(4)若本实验需要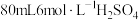 溶液溶液,配制步骤为:
溶液溶液,配制步骤为:
a:将容量瓶塞紧,充分摇匀;
b:待烧杯中的溶液冷却到室温后,转入___________;
c:用量筒量取___________mL浓硫酸慢慢注入盛有少量水的烧杯中,进行稀释;
d:用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都转入容量瓶,并轻轻摇匀。
e:继续加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线相切;回答下列问题:
①步骤c中用量筒量取___________ mL浓硫酸。
②实验步骤中使用的仪器b为___________ 。
③本实验正确的操作顺序为___________ (填序号)。
④下列操作会导致所配溶液浓度偏高的是___________ (填字母)。
a.定容时俯视刻度线
b.将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
c.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
d.转移洗涤液时洒到容量瓶外,继续用未清洗的该容量瓶重新配制
 通入
通入 溶液中制取,某化学兴趣小组想用下列装置制备漂白液并探究漂白液的化学性质。
溶液中制取,某化学兴趣小组想用下列装置制备漂白液并探究漂白液的化学性质。
(1)写出制取漂白液的化学反应方程式
(2)为了探究漂白液的性质,各取少量制备的漂白液于3支试管中,进行下列实验(已知淀粉遇碘变蓝),根据要求完善表格。
| 实验操作 | 试剂X | 实验现象 | 推论 |
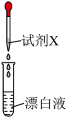 | 紫色石蕊试液 | 先变蓝,后褪色 | ①后褪色说明漂白液具有 |
| 含淀粉的碘化钾溶液 | ② | ③漂白液具有 | |
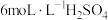 溶液 溶液 | 产生黄绿色气体 | ④溶液中发生反应的离子方程式为 |
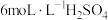 溶液的配制
溶液的配制若实验室没有配制好的
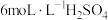 溶液,需要利用图片中的信息自行配制
溶液,需要利用图片中的信息自行配制浓H2SO4 相对分子质量:98 密度:1.84g/mL 质量分数:98% |
(4)若本实验需要
 溶液溶液,配制步骤为:
溶液溶液,配制步骤为:a:将容量瓶塞紧,充分摇匀;
b:待烧杯中的溶液冷却到室温后,转入___________;
c:用量筒量取___________mL浓硫酸慢慢注入盛有少量水的烧杯中,进行稀释;
d:用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都转入容量瓶,并轻轻摇匀。
e:继续加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线相切;回答下列问题:
①步骤c中用量筒量取
②实验步骤中使用的仪器b为
③本实验正确的操作顺序为
④下列操作会导致所配溶液浓度偏高的是
a.定容时俯视刻度线
b.将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
c.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
d.转移洗涤液时洒到容量瓶外,继续用未清洗的该容量瓶重新配制
您最近一年使用:0次
名校
3 . 某种胃药的有效成分为碳酸氢钠,测定其中碳酸氢钠含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应),该测定实验共进行了四次:
①配制250mL 盐酸和100mL
盐酸和100mL 的NaOH溶液
的NaOH溶液
②向一粒研碎后的药片中加入20.00mL蒸馏水
③用 的NaOH溶液中和过量的盐酸,记录所消耗NaOH溶液的体积
的NaOH溶液中和过量的盐酸,记录所消耗NaOH溶液的体积
④加入 的HCl盐酸
的HCl盐酸
请回答下列问题:
(1)正确的操作顺序是___________ (填序号)。
(2)如图为实验室某浓盐酸试剂瓶上的标签的有关内容

①该浓盐酸中溶质的物质的量浓度为___________  。
。
②用该浓盐酸配制本实验所需的盐酸,需要的仪器有烧杯、玻璃棒、量筒、________ 。
③下列实验操作对所配制的盐酸的物质的量浓度有何影响?(填“偏大一偏小”或“无影响”)
A.容量瓶在使用前未干燥,里面有少量蒸馏水:___________ ;
B.定容时俯视刻度线:___________ 。
(3)某同学4次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,计算这种药片中碳酸氢钠的质量为___________ 。(小数点后保留2位)
①配制250mL
 盐酸和100mL
盐酸和100mL 的NaOH溶液
的NaOH溶液②向一粒研碎后的药片中加入20.00mL蒸馏水
③用
 的NaOH溶液中和过量的盐酸,记录所消耗NaOH溶液的体积
的NaOH溶液中和过量的盐酸,记录所消耗NaOH溶液的体积④加入
 的HCl盐酸
的HCl盐酸请回答下列问题:
(1)正确的操作顺序是
(2)如图为实验室某浓盐酸试剂瓶上的标签的有关内容

①该浓盐酸中溶质的物质的量浓度为
 。
。②用该浓盐酸配制本实验所需的盐酸,需要的仪器有烧杯、玻璃棒、量筒、
③下列实验操作对所配制的盐酸的物质的量浓度有何影响?(填“偏大一偏小”或“无影响”)
A.容量瓶在使用前未干燥,里面有少量蒸馏水:
B.定容时俯视刻度线:
(3)某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 19.00 | 19.10 | 18.90 | 17.00 |
您最近一年使用:0次
4 . 漂白粉消毒是利用漂白粉的氧化作用对饮用水和废水进行杀菌的水处理过程。
(1)某品牌的漂白粉中,其有效成分的含量约为43%,写出工业上制漂白粉的化学反应方程式_________ 。
(2)某同学欲将该漂白粉配成450 含有ClO- 0.1
含有ClO- 0.1 的溶液。回答:
的溶液。回答:
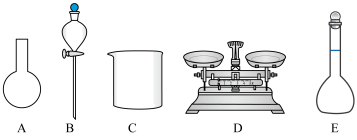
①写出在配制过程中,上图所示的仪器,用不到的仪器名称______________ 。
②配制过程中,需称量该漂白粉的质量为____________ g
③该同学配制溶液后,发现溶液底部中有少量不溶物。请用化学方程式写出形成其不溶物的原因__________ 。
(3)“84消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用98%(密度为1.84 )的浓硫酸配制500
)的浓硫酸配制500 2.3
2.3 的稀硫酸用于增强“84消毒液”的消毒能力。
的稀硫酸用于增强“84消毒液”的消毒能力。
①需用浓硫酸的体积为___________  。
。
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是__________ 。
A.溶液中 的物质的量 B.溶液的浓度
的物质的量 B.溶液的浓度
C.溶液的质量 D.溶液的密度
③在浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3 有
有__________ 。
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.定容时俯视观察液面
D.量取浓硫酸时俯视凹液面
(1)某品牌的漂白粉中,其有效成分的含量约为43%,写出工业上制漂白粉的化学反应方程式
(2)某同学欲将该漂白粉配成450
 含有ClO- 0.1
含有ClO- 0.1 的溶液。回答:
的溶液。回答:
①写出在配制过程中,上图所示的仪器,用不到的仪器名称
②配制过程中,需称量该漂白粉的质量为
③该同学配制溶液后,发现溶液底部中有少量不溶物。请用化学方程式写出形成其不溶物的原因
(3)“84消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用98%(密度为1.84
 )的浓硫酸配制500
)的浓硫酸配制500 2.3
2.3 的稀硫酸用于增强“84消毒液”的消毒能力。
的稀硫酸用于增强“84消毒液”的消毒能力。①需用浓硫酸的体积为
 。
。②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是
A.溶液中
 的物质的量 B.溶液的浓度
的物质的量 B.溶液的浓度C.溶液的质量 D.溶液的密度
③在浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3
 有
有A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.定容时俯视观察液面
D.量取浓硫酸时俯视凹液面
您最近一年使用:0次
21-22高一·全国·课后作业
名校
5 . 如图为实验室某浓盐酸试剂瓶标签上的部分数据,试根据标签.上的相关数据回答下列问题:.
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:______ ;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:______ 。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取______ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是______ 。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:  HCl的质量分数:36.5% |
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
2024-02-22更新
|
74次组卷
|
6卷引用:第一章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
(已下线)第一章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)河北省隆化存瑞中学2022-2023学年高一上学期第一次月考化学试题山东省威海市文登新一中2021-2022学年高一上学期12月月考化学试题河南省濮阳市第一高级中学2022-2023学年高一上学期期中质量检测化学试题黑龙江省齐齐哈尔市普高联谊校2022-2023学年高三上学期期中考试化学试题河南省周口市鹿邑县2023-2024学年高一上学期1月期末化学试题
名校
解题方法
6 . 某同学欲用密度为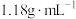 ,质量分数为36.5%的浓盐酸配制
,质量分数为36.5%的浓盐酸配制
 稀盐酸,请你帮助他完成这一任务。
稀盐酸,请你帮助他完成这一任务。
(1)该浓盐酸的物质的量浓度为_______  ;应量取的浓盐酸体积
;应量取的浓盐酸体积_______  。(保留2位有效数字)
。(保留2位有效数字)
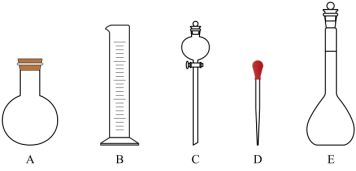
(2)应选用的容量瓶的规格_______  ;如图所示的仪器不需的仪器有
;如图所示的仪器不需的仪器有_______ (选填上方对应字母)。
(3)在配制稀盐酸溶液时,有如下操作:
A.用 蒸馏水洗涤玻璃仪器各2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
蒸馏水洗涤玻璃仪器各2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
B.用量筒准确量取所需体积的浓盐酸注入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其混合均匀
C.将已恢复至室温的盐酸移液操作注入所选用的容量瓶中
D.盖好瓶塞,反复上下颠倒摇匀
E.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶瓶颈上的刻度线相切
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线 处;
处;
正确的操作顺序是_______ (用字母符号表示,每个符号只能用一次)。
(4)下列操作可能使所配溶液浓度偏高的是_______ (填字母)。
①没有进行操作A;
②定容时俯视容量瓶瓶颈上的刻度线;
③加蒸馏水时不慎超过容量瓶瓶颈上的刻度线;
④容量瓶用蒸馏水洗净后,没烘干直接使用
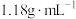 ,质量分数为36.5%的浓盐酸配制
,质量分数为36.5%的浓盐酸配制
 稀盐酸,请你帮助他完成这一任务。
稀盐酸,请你帮助他完成这一任务。
(1)该浓盐酸的物质的量浓度为
 ;应量取的浓盐酸体积
;应量取的浓盐酸体积 。(保留2位有效数字)
。(保留2位有效数字)(2)应选用的容量瓶的规格
 ;如图所示的仪器不需的仪器有
;如图所示的仪器不需的仪器有(3)在配制稀盐酸溶液时,有如下操作:
A.用
 蒸馏水洗涤玻璃仪器各2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
蒸馏水洗涤玻璃仪器各2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶B.用量筒准确量取所需体积的浓盐酸注入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其混合均匀
C.将已恢复至室温的盐酸移液操作注入所选用的容量瓶中
D.盖好瓶塞,反复上下颠倒摇匀
E.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶瓶颈上的刻度线相切
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线
 处;
处;正确的操作顺序是
(4)下列操作可能使所配溶液浓度偏高的是
①没有进行操作A;
②定容时俯视容量瓶瓶颈上的刻度线;
③加蒸馏水时不慎超过容量瓶瓶颈上的刻度线;
④容量瓶用蒸馏水洗净后,没烘干直接使用
您最近一年使用:0次
解题方法
7 . 某实验小组用0.50 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。
(一)配制0.50 NaOH溶液。
NaOH溶液。
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体_______ g。
(2)从下图中选择称量NaOH固体所需要的仪器_______ (填字母)。
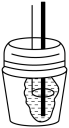
(二)测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示。
(3)写出该反应的热化学方程式(中和热 ):
):_______ 。
(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写表中的空白:
②近似认为0.50 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液的密度都是1
硫酸溶液的密度都是1 ,中和后生成溶液的比热容
,中和后生成溶液的比热容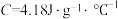 。则测得中和热
。则测得中和热 =
=_______  (取小数点后一位)。
(取小数点后一位)。
③上述实验数值结果与57.3 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是_______ (填字母)。
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
C.用温度计测定NaOH溶液起始温度后直接测定 溶液的温度
溶液的温度
 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。(一)配制0.50
 NaOH溶液。
NaOH溶液。(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体
(2)从下图中选择称量NaOH固体所需要的仪器
| 序号 | a | b | c | d | e | f |
| 仪器 |  |  |  |  |  |  |
(二)测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示。

(3)写出该反应的热化学方程式(中和热
 ):
):(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写表中的空白:
| 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温度差平均值 (  - - )/℃ )/℃ | ||
 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液的密度都是1
硫酸溶液的密度都是1 ,中和后生成溶液的比热容
,中和后生成溶液的比热容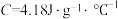 。则测得中和热
。则测得中和热 =
= (取小数点后一位)。
(取小数点后一位)。③上述实验数值结果与57.3
 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
C.用温度计测定NaOH溶液起始温度后直接测定
 溶液的温度
溶液的温度
您最近一年使用:0次
2022-12-31更新
|
211次组卷
|
3卷引用:河南省鹤壁市第一中学2022-2023学年高二上学期期末检测化学试题
8 . 某同学用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾FeSO4·7H2O,设计了如下流程(部分物质已略去,加入的试剂均过量):回答下列问题:
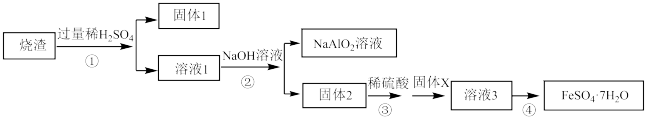
(1)固体1的主要成分为___________ (填化学式,下同),固体X为_____________ 。
(2)写出步骤②中生成固体2和NaAlO2溶液的离子方程式为_____________ 、__________
(3)某学生的过滤操作中,其操作不规范的是__________ (填标号)。
a.玻璃棒用作引流
b.滤纸边缘高出漏斗
c.漏斗末端颈尖未紧靠烧杯壁
d.将滤纸湿润,使其紧贴漏斗壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(4)步骤①中用到的稀硫酸浓度为2mol/L,体积为1L,此稀硫酸是由18.0 mol/L的浓硫酸稀释得到,该用量筒量取__________ ml 18.0 mol/L的浓硫酸。下列操作使所配稀硫酸浓度偏大的有________ (填写字母)。
A、在烧杯中稀释浓硫酸后,未冷却就立即转移到容量瓶中
B、往容量瓶转移时,有少量液体溅出;
C、定容时俯视刻度线;
D、容量瓶未干燥即用来配制溶液;
E、定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。

(1)固体1的主要成分为
(2)写出步骤②中生成固体2和NaAlO2溶液的离子方程式为
(3)某学生的过滤操作中,其操作不规范的是
a.玻璃棒用作引流
b.滤纸边缘高出漏斗
c.漏斗末端颈尖未紧靠烧杯壁
d.将滤纸湿润,使其紧贴漏斗壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(4)步骤①中用到的稀硫酸浓度为2mol/L,体积为1L,此稀硫酸是由18.0 mol/L的浓硫酸稀释得到,该用量筒量取
A、在烧杯中稀释浓硫酸后,未冷却就立即转移到容量瓶中
B、往容量瓶转移时,有少量液体溅出;
C、定容时俯视刻度线;
D、容量瓶未干燥即用来配制溶液;
E、定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
您最近一年使用:0次
解题方法
9 . 实验室配制500mL 0.1 mol/L Na2CO3溶液,实验操作步骤如下:
①用电子天平称出相应质量的Na2CO3固体。把它放入烧杯中,加入适量的蒸馏水,使它完全溶解。
②把制得的溶液,小心地注入___________中。
③继续向容量瓶中加蒸馏水至液面距离刻度1-2cm处,改用________小心滴加蒸馏水至液面凹液面最低处与刻度线相切。
④用少量蒸馏水洗涤玻璃棒和烧杯2-3次,每次洗涤的液体都要小心的转入容量瓶中。
⑤将瓶塞塞紧,充分摇匀。
(1)请填写②和③处仪器名称___________ 、___________ 。
(2)需要称取碳酸钠固体______________ 。
(3)操作步骤正确的顺序为______________ (填写序号)。
(4)溶液注入容量瓶先需恢复到室温,这是因为______________ 。
(5)下列操作对配置溶液的浓度大小有何影响?
I.若没有进行步骤④,则所配溶液的浓度将会______________ 。
A.偏大 B.偏小 C.无影响
Ⅱ.俯视刻度线,则所配制的溶液浓度将会______________ 。
A.偏大 B.偏小 C.无影响
(6)定容时,取上述溶液100mL稀释至1000mL,所得溶液中钠离子的物质的量浓度为_____________ 。
(7)若实验过程中,加入蒸馏水时,不慎超过了刻度线,应如何处理?____________ 。
①用电子天平称出相应质量的Na2CO3固体。把它放入烧杯中,加入适量的蒸馏水,使它完全溶解。
②把制得的溶液,小心地注入___________中。
③继续向容量瓶中加蒸馏水至液面距离刻度1-2cm处,改用________小心滴加蒸馏水至液面凹液面最低处与刻度线相切。
④用少量蒸馏水洗涤玻璃棒和烧杯2-3次,每次洗涤的液体都要小心的转入容量瓶中。
⑤将瓶塞塞紧,充分摇匀。
(1)请填写②和③处仪器名称
(2)需要称取碳酸钠固体
(3)操作步骤正确的顺序为
(4)溶液注入容量瓶先需恢复到室温,这是因为
(5)下列操作对配置溶液的浓度大小有何影响?
I.若没有进行步骤④,则所配溶液的浓度将会
A.偏大 B.偏小 C.无影响
Ⅱ.俯视刻度线,则所配制的溶液浓度将会
A.偏大 B.偏小 C.无影响
(6)定容时,取上述溶液100mL稀释至1000mL,所得溶液中钠离子的物质的量浓度为
(7)若实验过程中,加入蒸馏水时,不慎超过了刻度线,应如何处理?
您最近一年使用:0次
名校
解题方法
10 . 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
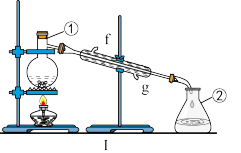
(1)写出仪器的名称:①_______ 。
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有_______ 。
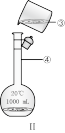
(3)某校环保兴趣小组在处理污水样品时,需用质量分数为37%、密度为1.19 g/cm3的浓盐酸配制成250 mL 0.1 mol/L的稀盐酸。装置Ⅱ是某同学转移溶液的示意图,图Ⅱ中的错误是_______ 。
①盛放浓盐酸的试剂瓶标签上应印有图中警示标识中的_______ 。(填序号)。
A. B.
B.  C.
C. D.
D.
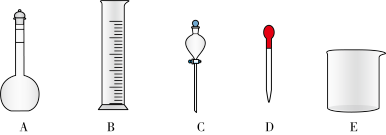
②在如图所示仪器中,配制上述溶液不需要的是_______ (填图中相应仪器的序号)。
③根据计算,本实验需要量取浓盐酸的体积为_______ mL,本实验应使用的量筒_______ (填序号)。
A.10ml B.100ml C.250ml D.500ml
④在容量瓶的使用方法中,下列操作正确的是_____ (填序号)。
A.使用容量瓶前检查是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住容量瓶底部,反复倒转多次,摇匀
⑤假设配制时其他操作均正确,只出现以下某一情况,试判断对所配制的溶液浓度的影响(相比于要求的值,即0.1 mol/L,填“偏高”“偏低”或“无影响”)。
A.容量瓶中有少量蒸馏水:_______ ;
B.稀释浓盐酸时,没有冷却就立即转移到容量瓶中:_______ ;
C.配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中:_______ ;
D.定容时俯视:_______ 。

(1)写出仪器的名称:①
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有
(3)某校环保兴趣小组在处理污水样品时,需用质量分数为37%、密度为1.19 g/cm3的浓盐酸配制成250 mL 0.1 mol/L的稀盐酸。装置Ⅱ是某同学转移溶液的示意图,图Ⅱ中的错误是

①盛放浓盐酸的试剂瓶标签上应印有图中警示标识中的
A.
 B.
B.  C.
C. D.
D.
②在如图所示仪器中,配制上述溶液不需要的是

③根据计算,本实验需要量取浓盐酸的体积为
A.10ml B.100ml C.250ml D.500ml
④在容量瓶的使用方法中,下列操作正确的是
A.使用容量瓶前检查是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住容量瓶底部,反复倒转多次,摇匀
⑤假设配制时其他操作均正确,只出现以下某一情况,试判断对所配制的溶液浓度的影响(相比于要求的值,即0.1 mol/L,填“偏高”“偏低”或“无影响”)。
A.容量瓶中有少量蒸馏水:
B.稀释浓盐酸时,没有冷却就立即转移到容量瓶中:
C.配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中:
D.定容时俯视:
您最近一年使用:0次
2022-07-20更新
|
106次组卷
|
2卷引用:内蒙古包头市第四中学2021-2022学年高一上学期期中考试化学试题



