1 . 葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
实验流程如下:


请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________ 。

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________ 。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是________ ;本实验中不宜用CaCl2替代CaCO3,理由是________ 。
(3)第③步需趁热过滤,其原因是________ 。
(4)第④步加入乙醇的作用是________ 。
(5)第⑥步中,下列洗涤剂最合适的是________ 。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |


请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是
(3)第③步需趁热过滤,其原因是
(4)第④步加入乙醇的作用是
(5)第⑥步中,下列洗涤剂最合适的是
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
您最近一年使用:0次
2016-12-09更新
|
2099次组卷
|
7卷引用:山东省滕州市第一中学2015-2016学年高一4月竞赛化学试题
山东省滕州市第一中学2015-2016学年高一4月竞赛化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(浙江卷)2014-2015学年广东省汕头市普通高中高二下学期教学测试化学试卷浙江省诸暨中学2017-2018学年高二上学期第二阶段考试化学试题(已下线)二轮复习 专题14 化学实验综合 押题专练【全国百强校】海南省海南中学2018届高三第五次月考化学试题(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
2014·山东青岛·一模
名校
2 . 碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl−)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
①氯酸钠的作用是____________ ;
②反应A后调节溶液的pH范围应为__________________________ 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净?____________________ 。
④造成蓝绿色产品中混有CuO杂质的原因是____________________ 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
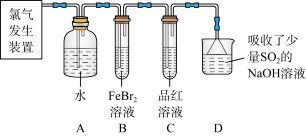
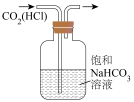
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有__________ 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因______ 。此时B装置中发生反应的离子方程式是______________ 。
③写出A溶液中具有强氧化性微粒的化学式___________ 。若向A溶液中加入NaHCO3粉末,会观察到的现象是_______ 。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl−)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
②反应A后调节溶液的pH范围应为
③第一次过滤得到的产品洗涤时,如何判断已经洗净?
④造成蓝绿色产品中混有CuO杂质的原因是
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。

①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因
③写出A溶液中具有强氧化性微粒的化学式
您最近一年使用:0次
解题方法
3 . 某化学兴趣小组的同学对实验室乙酸乙酯的制备和分离进行了实验探究。
制备:下列是该小组同学设计制备乙酸乙酯的实验装置。回答下列问题:
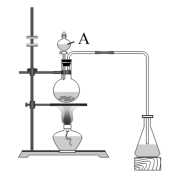
(1)仪器A的名称________ ,装置中长导管的主要作用是__________ ;
(2)证明锥形瓶中收集到乙酸乙酯的简单方法是_______________________ ;分离:锥形瓶中得到的产物是混合物,为了分离该混合物,设计了如下流程:
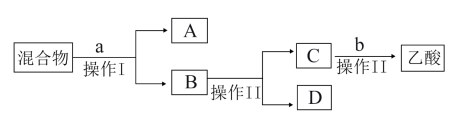
(3)a试剂最好选用__________ ;b试剂最好选用_____ 。
(4)操作Ⅰ、操作Ⅱ分别是_______
(5)讨论:研究表明质子酸离子液体也可用作酯化反应的催化剂。通过对比实验可以研究不同催化剂的催化效率,实验中除了需控制反应物乙酸、乙醇的用量相同外,还需控制的实验条件是___________ 。
制备:下列是该小组同学设计制备乙酸乙酯的实验装置。回答下列问题:

(1)仪器A的名称
(2)证明锥形瓶中收集到乙酸乙酯的简单方法是

(3)a试剂最好选用
(4)操作Ⅰ、操作Ⅱ分别是
| A.过滤、分液 | B.萃取、蒸馏 | C.分液、蒸馏 | D.过滤、蒸发 |
您最近一年使用:0次
解题方法
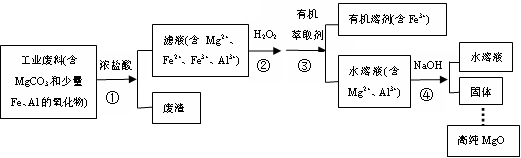
4 . 某研究性学习小组以一种工业废料制备高纯MgO,设计了流程如下。
请回答下列问题。
(1)步骤①中生成Mg2+的离子方程式为______________
(2)下列物质可用于代替步骤②中H2O2的是__________
A.NaCl B.Cl2 C.铁粉 D.KMnO4
(3)步骤③中采用如图所示装置除去Fe3+
ⅰ.实验装置图中仪器A的名称为________________
ⅱ.充分振荡并静置分层,打开仪器A上口的玻璃塞后,上、下层分离的正确操作是:________________
ⅲ.图中存在的错误是:________________
(4)步骤④中NaOH加入的量是______________ (填“少量”或“过量”)
(5)实验中,取工业废料40.0g( MgCO3的含量为42%),得到4.0g高纯氧化镁。该实验中高纯氧化镁的产率为____________ (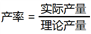 )
)
(6)高纯氧化镁可能具有如下性质和用途,正确的是____________
A.耐酸 B.耐碱 C.制耐火坩埚 D.制信号弹和焰火材料
请回答下列问题。
(1)步骤①中生成Mg2+的离子方程式为
(2)下列物质可用于代替步骤②中H2O2的是
A.NaCl B.Cl2 C.铁粉 D.KMnO4
(3)步骤③中采用如图所示装置除去Fe3+
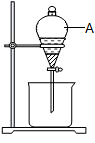
ⅰ.实验装置图中仪器A的名称为
ⅱ.充分振荡并静置分层,打开仪器A上口的玻璃塞后,上、下层分离的正确操作是:
ⅲ.图中存在的错误是:
(4)步骤④中NaOH加入的量是
(5)实验中,取工业废料40.0g( MgCO3的含量为42%),得到4.0g高纯氧化镁。该实验中高纯氧化镁的产率为
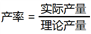 )
)(6)高纯氧化镁可能具有如下性质和用途,正确的是
A.耐酸 B.耐碱 C.制耐火坩埚 D.制信号弹和焰火材料
您最近一年使用:0次
名校
解题方法
5 . 磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图如下:
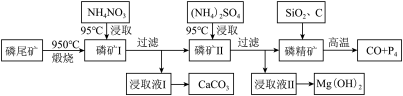
请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度_______________ (填“高于”、“低于” )950℃;
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是________________ ,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是__________________________ 。
(3)磷精矿与SiO2、C发生反应时被还原的物质是_______________ 。
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示。
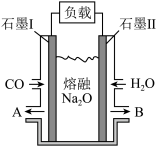
写出石墨Ⅰ电极上发生反应的电极反应式_______________ ,Na+向________ (填写“石墨Ⅰ”或“石墨Ⅱ”)移动。
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸。
①常温下关于1 L 0.1 mol·L-1 HCOONa溶液,下列关系不正确的是____________ 。
a.c(H+)·c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,c(HCOOH)·c(OH-)的数值________ (填写“增大”“减小”或“不变”)。

请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是
(3)磷精矿与SiO2、C发生反应时被还原的物质是
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示。

写出石墨Ⅰ电极上发生反应的电极反应式
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸。
①常温下关于1 L 0.1 mol·L-1 HCOONa溶液,下列关系不正确的是
a.c(H+)·c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,c(HCOOH)·c(OH-)的数值
您最近一年使用:0次
2017-02-17更新
|
467次组卷
|
3卷引用:四川省南充高级中学2023-2024学年高一上学期 期末化学模拟试卷
6 . ClO2是一种高效、广谱、安全的杀菌、消毒剂,易溶于水。制备方法如下:
(1)步骤Ⅰ:电解食盐水制备氯酸钠。用于电解的食盐水需先除去其中的 Ca2+、Mg2+、SO42-等杂质。在除杂操作时,往粗盐水中先加入过量的________ (填化学式),至沉淀不再产生后,再加入过量的________ 和NaOH,充分反应后将沉淀一并滤去。
(2)步骤Ⅱ:将步骤Ⅰ得到的食盐水在特定条件下电解得到氯酸钠(NaClO3),再将它与盐酸反应生成ClO2与Cl2,ClO2与Cl2的物质的量比是____________ 。
(3)学生拟用左下图所示装置模拟工业制取并收集ClO2,用NaClO3和草酸(H2C2O4)恒温在60℃ 时反应制得。

反应过程中需要对A容器进行加热,加热的方式为____________ ;加热需要的玻璃仪器除酒精灯外,还有_________________ ;
(4)反应后在装置C中可得亚氯酸钠(NaClO2)溶液。已知NaClO2饱和溶液在温度低于38℃时,析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的是NaClO2。根据右上图所示NaClO2的溶解度曲线,请完成从NaClO2溶液中制得NaClO2·3H2O的操作步骤:
①_____________ ;②_______________ ;③洗涤;④干燥。
(5)目前我国已成功研制出利用NaClO2制取二氧化氯的新方法,将Cl2通入到NaClO2溶液中。现制取270kg二氧化氯,需要亚氯酸钠的质量是________ 。
(6)ClO2和Cl2均能将电镀废水中的剧毒CN-氧化为无毒物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的_______ 倍。
(1)步骤Ⅰ:电解食盐水制备氯酸钠。用于电解的食盐水需先除去其中的 Ca2+、Mg2+、SO42-等杂质。在除杂操作时,往粗盐水中先加入过量的
(2)步骤Ⅱ:将步骤Ⅰ得到的食盐水在特定条件下电解得到氯酸钠(NaClO3),再将它与盐酸反应生成ClO2与Cl2,ClO2与Cl2的物质的量比是
(3)学生拟用左下图所示装置模拟工业制取并收集ClO2,用NaClO3和草酸(H2C2O4)恒温在60℃ 时反应制得。

反应过程中需要对A容器进行加热,加热的方式为
(4)反应后在装置C中可得亚氯酸钠(NaClO2)溶液。已知NaClO2饱和溶液在温度低于38℃时,析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的是NaClO2。根据右上图所示NaClO2的溶解度曲线,请完成从NaClO2溶液中制得NaClO2·3H2O的操作步骤:
①
(5)目前我国已成功研制出利用NaClO2制取二氧化氯的新方法,将Cl2通入到NaClO2溶液中。现制取270kg二氧化氯,需要亚氯酸钠的质量是
(6)ClO2和Cl2均能将电镀废水中的剧毒CN-氧化为无毒物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的
您最近一年使用:0次
2016-12-09更新
|
1248次组卷
|
3卷引用:安徽省黄山市八校联盟2019-2020学年高一下学期期中联考化学试题
11-12高一上·浙江温州·期中
7 . 食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
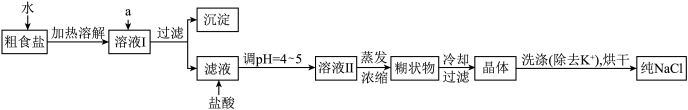
提供的试剂如下:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
欲除去溶液Ⅰ中的Ca2+、Mg2+、 离子,选出a所代表的多种试剂,按滴加顺序依次为
离子,选出a所代表的多种试剂,按滴加顺序依次为________________________________ 。(只填化学式)
(2)电解饱和食盐水的装置如图所示,如果在饱和食盐水中滴加酚酞,通电后_______ (填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式____________________ 。

(3)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置____________ (填代号)和制备并收集干燥、纯净Cl2的装置____________ (填代号)。

(1)粗食盐常含有少量Ca2+、Mg2+、
 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂如下:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
欲除去溶液Ⅰ中的Ca2+、Mg2+、
 离子,选出a所代表的多种试剂,按滴加顺序依次为
离子,选出a所代表的多种试剂,按滴加顺序依次为(2)电解饱和食盐水的装置如图所示,如果在饱和食盐水中滴加酚酞,通电后

(3)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O据此,从下列所给仪器装置中选择制备并收集H2的装置

您最近一年使用:0次
真题
名校
8 . 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
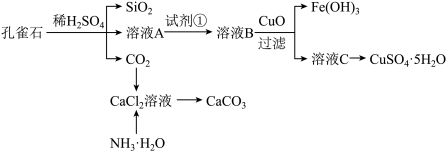
请回答下列问题:
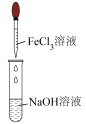
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为______ (填代号),检验溶液A中Fe3+的最佳试剂为___ (填代号)。
a.KMnO4b.(NH4) 2S c.H2O2d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、_________ 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是_____ 。
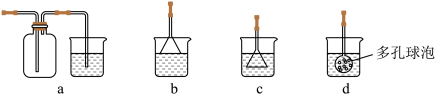
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)__________ (填化学式),若实验过程中有氨气逸出,应选用下列_____ 装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应______________________ ,直到______________________________ ,用KMnO4标准溶液滴定时应选用___ 滴定管(填“酸式”或“碱式”)。

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为
a.KMnO4b.(NH4) 2S c.H2O2d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)

(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应
您最近一年使用:0次
2010-03-10更新
|
134次组卷
|
7卷引用:09真题汇编-物质的制备、分离与提纯、鉴别与检验
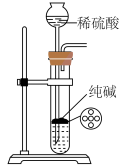
9 . 下列实验装置或操作能达到相应实验目的的是
选项 | A | B | C | D |
实验 装置 |
|
|
|
|
实验 目的 | 除去 中的 中的 | 制取纯净的 沉淀 沉淀 | 制取少量 气体 气体 | 用 浓硫酸配制 浓硫酸配制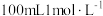 稀硫酸会涉及图中所示操作 稀硫酸会涉及图中所示操作 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次