名校
1 . 碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。
Ⅰ.碱式碳酸铜的制备
①步骤ⅱ中发生的化学反应方程式为_____ 。
②原料中 必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因
必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因_____ (用离子方程式表示)。
③步骤ⅱ中反应温度低于80℃的原因是_____ 。
(2)在步骤(ⅲ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤(把上层清液直接倾入另一容器中,让沉淀尽可能留在烧杯内)、趁热过滤与减压过滤,最终制得蓝绿色固体。该实验流程中会使用到的下列装置有_____ (填序号);
同学们设计了如图装置,针对制得的蓝绿色固体进行检验。 ,点燃D处酒精灯。C中盛装的试剂应是
,点燃D处酒精灯。C中盛装的试剂应是_____ ;
(4)若蓝绿色固体的组成为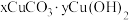 ,实验能观察到的现象是:D中现象为
,实验能观察到的现象是:D中现象为_____ ,E中现象为_____ ,F中现象为_____ 。
(5)同学们查阅文献得知: ,
,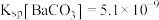 ,经讨论认为用
,经讨论认为用 代替
代替 来定量测定蓝绿色固体的化学式会更好,其原因是
来定量测定蓝绿色固体的化学式会更好,其原因是_____ (填序号);
a. 的碱性比
的碱性比 强
强
b.吸收等量 生成的
生成的 的质量大于
的质量大于 ,测量误差小
,测量误差小
c.相同条件下, 的溶解度明显大于
的溶解度明显大于
d. 溶解度大于
溶解度大于 ,能充分吸收
,能充分吸收
(6)若蓝绿色固体的组成为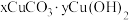 。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为
。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为 溶液,
溶液, 的相对分子质量为197]。则该蓝绿色固体的化学式为
的相对分子质量为197]。则该蓝绿色固体的化学式为_____ 。
Ⅰ.碱式碳酸铜的制备

①步骤ⅱ中发生的化学反应方程式为
②原料中
 必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因
必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因③步骤ⅱ中反应温度低于80℃的原因是
(2)在步骤(ⅲ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤(把上层清液直接倾入另一容器中,让沉淀尽可能留在烧杯内)、趁热过滤与减压过滤,最终制得蓝绿色固体。该实验流程中会使用到的下列装置有
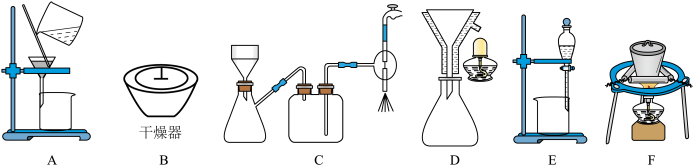
同学们设计了如图装置,针对制得的蓝绿色固体进行检验。
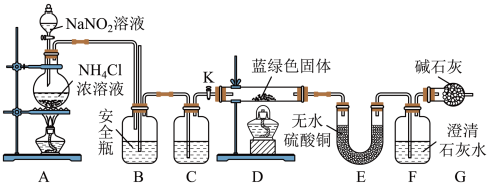
 ,点燃D处酒精灯。C中盛装的试剂应是
,点燃D处酒精灯。C中盛装的试剂应是(4)若蓝绿色固体的组成为
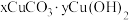 ,实验能观察到的现象是:D中现象为
,实验能观察到的现象是:D中现象为(5)同学们查阅文献得知:
 ,
,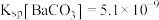 ,经讨论认为用
,经讨论认为用 代替
代替 来定量测定蓝绿色固体的化学式会更好,其原因是
来定量测定蓝绿色固体的化学式会更好,其原因是a.
 的碱性比
的碱性比 强
强b.吸收等量
 生成的
生成的 的质量大于
的质量大于 ,测量误差小
,测量误差小c.相同条件下,
 的溶解度明显大于
的溶解度明显大于
d.
 溶解度大于
溶解度大于 ,能充分吸收
,能充分吸收
(6)若蓝绿色固体的组成为
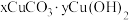 。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为
。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为 溶液,
溶液, 的相对分子质量为197]。则该蓝绿色固体的化学式为
的相对分子质量为197]。则该蓝绿色固体的化学式为
您最近一年使用:0次
名校
2 . 工业上,从有机催化剂(主要含钴和锌)回收金属的简易流程如下:
(1)“灼烧”的目的是___________ 。“酸浸”时加入稀硫酸,浸出液含有 、
、 、
、 、
、 、
、 等,检验
等,检验 的试剂是
的试剂是___________ (填化学式)。
(2)“净化”中加入 ,生成
,生成 和
和 。书写离子方程式:
。书写离子方程式:___________ 。
(3) (已知其中硫为+6价)中含
(已知其中硫为+6价)中含___________ mol过氧键 ,“沉钴”中加入
,“沉钴”中加入 ,还原产物为
,还原产物为 。
。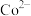 转化成
转化成 ,理论上消耗
,理论上消耗___________ mol 。
。
(4)“沉钴”的 不能太高,原因是
不能太高,原因是___________ 。
(5)“沉锌”加入 ,反应的离子方程式为
,反应的离子方程式为___________ ;沉锌的温度不能太高,原因是___________ 。
(6)“沉钴”中, 时
时 的数量级为
的数量级为___________ 。

(1)“灼烧”的目的是
 、
、 、
、 、
、 、
、 等,检验
等,检验 的试剂是
的试剂是(2)“净化”中加入
 ,生成
,生成 和
和 。书写离子方程式:
。书写离子方程式:(3)
 (已知其中硫为+6价)中含
(已知其中硫为+6价)中含 ,“沉钴”中加入
,“沉钴”中加入 ,还原产物为
,还原产物为 。
。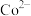 转化成
转化成 ,理论上消耗
,理论上消耗 。
。(4)“沉钴”的
 不能太高,原因是
不能太高,原因是(5)“沉锌”加入
 ,反应的离子方程式为
,反应的离子方程式为(6)“沉钴”中,
 时
时 的数量级为
的数量级为
您最近一年使用:0次
解题方法
3 . SnO2是锡的重要氧化物,现以锡锑渣(主要含塑料及SnO2、Sb4O6、PbO2)为原料,提纯SnO2的工艺流程图如下:
②Na2SnO3可溶于水,难溶于乙醇。
请回答下列问题:
(1)“焙烧”的主要目的是_______ 。
(2)“沉铅”时同时生成S沉淀的化学方程式_______ 。
(3)“还原”时Na3SbO4发生的离子方程式为_______ 。
(4)在不同溶剂中Na2SnO3的溶解度随温度变化如图。_______ 。
②由Na2SnO3溶液可获得Na2SnO3晶体,具体操作方法为_______ 、用_______ 洗涤、干燥。
(5)下列冶炼方法与本工艺流程中加入焦炭冶炼锡的方法相似的是_______。
(6)将10kg锡锑渣进行碱浸,“还原”时消耗0. 13kg锡粒,假设其余各步损失不计,干燥后称量锡酸钠质量为4. 0kg,滴定测得锡酸钠中锡的质量分数为53. 5%。锡锑渣中锡元素的质量分数为_______ 。

②Na2SnO3可溶于水,难溶于乙醇。
请回答下列问题:
(1)“焙烧”的主要目的是
(2)“沉铅”时同时生成S沉淀的化学方程式
(3)“还原”时Na3SbO4发生的离子方程式为
(4)在不同溶剂中Na2SnO3的溶解度随温度变化如图。
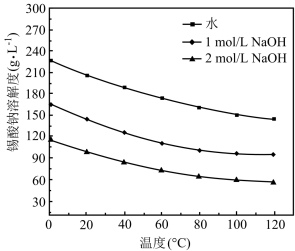
②由Na2SnO3溶液可获得Na2SnO3晶体,具体操作方法为
(5)下列冶炼方法与本工艺流程中加入焦炭冶炼锡的方法相似的是_______。
| A.工业制粗硅 | B.电解熔融氯化钠制钠 |
| C.氧化汞分解制汞 | D.工业炼铁 |
(6)将10kg锡锑渣进行碱浸,“还原”时消耗0. 13kg锡粒,假设其余各步损失不计,干燥后称量锡酸钠质量为4. 0kg,滴定测得锡酸钠中锡的质量分数为53. 5%。锡锑渣中锡元素的质量分数为
您最近一年使用:0次
解题方法
4 . 一种回收锌电解阳极泥(主要成分为 、
、 和
和 ,还有少量锰铅复合氧化物
,还有少量锰铅复合氧化物 和
和 )中金属元素锌、铅和银的工艺流程如下。回答下列问题:
)中金属元素锌、铅和银的工艺流程如下。回答下列问题: 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。
(1) 中
中 的化合价为+2价,
的化合价为+2价, 的化合价有+2价和+4价,则氧化物中+2价和+4价
的化合价有+2价和+4价,则氧化物中+2价和+4价 的个数比为
的个数比为___________ ,基态 原子的价层电子排布图为
原子的价层电子排布图为___________ 。
(2)滤液1的主要溶质为___________ (填化学式)。
(3)“还原酸浸”工序中主要反应的化学方程式为___________ 。
(4)结合 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”为加热蒸发、趁热过滤、洗涤、干燥。结合
晶体的“一系列操作”为加热蒸发、趁热过滤、洗涤、干燥。结合 溶解度曲线分析趁热过滤的原因是
溶解度曲线分析趁热过滤的原因是___________ 。 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成
,在阴极放电生成 单质,有利于
单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为___________ 。
(6)通过计算说明可用 溶液将“滤渣”中的
溶液将“滤渣”中的 转化为
转化为 的原因
的原因___________ 。[已知:25℃时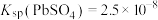 ,
,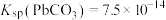 ]
]
(7)锰、镍、镓的某种磁性形状记忆型合金的晶胞结构如图所示。 表示阿伏加德罗常数的值。该晶体的密度为
表示阿伏加德罗常数的值。该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 、
、 和
和 ,还有少量锰铅复合氧化物
,还有少量锰铅复合氧化物 和
和 )中金属元素锌、铅和银的工艺流程如下。回答下列问题:
)中金属元素锌、铅和银的工艺流程如下。回答下列问题:
 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。(1)
 中
中 的化合价为+2价,
的化合价为+2价, 的化合价有+2价和+4价,则氧化物中+2价和+4价
的化合价有+2价和+4价,则氧化物中+2价和+4价 的个数比为
的个数比为 原子的价层电子排布图为
原子的价层电子排布图为(2)滤液1的主要溶质为
(3)“还原酸浸”工序中主要反应的化学方程式为
(4)结合
 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”为加热蒸发、趁热过滤、洗涤、干燥。结合
晶体的“一系列操作”为加热蒸发、趁热过滤、洗涤、干燥。结合 溶解度曲线分析趁热过滤的原因是
溶解度曲线分析趁热过滤的原因是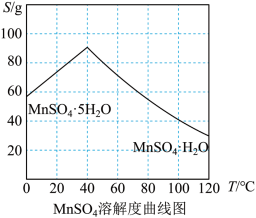
 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成
,在阴极放电生成 单质,有利于
单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为(6)通过计算说明可用
 溶液将“滤渣”中的
溶液将“滤渣”中的 转化为
转化为 的原因
的原因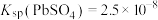 ,
,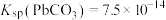 ]
](7)锰、镍、镓的某种磁性形状记忆型合金的晶胞结构如图所示。
 表示阿伏加德罗常数的值。该晶体的密度为
表示阿伏加德罗常数的值。该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。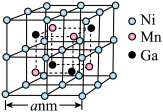
您最近一年使用:0次
解题方法
5 . 锰锌铁氧体是一种典型的软磁材料,广泛应用于电子,通讯等领域,主要成分是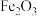 、
、 、
、 ,由黄钾铁矾渣(主要成分为
,由黄钾铁矾渣(主要成分为 ,还含有
,还含有 ,
, ,
, 、
、 、
、 、
、 等硫酸盐及
等硫酸盐及 ]制备锰锌铁氧体的流程如图。
]制备锰锌铁氧体的流程如图。
(1)“酸浸”后,浸渣的主要成分有___________ (填化学式),能提高浸出率的措施有___________ (任写两点即可)。
(2)加入铁粉时,反应温度对 浓度的影响如图,反应的最佳温度为
浓度的影响如图,反应的最佳温度为___________ 。___________ 。
(4)“除铜、镉”中,最先沉淀的离子是___________ (填离子符号),若要将溶液中的铜和镉完全沉淀,溶液中的 不低于
不低于___________ mol/L。
(5)若锰锌铁氧体中金属元素理论质量配比为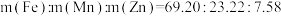 ,若调节成分前溶液中
,若调节成分前溶液中 ,
, ,则应加入的
,则应加入的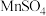 质量为
质量为___________ g。
(6)若以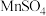 代表溶液成分,则“共沉反应”中,发生反应的离子方程式为
代表溶液成分,则“共沉反应”中,发生反应的离子方程式为___________ 。
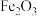 、
、 、
、 ,由黄钾铁矾渣(主要成分为
,由黄钾铁矾渣(主要成分为 ,还含有
,还含有 ,
, ,
, 、
、 、
、 、
、 等硫酸盐及
等硫酸盐及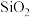 ]制备锰锌铁氧体的流程如图。
]制备锰锌铁氧体的流程如图。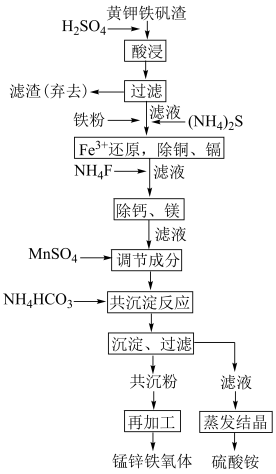
| 表1 有关离子沉淀的pH | |||||
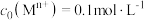 ( (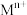 为金属离子) 为金属离子) | 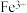 | 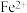 | 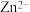 |  | 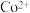 |
| 开始沉淀pH | 2.2 | 5.8 | 6.2 | 4.4 | 7.2 |
完全沉淀pH(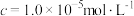 ) ) | 3.2 | 8.3 | 8.2 | 6.4 | 9.2 |
| 表2 物质的溶度积常数 | ||||
| 物质 |  |  |  |  |
 | 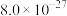 |  | 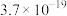 | 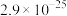 |
(1)“酸浸”后,浸渣的主要成分有
(2)加入铁粉时,反应温度对
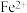 浓度的影响如图,反应的最佳温度为
浓度的影响如图,反应的最佳温度为
(4)“除铜、镉”中,最先沉淀的离子是
 不低于
不低于(5)若锰锌铁氧体中金属元素理论质量配比为
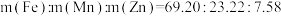 ,若调节成分前溶液中
,若调节成分前溶液中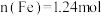 ,
, ,则应加入的
,则应加入的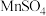 质量为
质量为(6)若以
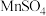 代表溶液成分,则“共沉反应”中,发生反应的离子方程式为
代表溶液成分,则“共沉反应”中,发生反应的离子方程式为
您最近一年使用:0次
名校
6 . 铋酸钠( )是一种强氧化剂。由辉铋矿(主要成分为
)是一种强氧化剂。由辉铋矿(主要成分为 ,含
,含 、
、 、CuO等杂质)制备
、CuO等杂质)制备 的工艺流程如下:
的工艺流程如下:
① 易水解,
易水解, 难溶于冷水,与热水反应,
难溶于冷水,与热水反应, 不溶于水。
不溶于水。
②“氧化浸取”时,硫元素转化为硫单质。
③常温下,有关金属离子开始沉淀和沉淀完全的pH如表:
回答下列问题:
(1)铋元素在周期表中的位置_________ 。“滤渣1”的主要成分为________ (填化学式)。
(2)“氧化浸取”过程中,需要控制温度不超过40℃的原因是_______________ , 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)已知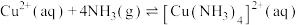 ,
, 中
中 的配位数为
的配位数为________________ ,配体的空间结构为__________ 。
(4)“氧化”过程发生反应的离子方程式为_________________ 。
(5)取1.0g制得的 产品,加入足量稀硫酸和
产品,加入足量稀硫酸和 稀溶液,发生反应
稀溶液,发生反应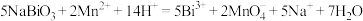 ,完全反应后再用0.1000
,完全反应后再用0.1000 的
的 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色恰好褪去时,消耗20.00mL
,当溶液紫红色恰好褪去时,消耗20.00mL  标准溶液,则产品中铋元素的质量百分含量为
标准溶液,则产品中铋元素的质量百分含量为__________ %。
(6)我国科学家对新型二维半导体芯片材料——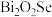 的研究取得了突破性进展。
的研究取得了突破性进展。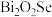 的晶胞结构中
的晶胞结构中 的位置如图所示(略去
的位置如图所示(略去 、
、 ),已知晶胞为竖直的长方体,高为b pm,晶体密度为
),已知晶胞为竖直的长方体,高为b pm,晶体密度为 。设
。设 为阿伏加德罗常数的值,则晶胞底边边长a=
为阿伏加德罗常数的值,则晶胞底边边长a=_______ (填含b、 、
、 的计算式,不必化简)。
的计算式,不必化简)。
 )是一种强氧化剂。由辉铋矿(主要成分为
)是一种强氧化剂。由辉铋矿(主要成分为 ,含
,含 、
、 、CuO等杂质)制备
、CuO等杂质)制备 的工艺流程如下:
的工艺流程如下:
①
 易水解,
易水解, 难溶于冷水,与热水反应,
难溶于冷水,与热水反应, 不溶于水。
不溶于水。②“氧化浸取”时,硫元素转化为硫单质。
③常温下,有关金属离子开始沉淀和沉淀完全的pH如表:
金属离子 |
|
|
|
|
开始沉淀的pH | 7.6 | 2.7 | 4.8 | 4.5 |
沉淀完全的pH | 9.6 | 3.7 | 6.4 | 5.5 |
(1)铋元素在周期表中的位置
(2)“氧化浸取”过程中,需要控制温度不超过40℃的原因是
 发生反应的化学方程式为
发生反应的化学方程式为(3)已知
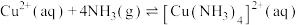 ,
, 中
中 的配位数为
的配位数为(4)“氧化”过程发生反应的离子方程式为
(5)取1.0g制得的
 产品,加入足量稀硫酸和
产品,加入足量稀硫酸和 稀溶液,发生反应
稀溶液,发生反应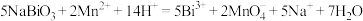 ,完全反应后再用0.1000
,完全反应后再用0.1000 的
的 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色恰好褪去时,消耗20.00mL
,当溶液紫红色恰好褪去时,消耗20.00mL  标准溶液,则产品中铋元素的质量百分含量为
标准溶液,则产品中铋元素的质量百分含量为(6)我国科学家对新型二维半导体芯片材料——
 的研究取得了突破性进展。
的研究取得了突破性进展。 的晶胞结构中
的晶胞结构中 的位置如图所示(略去
的位置如图所示(略去 、
、 ),已知晶胞为竖直的长方体,高为b pm,晶体密度为
),已知晶胞为竖直的长方体,高为b pm,晶体密度为 。设
。设 为阿伏加德罗常数的值,则晶胞底边边长a=
为阿伏加德罗常数的值,则晶胞底边边长a= 、
、 的计算式,不必化简)。
的计算式,不必化简)。
您最近一年使用:0次
7 . 物能循环是人类社会可持续发展的重要措施。某化学实验室用过量 溶液处理覆铜板得到浸出液,并对浸出液中的物质进行回收,实验流程如下。下列有关说法错误的是
溶液处理覆铜板得到浸出液,并对浸出液中的物质进行回收,实验流程如下。下列有关说法错误的是
 溶液处理覆铜板得到浸出液,并对浸出液中的物质进行回收,实验流程如下。下列有关说法错误的是
溶液处理覆铜板得到浸出液,并对浸出液中的物质进行回收,实验流程如下。下列有关说法错误的是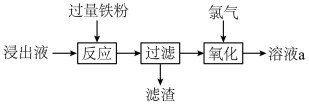
| A.若向浸出液中加入过量氨水可得到蓝色沉淀 |
B.滤渣的主要成分为 和 和 |
C.用 溶液检验是否“氧化”完全 溶液检验是否“氧化”完全 |
D.溶液 显酸性 显酸性 |
您最近一年使用:0次
名校
解题方法
8 . 肉桂酸广泛应用于香精香料、食品添加剂、医药工业、美容和有机合成等方面。其合成原理及实验室制备方法如下:
i.在50mL仪器a中加入5mL苯甲醛、14mL乙酸酐和12g无水碳酸钾粉末(过量),加热回流45min。
ii.向反应混合物中加入40mL蒸馏水浸泡几分钟,进行水蒸气蒸馏。
iii.将烧瓶冷却后,加入10g碳酸钠,再加入70mL水,加热煮沸,趁热过滤。
iV.待滤液冷却至室温后,在搅拌下小心加入40mL 盐酸,使溶液呈酸性。
盐酸,使溶液呈酸性。
V.冷却结晶,抽滤,用少量试剂b洗涤,80℃烘干,得粗产品4.5g。
回答下列问题:
(1)仪器使用前必须干燥,原因是___________ 。
(2)加热回流装置中仪器a的名称是___________ ,不使用水冷冷凝管而用空气冷凝管是为了___________ 。
(3)整个实验过程中温度不宜超过180℃,原因是___________ 。
(4)水蒸气蒸馏装置中止水夹的主要作用是___________ 。
(5)步骤V中试剂b是___________ 。
(6)本实验肉桂酸的产率最接近___________ (填标号)。若产物不纯,则提纯产物的方法为___________ 。
A.50% B.60% C.70% D.80%
主反应:
温度较高时发生副反应: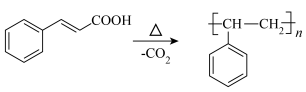
i.在50mL仪器a中加入5mL苯甲醛、14mL乙酸酐和12g无水碳酸钾粉末(过量),加热回流45min。
ii.向反应混合物中加入40mL蒸馏水浸泡几分钟,进行水蒸气蒸馏。
iii.将烧瓶冷却后,加入10g碳酸钠,再加入70mL水,加热煮沸,趁热过滤。
iV.待滤液冷却至室温后,在搅拌下小心加入40mL
 盐酸,使溶液呈酸性。
盐酸,使溶液呈酸性。V.冷却结晶,抽滤,用少量试剂b洗涤,80℃烘干,得粗产品4.5g。

| 名称 | 相对分子质量 | 密度/ | 熔点/℃ | 沸点/℃ | 溶解度:g/100mL | ||
| 水 | 醇 | 醚 | |||||
| 苯甲醛 | 106 | 1.04 | -26 | 178~179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 1.08 | -79 | 138~140 | 遇水生成乙酸 | 溶 | 不溶 |
| 肉桂 | 148 | 1.24 | 133~134 | 300 | 0.04 | 24 | 溶 |
(1)仪器使用前必须干燥,原因是
(2)加热回流装置中仪器a的名称是
(3)整个实验过程中温度不宜超过180℃,原因是
(4)水蒸气蒸馏装置中止水夹的主要作用是
(5)步骤V中试剂b是
(6)本实验肉桂酸的产率最接近
A.50% B.60% C.70% D.80%
您最近一年使用:0次
名校
9 . 钯(Pd)见一种银白色过渡金属,质软、有良好的延展性和可塑性,可锻造、压延和拉丝。块状金属钯能吸收大量氢气,使体积显著胀大、变脆乃至破裂成碎片。一种从废钯催化剂(杂质主要含有机物、活性炭及少量Fe、Cu、Al等元素)中回收钯和催化剂FeOCl的工艺流程如图所示:
②离子交换树脂的基本工作原理分别为 (
( 表示树脂的有机成分);
表示树脂的有机成分);
③常温下,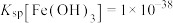 ,
,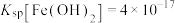 ,
,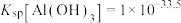 ;当溶液中某离子浓度小于等于
;当溶液中某离子浓度小于等于 时,可认为该离子沉淀完全;
时,可认为该离子沉淀完全;
④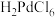 是一种二元强酸,
是一种二元强酸,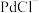 在溶液中存在配位平衡:
在溶液中存在配位平衡: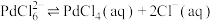
 ;
;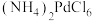 在水中溶解度小。
在水中溶解度小。
回答下列问题:
(1)废钯催化剂“焙烧”时,先通入空气进行逆流式焙烧的目的是___________ ,再通入甲酸继续焙烧的目的是___________ 。
(2)“酸浸”过程需要升高温度至70℃左右,则主要反应的离子方程式为___________ 。
(3)“洗脱”时,加入最佳“试剂Y”的名称是___________ ,“洗脱液”中要加入过量 的目的是
的目的是___________ 。
(4)“还原”过程中,不生成污染环境的气体,则被氧化的元素与被还原的元素物质的量之比为___________ 。“调pH”步骤中,若铁元素和铝元素浓度均为 ,则调pH的范围为
,则调pH的范围为___________  。
。

②离子交换树脂的基本工作原理分别为
 (
(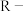 表示树脂的有机成分);
表示树脂的有机成分);③常温下,
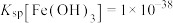 ,
,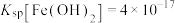 ,
,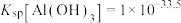 ;当溶液中某离子浓度小于等于
;当溶液中某离子浓度小于等于 时,可认为该离子沉淀完全;
时,可认为该离子沉淀完全;④
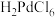 是一种二元强酸,
是一种二元强酸,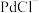 在溶液中存在配位平衡:
在溶液中存在配位平衡: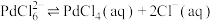
 ;
;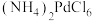 在水中溶解度小。
在水中溶解度小。回答下列问题:
(1)废钯催化剂“焙烧”时,先通入空气进行逆流式焙烧的目的是
(2)“酸浸”过程需要升高温度至70℃左右,则主要反应的离子方程式为
(3)“洗脱”时,加入最佳“试剂Y”的名称是
 的目的是
的目的是(4)“还原”过程中,不生成污染环境的气体,则被氧化的元素与被还原的元素物质的量之比为
 ,则调pH的范围为
,则调pH的范围为 。
。
您最近一年使用:0次
10 . 从钒铬锰矿渣(主要成分为V2O5、Cr2O3、MnO)中提铬的一种工艺流程如下:
下列说法错误的是

下列说法错误的是
| A.Cr元素位于元素周期表第四周期 VIB 族 |
| B.“沉钒”过程利用了 Fe(OH)3(胶体)的吸附性,使含钒微粒与胶体共沉降 |
| C.“转化”过程中生成MnO2的离子方程式为Mn2++H2O2+2OH-=MnO2+2H2O |
| D.“提纯”过程中Na2S2O3的作用是还原含铬元素的物质 |
您最近一年使用:0次



