名校
解题方法
1 . 二苯铬[(C6H6)2Cr]可作烯烃聚合或异丙醇脱氢等反应的催化剂,工业上常用 Cr2O3为原料按如下流程制备二苯铬
下列说法正确的是
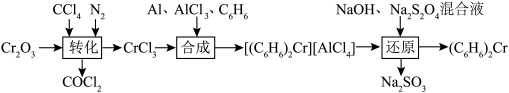
下列说法正确的是
| A.为了向“转化”提供稳定的CCl4气流,可用水浴加热 CCl4并用氮气带出CCl4 |
| B.1mol[(C6H6)2Cr][AlCl4]中含有6NA个配位键(NA表示阿伏加德罗常数的值) |
| C.“还原”中,还需通入一定量N₂,主要目的是防止Na2S2O4被氧化 |
| D.“还原”后,经过滤、蒸馏水洗涤可得到纯净的二苯铬 |
您最近一年使用:0次
昨日更新
|
60次组卷
|
3卷引用:湖南省邵阳市第二中学2024届下学期5月模拟考试(三模)化学试题
解题方法
2 . 碱式碳酸铜在焰火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿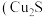 ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示:
等杂质)为原料制备碱式碳酸铜的流程如图所示: 为无色液体,是硫、磷、硒、澳、碘、樟脑等的良好溶剂,具有挥发性。
为无色液体,是硫、磷、硒、澳、碘、樟脑等的良好溶剂,具有挥发性。
回答下列问题:
(1) 的电子式为
的电子式为_____ 。
(2)滤渣I经 提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是
提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是 和
和_____ (填化学式)。“浸取”时 发生反应的离子方程式为
发生反应的离子方程式为_____ 。
(3)“除铁”时,加入试剂 的目的是调节溶液的
的目的是调节溶液的 为2.9以完全除去铁元素(溶液中离子浓度小于
为2.9以完全除去铁元素(溶液中离子浓度小于 即可视为完全沉淀),则试剂
即可视为完全沉淀),则试剂 可用
可用_____ (填化学式)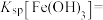
____ 。
(4)写出“沉锰”(除 )过程中发生反应的离子方程式:
)过程中发生反应的离子方程式:_______ 。
(5)“赶氨”时,最适宜的操作方法是_______ 。
(6)副产品 在真空中加热分解制备
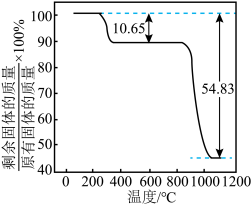
在真空中加热分解制备 ,分解过程中测得固体的质量随温度变化如图所示。温度应控制的范围是
,分解过程中测得固体的质量随温度变化如图所示。温度应控制的范围是_______ (填字母)。
A.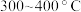 B.
B.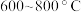 C.
C.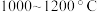
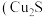 ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示:
等杂质)为原料制备碱式碳酸铜的流程如图所示: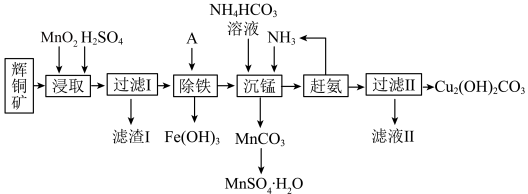
 为无色液体,是硫、磷、硒、澳、碘、樟脑等的良好溶剂,具有挥发性。
为无色液体,是硫、磷、硒、澳、碘、樟脑等的良好溶剂,具有挥发性。回答下列问题:
(1)
 的电子式为
的电子式为(2)滤渣I经
 提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是
提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是 和
和 发生反应的离子方程式为
发生反应的离子方程式为(3)“除铁”时,加入试剂
 的目的是调节溶液的
的目的是调节溶液的 为2.9以完全除去铁元素(溶液中离子浓度小于
为2.9以完全除去铁元素(溶液中离子浓度小于 即可视为完全沉淀),则试剂
即可视为完全沉淀),则试剂 可用
可用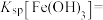
(4)写出“沉锰”(除
 )过程中发生反应的离子方程式:
)过程中发生反应的离子方程式:(5)“赶氨”时,最适宜的操作方法是
(6)副产品
 在真空中加热分解制备
在真空中加热分解制备 ,分解过程中测得固体的质量随温度变化如图所示。温度应控制的范围是
,分解过程中测得固体的质量随温度变化如图所示。温度应控制的范围是A.
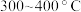 B.
B.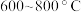 C.
C.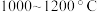
您最近一年使用:0次
3 . [Cu(NH3)4]SO4•H2O是铜的重要配合物,其制备原料之一CuSO4可用废铜屑制备,其实验方案如下:
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
| A.方案1使用的玻璃仪器有烧杯、分液漏斗、玻璃棒和酒精灯 |
| B.方案2中参与反应的硫酸利用率为50%,且产生大气污染物 |
| C.方案3的离子方程式为Cu+H2O2+2H+=Cu2++2H2O |
D.方案4的化学方程式为2Cu+H2SO4+O2 2CuSO4+2H2O 2CuSO4+2H2O |
您最近一年使用:0次
名校
解题方法
4 . 实验室由1,3,5-三甲苯(密度为0.87gcm3)为主要有机原料制备2,4,6-三甲基苯甲酸的反应原理为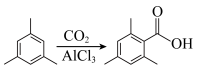 ;
;
| 物质 | 性状 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1,3,5-三甲苯(Mr=120) | 无色液体 | -44.8 | 164.7 | 难溶于水、酸、碱 |
| 2,4,6-三甲基苯甲酸(Mr=164) | 白色固体 | 155 | 296 | 微溶于冷水,能溶于热水,易溶于碱 |
| 六甲基二苯甲酮 | 白色粉末 | 136 | 340 | 难溶于水、酸、碱 |
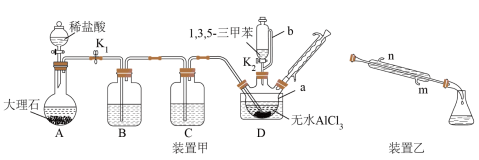
①在装置甲仪器a中加入8.0g无水AlCl3、20mL1,3,5-三甲苯,并控制温度40℃。
②打开分液漏斗活塞和K1,通入过量干燥纯净的CO2气体,加热D回流20~30min。
③关闭分液漏斗活塞和K1.取下球形冷凝管,接装置乙加热蒸馏,回收未反应完的1,3,5-三甲苯。
④将仪器a中的混合物倒入NaOH溶液中,调节pH至8~9,过滤。
⑤向滤液中加入稀盐酸调节pH=2,过滤、洗涤干燥,再将粗品进行纯化,得到19.0g白色固体。
回答下列问题:
(1)仪器b的名称为
(2)为获得干燥纯净的CO2气体,装置B、C中所盛试剂分别为
(3)装置乙中,冷凝水的进水口为
(4)步骤④中过滤得到的沉淀中包含Al(OH)3和六甲基二苯甲酮,从该沉淀中获得六甲基二苯甲酮的实验方法为
(5)①2,4,6-三甲基苯甲酸、②苯甲酸、③2,4,6-三氟苯甲酸,三种酸的酸性由强到弱的顺序为
(6)本实验的产率为
您最近一年使用:0次
昨日更新
|
58次组卷
|
2卷引用:湖南省邵阳市第二中学2024届下学期5月模拟考试(三模)化学试题
名校
解题方法
5 . 锑白 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: ;
;
②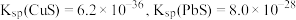 。
。
回答下列问题:
(1)“粉碎”辉锑矿的目的是___________ 。
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、___________ (填化学式); 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为___________ 。
(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为___________ (P转化为最高价态)。
(4)若浸取液中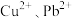 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥___________  才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时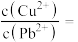
___________ 。
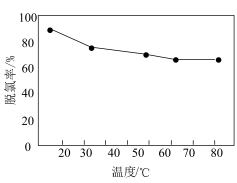
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:___________ 。
(6)锑可用于制备超亮光电极材料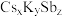 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为___________ ,晶体b中与 距离最近的
距离最近的 的个数为
的个数为___________ 。
 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的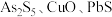 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: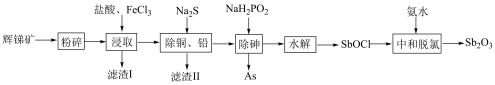
 ;
;②
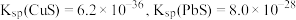 。
。回答下列问题:
(1)“粉碎”辉锑矿的目的是
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为
(4)若浸取液中
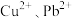 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥ 才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时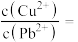
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:
(6)锑可用于制备超亮光电极材料
 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为 距离最近的
距离最近的 的个数为
的个数为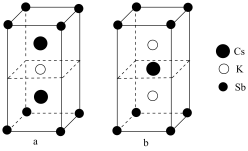
您最近一年使用:0次
解题方法
6 . 活性 在橡胶、光学、化工及电子等行业中有重要应用。某工厂以铅锌烟气(主要成分为
在橡胶、光学、化工及电子等行业中有重要应用。某工厂以铅锌烟气(主要成分为 、
、 ,兼有少量
,兼有少量 、
、 )制备活性
)制备活性 的工艺流程如下:
的工艺流程如下:
(1)基态Zn原子的核外电子排布式为___________ 。
(2)为提高“酸浸”速率,可采取的措施___________ (写出一点即可)。
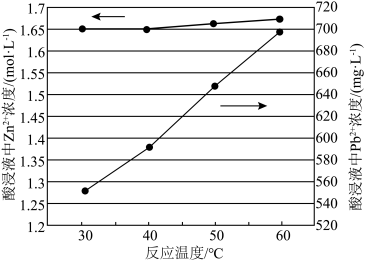
(3)“酸浸”时当浸出液pH为3.93时,温度与Zn、Pb元素浸出率的影响如图所示,则“酸浸”时采用30℃而不用更高温度的原因是___________ 。 溶液充分反应后过滤,滤渣Ⅰ中有
溶液充分反应后过滤,滤渣Ⅰ中有 ,该步反应的离子方程式为
,该步反应的离子方程式为___________ 。
(5)“还原”时,滤渣Ⅱ的主要成分为Pb、Cu,最适宜使用的试剂X是___________ (填化学式)。
(6)在“沉锌”中生成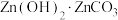 沉淀的化学方程式为
沉淀的化学方程式为___________ 。
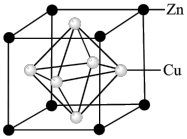
(7)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的立方晶胞结构如图,晶胞参数为a pm。___________ 个。
②该铜锌合金晶体密度为___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 在橡胶、光学、化工及电子等行业中有重要应用。某工厂以铅锌烟气(主要成分为
在橡胶、光学、化工及电子等行业中有重要应用。某工厂以铅锌烟气(主要成分为 、
、 ,兼有少量
,兼有少量 、
、 )制备活性
)制备活性 的工艺流程如下:
的工艺流程如下: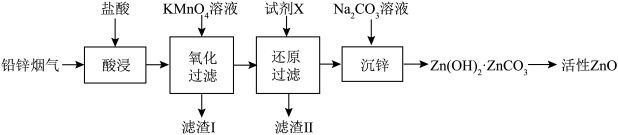
(1)基态Zn原子的核外电子排布式为
(2)为提高“酸浸”速率,可采取的措施
(3)“酸浸”时当浸出液pH为3.93时,温度与Zn、Pb元素浸出率的影响如图所示,则“酸浸”时采用30℃而不用更高温度的原因是
 溶液充分反应后过滤,滤渣Ⅰ中有
溶液充分反应后过滤,滤渣Ⅰ中有 ,该步反应的离子方程式为
,该步反应的离子方程式为(5)“还原”时,滤渣Ⅱ的主要成分为Pb、Cu,最适宜使用的试剂X是
(6)在“沉锌”中生成
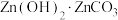 沉淀的化学方程式为
沉淀的化学方程式为(7)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的立方晶胞结构如图,晶胞参数为a pm。
②该铜锌合金晶体密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
7 . 一种回收锌电解阳极泥(生要成分为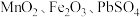 和
和 ,还有少量猛铅氧化物
,还有少量猛铅氧化物 和
和 )中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题: 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。
② 时,
时,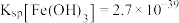
③在较高温度及酸性催化条件下,葡萄糖能发生如下反应: 的最外层电子的电子排布式为
的最外层电子的电子排布式为_______ 。
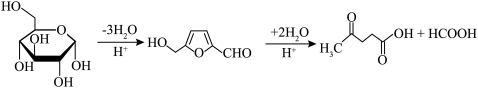
(2)“还原酸浸”过程中主要反应的化学方程式为_______ ;实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是_______ 。
(3)结合 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是_______ ,用_______ (填物质的名称)洗涤、干澡。 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成
,在阴极放电生成 单质,有利于
单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为_______ 。
(5)整个流程中可循环利用的物质是_______ 。
(6)取“沉铁”操作所得的沉淀物置于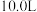 水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有
水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有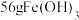 ,最终所得溶液中
,最终所得溶液中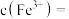
_______  。
。
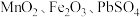 和
和 ,还有少量猛铅氧化物
,还有少量猛铅氧化物 和
和 )中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题: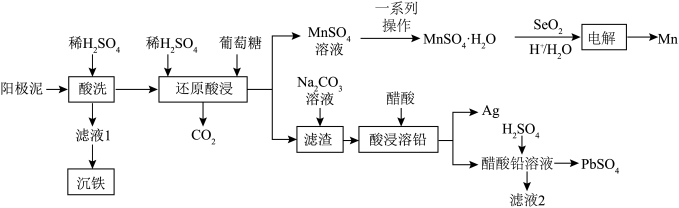
 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。②
 时,
时,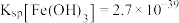
③在较高温度及酸性催化条件下,葡萄糖能发生如下反应:
 的最外层电子的电子排布式为
的最外层电子的电子排布式为(2)“还原酸浸”过程中主要反应的化学方程式为
(3)结合
 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是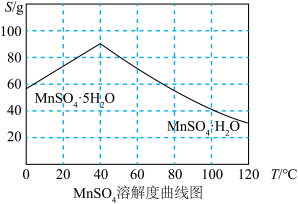
 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成
,在阴极放电生成 单质,有利于
单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为(5)整个流程中可循环利用的物质是
(6)取“沉铁”操作所得的沉淀物置于
 水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有
水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有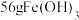 ,最终所得溶液中
,最终所得溶液中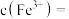
 。
。
您最近一年使用:0次
8 . 镍、钴及其化合物在工业上有广泛的应用。以含镍废料(主要成分为NiO,含少量FeO、 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备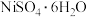 和
和 的工艺流程如下。
的工艺流程如下。
(1)基态Co原子的价层电子的轨道表示式为___________ 。
(2)“滤渣Ⅰ”主要成分是___________ (填化学式)。
(3)“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为___________ 。
(4)“萃取”时需充分振荡,目的是___________ 。“萃取”和“反萃取”可简单表示为: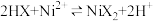 。在萃取过程中加入适量氨水,其作用是
。在萃取过程中加入适量氨水,其作用是___________ 。“反萃取”需要往有机层中加___________ (填试剂名称)。
(5)常温下,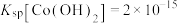 ,若起始时
,若起始时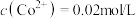 ,“沉钴”过程中应控制pH<
,“沉钴”过程中应控制pH<___________ 。
(6) 在空气中能受热分解,测得剩余固体的质量与起始
在空气中能受热分解,测得剩余固体的质量与起始 的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。 固体置于热解装置中,通入空气流,在
固体置于热解装置中,通入空气流,在___________ ℃(填范围)煅烧至恒重即可得到 。由
。由 制备
制备 总的反应方程式为
总的反应方程式为___________ 。
 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备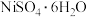 和
和 的工艺流程如下。
的工艺流程如下。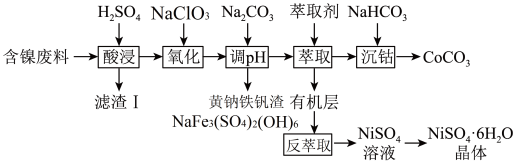
(1)基态Co原子的价层电子的轨道表示式为
(2)“滤渣Ⅰ”主要成分是
(3)“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为
(4)“萃取”时需充分振荡,目的是
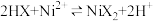 。在萃取过程中加入适量氨水,其作用是
。在萃取过程中加入适量氨水,其作用是(5)常温下,
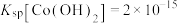 ,若起始时
,若起始时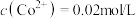 ,“沉钴”过程中应控制pH<
,“沉钴”过程中应控制pH<(6)
 在空气中能受热分解,测得剩余固体的质量与起始
在空气中能受热分解,测得剩余固体的质量与起始 的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。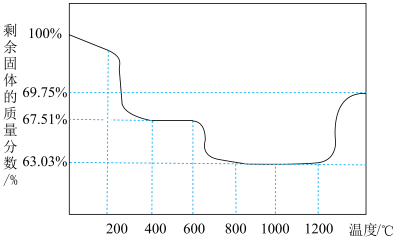
 固体置于热解装置中,通入空气流,在
固体置于热解装置中,通入空气流,在 。由
。由 制备
制备 总的反应方程式为
总的反应方程式为
您最近一年使用:0次
解题方法
9 . 实验室制备丙炔酸甲酯(CH≡C—COOCH₃,沸点为103~105℃)的流程如下图所示,下列说法正确的是
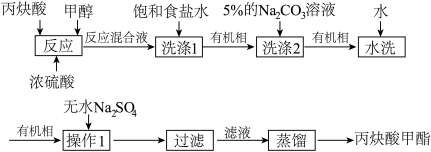
| A.“蒸馏”时可用水浴加热 |
| B.“操作1”名称为洗涤 |
| C.“洗涤2”中5% Na₂CO₃溶液的作用是除去丙炔酸等酸性物质 |
| D.“反应”前加入试剂的顺序为浓硫酸、丙炔酸、甲醇 |
您最近一年使用:0次
解题方法
10 . 室温下,工业上用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示,下列说法正确的是
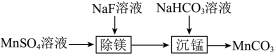
| A.“除镁”步骤中,进行过滤操作需要用到的玻璃仪器仅有漏斗和烧杯 |
| B.“除镁”步骤中,所用的NaF溶液为强电解质 |
C.“沉锰"步骤中的离子方程式为2 +Mn2+=MnCO3↓+H2O+CO2↑ +Mn2+=MnCO3↓+H2O+CO2↑ |
D.“沉锰”后的滤液中: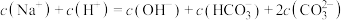 |
您最近一年使用:0次



