解题方法
1 . 铜(Ⅱ)氨基酸配合物在医药、食品、农业等领域具有广泛的应用,甘氨酸( ,以HL代表甘氨酸)在约70℃的条件下可与氢氧化铜反应制备二甘氨酸合铜(Ⅱ)水合物,其反应的化学方程式为
,以HL代表甘氨酸)在约70℃的条件下可与氢氧化铜反应制备二甘氨酸合铜(Ⅱ)水合物,其反应的化学方程式为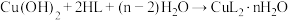 。
。
Ⅰ.氢氧化铜的制备
①向烧杯中加入适量 和20mL水。
和20mL水。
②完全溶解后,边滴加氨水边搅拌至最初产生的沉淀完全溶解。
③加入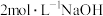 溶液至不再生成沉淀,过滤,用水洗涤。
溶液至不再生成沉淀,过滤,用水洗涤。
(1)步骤②沉淀溶解过程中反应的离子方程式为___________ 。
(2)步骤③中检验沉淀洗涤干净的操作及现象为___________ 。
Ⅱ.二甘氨酸合铜(Ⅱ)水合物的制备
④称取适量甘氨酸,溶于150mL水中。
⑤在65~70℃的条件下加热,边搅拌边加入新制的 ,至
,至 全部溶解。
全部溶解。
⑥热抽滤,向滤液加入10mL无水乙醇。
⑦抽滤,用乙醇溶液洗涤晶体,再用丙酮洗涤,抽干。
⑧将产品烘干。
(3)步骤④中使用的部分仪器如下。仪器a的名称是___________ 。加快甘氨酸溶解的操作为___________ 。___________ 。
(5)步骤⑦中用乙醇溶液洗涤晶体后再用丙酮洗涤的原因为___________ 。
Ⅲ.产品中铜含量的测定
称取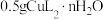 产品,加入水和稀硫酸溶解,配制成250mL溶液。取20.00mL该溶液,加入足量KI固体和50mL水,以淀粉为指示剂,立即用
产品,加入水和稀硫酸溶解,配制成250mL溶液。取20.00mL该溶液,加入足量KI固体和50mL水,以淀粉为指示剂,立即用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液1.60mL。
溶液1.60mL。
已知:在酸性介质中,配合物中的 被质子化,配合物被破坏;
被质子化,配合物被破坏;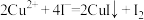 ,
, 。
。
(6)滴定终点溶液颜色的变化为___________ 。
(7)产品中铜元素的质量分数为___________ 。
 ,以HL代表甘氨酸)在约70℃的条件下可与氢氧化铜反应制备二甘氨酸合铜(Ⅱ)水合物,其反应的化学方程式为
,以HL代表甘氨酸)在约70℃的条件下可与氢氧化铜反应制备二甘氨酸合铜(Ⅱ)水合物,其反应的化学方程式为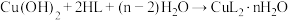 。
。Ⅰ.氢氧化铜的制备
①向烧杯中加入适量
 和20mL水。
和20mL水。②完全溶解后,边滴加氨水边搅拌至最初产生的沉淀完全溶解。
③加入
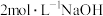 溶液至不再生成沉淀,过滤,用水洗涤。
溶液至不再生成沉淀,过滤,用水洗涤。(1)步骤②沉淀溶解过程中反应的离子方程式为
(2)步骤③中检验沉淀洗涤干净的操作及现象为
Ⅱ.二甘氨酸合铜(Ⅱ)水合物的制备
④称取适量甘氨酸,溶于150mL水中。
⑤在65~70℃的条件下加热,边搅拌边加入新制的
 ,至
,至 全部溶解。
全部溶解。⑥热抽滤,向滤液加入10mL无水乙醇。
⑦抽滤,用乙醇溶液洗涤晶体,再用丙酮洗涤,抽干。
⑧将产品烘干。
(3)步骤④中使用的部分仪器如下。仪器a的名称是
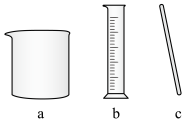
(5)步骤⑦中用乙醇溶液洗涤晶体后再用丙酮洗涤的原因为
Ⅲ.产品中铜含量的测定
称取
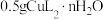 产品,加入水和稀硫酸溶解,配制成250mL溶液。取20.00mL该溶液,加入足量KI固体和50mL水,以淀粉为指示剂,立即用
产品,加入水和稀硫酸溶解,配制成250mL溶液。取20.00mL该溶液,加入足量KI固体和50mL水,以淀粉为指示剂,立即用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液1.60mL。
溶液1.60mL。已知:在酸性介质中,配合物中的
 被质子化,配合物被破坏;
被质子化,配合物被破坏;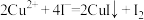 ,
, 。
。(6)滴定终点溶液颜色的变化为
(7)产品中铜元素的质量分数为
您最近一年使用:0次
解题方法
2 . 三草酸合铁(Ⅲ)酸钾{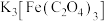 }常用来作为化学光量计、催化剂等,一种合成路线如图所示,已知:三草酸合铁酸钾晶体易溶于水(溶解度:
}常用来作为化学光量计、催化剂等,一种合成路线如图所示,已知:三草酸合铁酸钾晶体易溶于水(溶解度: ,
, ;
; ,
, ),难溶于乙醇,
),难溶于乙醇, 下可失去全部结晶水,
下可失去全部结晶水, 时分解,它具有光敏性,受光照射分解变为黄色,下列叙述正确的是
时分解,它具有光敏性,受光照射分解变为黄色,下列叙述正确的是
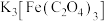 }常用来作为化学光量计、催化剂等,一种合成路线如图所示,已知:三草酸合铁酸钾晶体易溶于水(溶解度:
}常用来作为化学光量计、催化剂等,一种合成路线如图所示,已知:三草酸合铁酸钾晶体易溶于水(溶解度: ,
, ;
; ,
, ),难溶于乙醇,
),难溶于乙醇, 下可失去全部结晶水,
下可失去全部结晶水, 时分解,它具有光敏性,受光照射分解变为黄色,下列叙述正确的是
时分解,它具有光敏性,受光照射分解变为黄色,下列叙述正确的是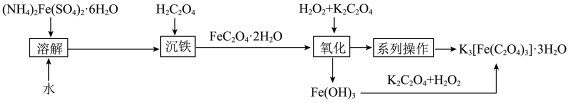
A.“沉铁”中,滤液主要成分是 |
| B.“系列操作”是过滤、乙醇洗涤、干燥 |
| C.向产品的饱和溶液中加入乙醇,有利于析出产品 |
| D.产品贮存于透明带软木塞的试剂瓶中 |
您最近一年使用:0次
解题方法
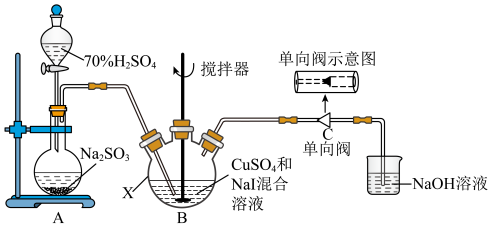
3 . 碘化亚铜(CuI)可用作有机合成催化剂,是一种白色粉末,不溶于水,在空气中相对稳定。实验室制备碘化亚铜的装置如图(部分夹持及加热装置已略去):
I.取50.0g 、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
Ⅱ.打开分液漏斗,将A中产生的 通向B中的黄色沉淀,充分反应后得到白色沉淀;
通向B中的黄色沉淀,充分反应后得到白色沉淀;
Ⅲ.将分离出的白色沉淀经过“系列操作”得到19.1g产品;
Ⅳ.测定产品中CuI的纯度。
回答下列问题:
(1)在使用分液漏斗组装发生装置之前,必需进行的操作是___________ 。仪器X的名称是___________ 。
(2)已知步骤I中的黄色沉淀含CuI和一种单质,制备CuI的化学方程式为___________ 。
(3)步骤Ⅱ通入 的主要目的是
的主要目的是___________ 。写出通入 所发生的离子反应方程式
所发生的离子反应方程式___________ 。
(4)下图中能起到与单向阀C相同作用的是___________ (填字母)。(下图容器中未标注的液体均为氢氧化钠溶液) 浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为
浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为 并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为
并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为___________ %,据此推算CuI的产率接近于___________ (填字母)。
I.取50.0g
 、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;Ⅱ.打开分液漏斗,将A中产生的
 通向B中的黄色沉淀,充分反应后得到白色沉淀;
通向B中的黄色沉淀,充分反应后得到白色沉淀;Ⅲ.将分离出的白色沉淀经过“系列操作”得到19.1g产品;
Ⅳ.测定产品中CuI的纯度。
回答下列问题:
(1)在使用分液漏斗组装发生装置之前,必需进行的操作是
(2)已知步骤I中的黄色沉淀含CuI和一种单质,制备CuI的化学方程式为
(3)步骤Ⅱ通入
 的主要目的是
的主要目的是 所发生的离子反应方程式
所发生的离子反应方程式(4)下图中能起到与单向阀C相同作用的是

 浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为
浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为 并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为
并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为
您最近一年使用:0次
解题方法
4 . 镀锌钢构件的酸洗废液中含有2.5mol。L-1盐酸、50%FeCl2·4H2O和2%ZnCl2。实验室从酸洗废液中回收盐酸和FeCl2·4H2O的实验流程如下:
回答下列问题:
I.回收盐酸和FeCl2·4H2O粗产品
(1)操作1应选择___________ (填序号)。
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl2·4H2O粗产品,应加热至留有少量残余液时立即停止。
①立即停止可以避免Fe2+被氧化外,还能___________ 。
②如果残余液过多,可能会导致___________ 。(答一条)
Ⅱ.FeCl2·4H2O粗产品的重结晶
(3)检验FeCl2·4H2O粗产品中含有Fe3+的操作方法是___________ 。
(4)重结晶前加入的物质X为___________ ;操作2的名称是___________ 。
Ⅲ.滴定亚铁离子,测定FeCl2·4H2O晶体纯度
准确称取ag重结晶后的FeCl2·4H2O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指示剂,用cmol。L-1K2Cr2O7标准溶液滴定至终点,半分钟内不恢复原色,消耗K2Cr2O7标准溶液平均体积为VmL(此时Cl-不被氧化)。(M【FeCl2·4H2O】=199 g·mol-1)
(5)计算FeCl2·4H2O晶体的纯度为___________ %(用含a、c的最简代数式表示)。
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。___________ 。
②亚甲基蓝中N原子的杂化方式有___________ 。
③DMA的碱性比苯胺强,说明理由___________ 。
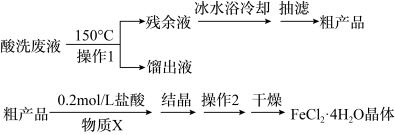
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| FeCl2 | 49.7 | 59.0 | 62.5 | 66.7 | 70.0 | 78.3 | 88.7 | 94.9 |
| ZnCl2 | 342 | 363 | 395 | 437 | 452 | 488 | 541 | 614 |
I.回收盐酸和FeCl2·4H2O粗产品
(1)操作1应选择
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl2·4H2O粗产品,应加热至留有少量残余液时立即停止。
①立即停止可以避免Fe2+被氧化外,还能
②如果残余液过多,可能会导致
Ⅱ.FeCl2·4H2O粗产品的重结晶
(3)检验FeCl2·4H2O粗产品中含有Fe3+的操作方法是
(4)重结晶前加入的物质X为
Ⅲ.滴定亚铁离子,测定FeCl2·4H2O晶体纯度
准确称取ag重结晶后的FeCl2·4H2O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指示剂,用cmol。L-1K2Cr2O7标准溶液滴定至终点,半分钟内不恢复原色,消耗K2Cr2O7标准溶液平均体积为VmL(此时Cl-不被氧化)。(M【FeCl2·4H2O】=199 g·mol-1)
(5)计算FeCl2·4H2O晶体的纯度为
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。

②亚甲基蓝中N原子的杂化方式有
③DMA的碱性比苯胺强,说明理由
您最近一年使用:0次
名校
解题方法
5 . 实验室由安息香( ,
, )在热
)在热 的氧化下制备二苯乙二酮(
的氧化下制备二苯乙二酮( ,
,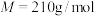 )
)
| 物质 | 性状 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 安息香 | 白色固体 | 133 | 344 | 难溶于冷水,溶于热水、乙醇、乙酸 |
| 二苯乙二酮 | 淡黄色固体 | 95 | 347 | 不溶于水,溶于乙醇、苯、乙酸 |
| 冰乙酸 | 无色液体 | 17 | 118 | 与水、乙醇互溶 |

①在圆底烧瓶中加入20mL冰乙酸、10mL水及
 ,边搅拌边加热,至固体全部溶解。
,边搅拌边加热,至固体全部溶解。②停止加热,待沸腾平息后加入4.2g安息香,加热回流1h。
③慢慢加入100mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶3.8g。
回答下列问题:
(1)仪器B的名称是
(2)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是
(3)写出圆底烧瓶中发生的主要反应的化学方程式:
(4)本实验中,若采用催化剂量的
 并通入空气进行实验,能否达到目的?
并通入空气进行实验,能否达到目的?(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是
(6)若粗品中混有少量未氧化的安息香,可用少量
a.热水 b.乙酸 c.冷水 d.乙醇
(7)本实验的产率为
您最近一年使用:0次
解题方法
6 . 以辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)和软锰矿(主要成分为MnO2)为原料制备超细氧化铋的工艺流程如下: ,
, 易发生水解,其反应的离子方程式为:
易发生水解,其反应的离子方程式为: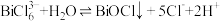 。
。
(1)Bi元素位于第6周期VA族,其价电子轨道表示式为___________ ,BiOCl叫氯氧化铋而不叫次氯酸铋,从化合价角度分析原因为___________ 。
(2)“联合焙烧”时,Bi2S3和MnO2在空气中反应生成Bi2O3和MnSO4.该反应的化学方程式为___________ 。
(3)BiCl 能被有机萃取剂(TBP)苯取,其萃取原理可表示为:
能被有机萃取剂(TBP)苯取,其萃取原理可表示为: 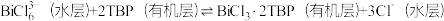 。
。
①“萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图所示。c(Cl-)最佳为1.3mol·L-1的可能原因是___________ 。
②萃取后分液所得水相中的主要阳离子为___________ (填化学式)。___________ 。
(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3·7H2O的质量的比值随温度变化的关系如图所示。400℃时制得超细氧化铋,其化学式为___________ 。(M[Bi2(C2O4)3·7H2O]=808g·mol-1)

 ,
, 易发生水解,其反应的离子方程式为:
易发生水解,其反应的离子方程式为: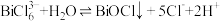 。
。(1)Bi元素位于第6周期VA族,其价电子轨道表示式为
(2)“联合焙烧”时,Bi2S3和MnO2在空气中反应生成Bi2O3和MnSO4.该反应的化学方程式为
(3)BiCl
 能被有机萃取剂(TBP)苯取,其萃取原理可表示为:
能被有机萃取剂(TBP)苯取,其萃取原理可表示为: 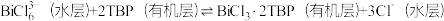 。
。①“萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图所示。c(Cl-)最佳为1.3mol·L-1的可能原因是
②萃取后分液所得水相中的主要阳离子为

(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3·7H2O的质量的比值随温度变化的关系如图所示。400℃时制得超细氧化铋,其化学式为

您最近一年使用:0次
名校
7 . 锡在材料、医药、化工等方面有广泛的应用,锡精矿(SnO2)中主要有Fe、S、As、Sb、Pb等杂质元素。下图为锡的冶炼工艺流程:
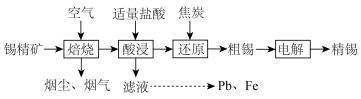
| A.焙烧产生的烟尘、烟气中主要杂质元素是S、As、Sb |
B.酸浸时,PbO生成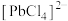 ,为了提高铅的浸出率,可添加适量NaCl固体 ,为了提高铅的浸出率,可添加适量NaCl固体 |
C.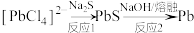 的反应2中S元素化合价全部升高 的反应2中S元素化合价全部升高 |
| D.电解精炼时,电源的正极与粗锡相连 |
您最近一年使用:0次
2024-06-06更新
|
67次组卷
|
2卷引用:湖南省天壹名校联盟2024届高三下学期4月大联考化学试题
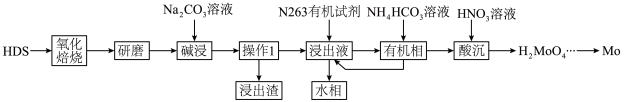
8 . HDS废催化剂是石油精炼加工产生的废弃物,但富含Mo、Ni等元素,是重要的二次资源。一种从HDS中回收Mo的工艺流程如图所示。 、
、 、
、 ;
;
②“浸出渣”的成分为 、
、 ;
;
③常温下, 易溶于水。
易溶于水。
(1)钼酸镍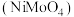 中
中 元素的化合价为
元素的化合价为_____ 价。
(2)“操作1”为_____ ,在化学实验室中“操作1”用到的玻璃仪器有烧杯、_____ 和_____ 。
(3)结合下图,碱浸时选择的 最佳添加量为
最佳添加量为_____ wt%,最佳浸出温度为_____ ℃。 在碱浸时有
在碱浸时有 和
和 生成,该反应化学方程式为
生成,该反应化学方程式为_____ 。
(5)采用碳酸根类型的N263萃取钼的反应为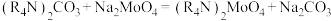 。已知一些离子被
。已知一些离子被 萃取的先后顺序为
萃取的先后顺序为 ,则加入
,则加入 反萃取发生反应的离子方程式为
反萃取发生反应的离子方程式为_____ 。萃取后有机相为 型,加入
型,加入 处理后可实现萃取剂再生。
处理后可实现萃取剂再生。
(6)在实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示为_____ (填标号)。_____ 和_____ 。
 、
、 、
、 ;
;②“浸出渣”的成分为
 、
、 ;
;③常温下,
 易溶于水。
易溶于水。(1)钼酸镍
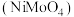 中
中 元素的化合价为
元素的化合价为(2)“操作1”为
(3)结合下图,碱浸时选择的
 最佳添加量为
最佳添加量为
 在碱浸时有
在碱浸时有 和
和 生成,该反应化学方程式为
生成,该反应化学方程式为(5)采用碳酸根类型的N263萃取钼的反应为
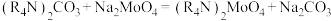 。已知一些离子被
。已知一些离子被 萃取的先后顺序为
萃取的先后顺序为 ,则加入
,则加入 反萃取发生反应的离子方程式为
反萃取发生反应的离子方程式为 型,加入
型,加入 处理后可实现萃取剂再生。
处理后可实现萃取剂再生。(6)在实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示为
您最近一年使用:0次
2024-06-06更新
|
29次组卷
|
2卷引用:2024届安徽省名校教研联盟高三下学期3月月考化学试卷
名校
解题方法
9 . 氯苯是染料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯如图所示(加热和固定仪器的装置略去)。
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a仪器中的固体反应物可以是_______ (填序号)。
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d仪器中有FeCl3和苯),加热维持反应温度为40~60 ℃,温度过高会生成过多的二氯苯。对d加热的方法是_______ 。
(3)仪器b的名称是_______ ,仪器c中冷凝水从_______ 进(填“上口”或“下口”),仪器c出口的气体成分是HCl、Cl2、水蒸气和_______ 。
(4)制取氯苯的化学方程式为_______ 。
(5)仪器d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。
①碱洗之前要进行水洗,其目的是_______ 。
②10% NaOH溶液碱洗时发生氧化还原反应的离子反应方程式为_______ 。
(6)工业生产中苯的流失情况如表所示:
则10 t苯可制得成品氯苯_______ t。(列出计算式即可。氯苯和苯的相对分子质量分别是112.5和78)
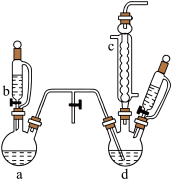
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a仪器中的固体反应物可以是
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d仪器中有FeCl3和苯),加热维持反应温度为40~60 ℃,温度过高会生成过多的二氯苯。对d加热的方法是
(3)仪器b的名称是
(4)制取氯苯的化学方程式为
(5)仪器d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。
①碱洗之前要进行水洗,其目的是
②10% NaOH溶液碱洗时发生氧化还原反应的离子反应方程式为
(6)工业生产中苯的流失情况如表所示:
| 项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
| 苯流失量/(kg·t-1) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
您最近一年使用:0次
解题方法
10 . 镍主要用于合金及用作催化剂,也可用来制造货币等。以镍废渣(主要成分为 ,还含有
,还含有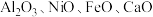 和
和 为原料制备纯镍的流程如图,回答下列问题:
为原料制备纯镍的流程如图,回答下列问题:_____________ (填化学式):常温下,“酸浸”中硫酸浓度与镍浸出率的关系如图所示,硫酸浓度大于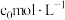 后,镍浸出率降低的可能原因是
后,镍浸出率降低的可能原因是_____________ 。_________________________________________________ (用离子方程式表示)。
(3)请设计实验确认“氧化”过程中的杂质离子已经被完全转化_____________________________________ 。
(4)“沉铝”时 的作用是
的作用是_________________ ,“操作 ”包括蒸发浓缩、
”包括蒸发浓缩、_____________ 、过滤、洗涤。
 ,还含有
,还含有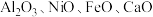 和
和 为原料制备纯镍的流程如图,回答下列问题:
为原料制备纯镍的流程如图,回答下列问题: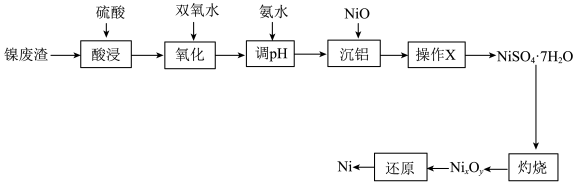
 后,镍浸出率降低的可能原因是
后,镍浸出率降低的可能原因是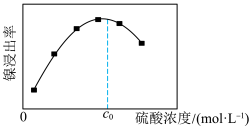
(3)请设计实验确认“氧化”过程中的杂质离子已经被完全转化
(4)“沉铝”时
 的作用是
的作用是 ”包括蒸发浓缩、
”包括蒸发浓缩、
您最近一年使用:0次



