名校
解题方法
1 . 四氯化碳( )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
① 与溴水反应生成硫酸和氢溴酸等,可用溴水吸收
与溴水反应生成硫酸和氢溴酸等,可用溴水吸收 ;
;
② 与
与 在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
③硫单质的沸点445℃, 的沸点46.5℃,
的沸点46.5℃, 沸点76.8℃、密度1.6
沸点76.8℃、密度1.6 。
。
回答下列问题:
(1)装置A中仪器a的名称是___________ ,用浓盐酸与 反应制取
反应制取 ,发生反应的离子方程式为
,发生反应的离子方程式为____________ (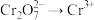 )。
)。
(2)装置的连接顺序为___________ 。
A→_______→________→_______→_____→E。
(3)为使冷凝效果较好,应选用的冷凝管为_______ (填编号);装置C中冷凝管的作用是____________ ,冷水从_________ 口通入。 、
、 ,此时装置F的作用为
,此时装置F的作用为_________________ 。
(5)反应一段时间后,装置C中出现淡黄色固体,写出装置C中发生反应的化学方程式:_________ 。
(6)装置C中反应结束后,先过滤除去固体_________ (填名称),再经过_________ (填操作名称)可得到 。
。
 )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。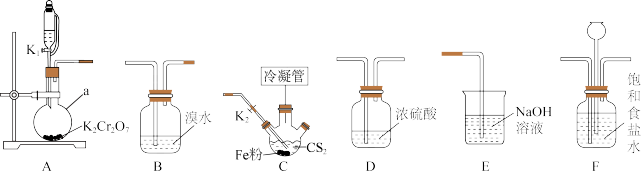
①
 与溴水反应生成硫酸和氢溴酸等,可用溴水吸收
与溴水反应生成硫酸和氢溴酸等,可用溴水吸收 ;
;②
 与
与 在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;③硫单质的沸点445℃,
 的沸点46.5℃,
的沸点46.5℃, 沸点76.8℃、密度1.6
沸点76.8℃、密度1.6 。
。回答下列问题:
(1)装置A中仪器a的名称是
 反应制取
反应制取 ,发生反应的离子方程式为
,发生反应的离子方程式为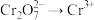 )。
)。(2)装置的连接顺序为
A→_______→________→_______→_____→E。
(3)为使冷凝效果较好,应选用的冷凝管为

 、
、 ,此时装置F的作用为
,此时装置F的作用为(5)反应一段时间后,装置C中出现淡黄色固体,写出装置C中发生反应的化学方程式:
(6)装置C中反应结束后,先过滤除去固体
 。
。
您最近一年使用:0次
2024-06-06更新
|
72次组卷
|
2卷引用:2024届山西省大同市第一中学校高三下学期高考临门一脚(一)理综试卷-高中化学
2 . 碘化亚铜(CuI)是一种难溶于水的白色固体,能被O2氧化。
(1)一种碘化亚铜薄膜透光性高、电阻率低,常用于LED等光电子器件中。其简要制备方法:真空中,在硅衬底镀一层铜膜,然后碘蒸汽与铜膜反应得碘化亚铜薄膜。
①在真空中镀铜膜目的是___________ 。
②实验测得不同铜碘比发生反应得到的CuI薄膜在不同波长下的透光率如图所示。合适的铜碘比为___________ 。___________ 。其他条件不变,溶液中铜元素的质量随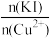 变化情况如图所示,当
变化情况如图所示,当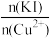 >2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
>2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是___________ 。 溶液洗涤沉淀的目的是
溶液洗涤沉淀的目的是___________ 。
(3)硫酸铜为原料制备碘化亚铜。
补充完整制取碘化亚铜的实验方案:取25 mL 0.4mol·L−1 CuSO4溶液于三颈烧瓶中,___________ 。(实验中须使用的试剂和仪器有:SO2、I2、0.1 mol·L−1 NaOH、乙醇、真空干燥箱)。
(4)已知荧光强度比值与Cu2+浓度关系如图所示。取0.0001 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为___________ (保留一位小数)。
(1)一种碘化亚铜薄膜透光性高、电阻率低,常用于LED等光电子器件中。其简要制备方法:真空中,在硅衬底镀一层铜膜,然后碘蒸汽与铜膜反应得碘化亚铜薄膜。
①在真空中镀铜膜目的是
②实验测得不同铜碘比发生反应得到的CuI薄膜在不同波长下的透光率如图所示。合适的铜碘比为
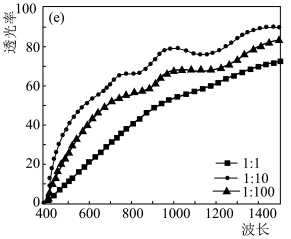

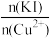 变化情况如图所示,当
变化情况如图所示,当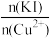 >2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
>2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是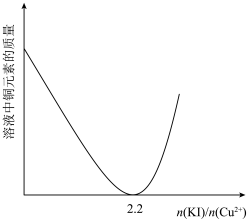
 溶液洗涤沉淀的目的是
溶液洗涤沉淀的目的是(3)硫酸铜为原料制备碘化亚铜。
补充完整制取碘化亚铜的实验方案:取25 mL 0.4mol·L−1 CuSO4溶液于三颈烧瓶中,
(4)已知荧光强度比值与Cu2+浓度关系如图所示。取0.0001 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为

您最近一年使用:0次
名校
3 . “分铜液净化渣”主要含铜、碲(Te)、锑(Sb)、砷(As)等元素的化合物,回收工艺流程如图所示。 含有
含有 、
、 。
。
②“酸浸”时,浸渣中含锑元素生成难溶 ;
; 极易水解。
极易水解。
③常温下, 的各级电离常数为
的各级电离常数为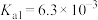 、
、 、
、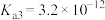 。
。
下列说法不正确的是

 含有
含有 、
、 。
。②“酸浸”时,浸渣中含锑元素生成难溶
 ;
; 极易水解。
极易水解。③常温下,
 的各级电离常数为
的各级电离常数为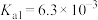 、
、 、
、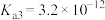 。
。下列说法不正确的是
A.“碱浸”时, 与 与 反应的离子方程式为 反应的离子方程式为 |
B.滤液 中 中 元素主要存在形式为 元素主要存在形式为 |
C.“氯盐酸浸”时, 的作用是作还原剂并防水解 的作用是作还原剂并防水解 |
D.“水解”时,生成 的化学方程式为 的化学方程式为 |
您最近一年使用:0次
名校
4 . 某废旧金属材料中主要含 、
、 、
、 、
、 、
、 、
、 、
、 和可燃性有机物,现利用下列工艺流程回收部分金属及金属化合物:
和可燃性有机物,现利用下列工艺流程回收部分金属及金属化合物: 。
。
回答下列问题:
(1)“焙烧”的目的是将金属单质转化为氧化物,并除去_______ 。
(2) 的电子式为
的电子式为_________ ,“碱浸”时发生反应的离子方程式为______ 。
(3)“操作Ⅰ”的名称为________ 。
(4)试剂a为_______ (填化学式),加入试剂a后可能发生的反应为______ (写出其中1个反应的离子方程式即可)。
(5)滤液Ⅱ中可能含有因氧气的作用而产生的少量______ (填离子符号),检验该离子的操作是______ 。
 、
、 、
、 、
、 、
、 、
、 、
、 和可燃性有机物,现利用下列工艺流程回收部分金属及金属化合物:
和可燃性有机物,现利用下列工艺流程回收部分金属及金属化合物: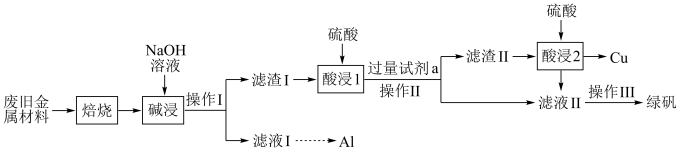
 。
。回答下列问题:
(1)“焙烧”的目的是将金属单质转化为氧化物,并除去
(2)
 的电子式为
的电子式为(3)“操作Ⅰ”的名称为
(4)试剂a为
(5)滤液Ⅱ中可能含有因氧气的作用而产生的少量
您最近一年使用:0次
解题方法
5 . 某工厂废水中含有大量的FeSO4和较多的CuSO4。为制备晶体X并检验其部分性质,按如图流程进行相关实验:
②晶体X是一种含结晶水的化合物,制备X时加入的(NH4)2SO4与FeSO4溶液中溶质的物质的量相等。
(1)在制备晶体X的过程中,会使用少量酒精来洗涤晶体。其目的是_______ 。
(2)取少量铜粉加入浓盐酸中加热,铜粉溶解并生成H3[CuCl4],写出化学方程式_______ 。
(3)下列说法不正确 的是_______ (填字母)。
(4)取少量略变黄的绿矾溶于稀硫酸,请设计实验验证溶液中铁元素的存在形式_______ ;写出实验过程中所涉及的反应方程式_______ 。

②晶体X是一种含结晶水的化合物,制备X时加入的(NH4)2SO4与FeSO4溶液中溶质的物质的量相等。
(1)在制备晶体X的过程中,会使用少量酒精来洗涤晶体。其目的是
(2)取少量铜粉加入浓盐酸中加热,铜粉溶解并生成H3[CuCl4],写出化学方程式
(3)下列说法
| A.测得晶体X分子量为392,则其化学式可能为(NH4)2Fe(SO4)2•6H2O |
| B.晶体X中不含Fe3+,故不可以作净水剂和消毒剂 |
| C.晶体X比绿矾稳定的原因是(NH4)2SO4包裹在FeSO4外部,隔绝空气,防止Fe2+被氧化 |
| D.结合流程图信息,测定待测KMnO4溶液浓度时,用晶体X配标准液去滴定比绿矾误差更小 |
(4)取少量略变黄的绿矾溶于稀硫酸,请设计实验验证溶液中铁元素的存在形式
您最近一年使用:0次
6 . 物质的鉴别和除杂是化学学习的重要内容之一,则下列鉴别和除杂的方法错误的是
| A.用熟石灰鉴别尿素和氯化铵 | B.用水鉴别氢氧化钠和氯化钠 |
C.点燃的方法除去 中的CO 中的CO | D.用碳酸钠鉴别氯化钙溶液和稀盐酸 |
您最近一年使用:0次
名校
解题方法
7 . 铈是地壳中最丰富的稀土金属,可用作合金添加剂、医药、制革等。某兴趣小组以二氧化铈( )废渣为原料制备金属铈和
)废渣为原料制备金属铈和 的流程如图所示。
的流程如图所示。
 )废渣为原料制备金属铈和
)废渣为原料制备金属铈和 的流程如图所示。
的流程如图所示。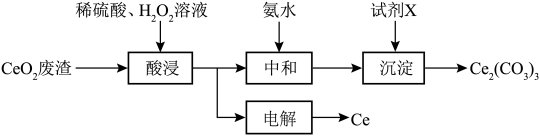
A.“酸浸”时发生的反应为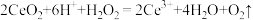 |
| B.“中和”时,加入氨水不宜过量 |
C.“试剂X”可选用 和氨水混合物 和氨水混合物 |
D.“电解”时,阴极上得到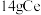 的同时阳极上得到 的同时阳极上得到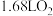 |
您最近一年使用:0次
2024-06-05更新
|
71次组卷
|
2卷引用:重庆市荣昌永荣中学校2024届高三下学期模拟预测化学试题2
名校
解题方法
8 . 以硫酸工业的尾气 为主要原料制备
为主要原料制备 、
、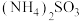 的工艺流程如下图所示:
的工艺流程如下图所示:
(1)反应I的化学方程式为___________ 。
(2)生产过程中,得到滤液时,操作所需的玻璃仪器除烧杯外还有___________ 。
(3)反应Ⅲ所得的 可在反应
可在反应___________ (填“I”、“Ⅱ”或“Ⅳ”)中重复使用,检验滤液中阳离子的操作方法是___________ 。
(4)已知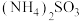 能将氮氧化物转化为无污染性气体(
能将氮氧化物转化为无污染性气体( 不参与氧化还原反应),则
不参与氧化还原反应),则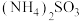 与
与 反应(忽略
反应(忽略 和
和 的转化),还原剂和氧化剂的比值为
的转化),还原剂和氧化剂的比值为___________ ,当生成的无污染性气体体积为 (标准状况),该反应转移的电子数目为
(标准状况),该反应转移的电子数目为___________ 。
(5)将一定比例的氢气和二氧化硫以一定流速通过装有 催化剂的反应容器,反应原理如图所示。结合图中信息写出第2步反应的化学方程式:
催化剂的反应容器,反应原理如图所示。结合图中信息写出第2步反应的化学方程式:___________ 。
 为主要原料制备
为主要原料制备 、
、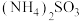 的工艺流程如下图所示:
的工艺流程如下图所示: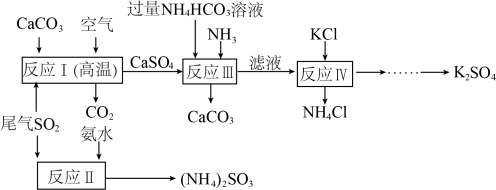
(1)反应I的化学方程式为
(2)生产过程中,得到滤液时,操作所需的玻璃仪器除烧杯外还有
(3)反应Ⅲ所得的
 可在反应
可在反应(4)已知
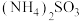 能将氮氧化物转化为无污染性气体(
能将氮氧化物转化为无污染性气体( 不参与氧化还原反应),则
不参与氧化还原反应),则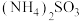 与
与 反应(忽略
反应(忽略 和
和 的转化),还原剂和氧化剂的比值为
的转化),还原剂和氧化剂的比值为 (标准状况),该反应转移的电子数目为
(标准状况),该反应转移的电子数目为(5)将一定比例的氢气和二氧化硫以一定流速通过装有
 催化剂的反应容器,反应原理如图所示。结合图中信息写出第2步反应的化学方程式:
催化剂的反应容器,反应原理如图所示。结合图中信息写出第2步反应的化学方程式: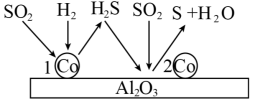
您最近一年使用:0次
名校
9 . 硫化钡(BaS)是一种用于制取含钡化合物和含硫化合物的化工原料。一种以BaS为原料生产氢氧化钡并获得某种副产品X和硫代硫酸钠( )的工艺流程如下:
)的工艺流程如下:
Ⅰ. 是黄色的离子,其化学性质与
是黄色的离子,其化学性质与 类似,具有一定的还原性,在酸性环境下会分解。
类似,具有一定的还原性,在酸性环境下会分解。
Ⅱ. 在碱性环境下稳定,在酸性环境下会分解。
在碱性环境下稳定,在酸性环境下会分解。 在水中溶解度很小。
在水中溶解度很小。
回答下列问题:
(1)制备BaS的方法是在高温下用无烟煤粉(主要成分为C)还原重晶石( ),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为
),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
(2)粗制BaS溶解于温热水中配制成BaS溶液,往其中通入 可发生反应生成
可发生反应生成 和
和 。下图是
。下图是 和
和 的溶解度随温度变化曲线,根据后面的流程推测,图中
的溶解度随温度变化曲线,根据后面的流程推测,图中_______ (填“甲”或“乙”)代表 的溶解度曲线。
的溶解度曲线。 中的x可变,当
中的x可变,当 时,
时, 晶体的晶胞如下:
晶体的晶胞如下: ,则
,则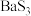 的密度为
的密度为_______  (用含a、b、c、
(用含a、b、c、 的式子表示)。
的式子表示)。
(4) 粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有
粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有_______ (填标号)。
a.NaClO溶液 b.稀 溶液 c.KI溶液
溶液 c.KI溶液
(5)往母液A中加入 溶液可得到副产品X,X的化学式为
溶液可得到副产品X,X的化学式为_______ 。已知温度较低时, 在水中溶解度会迅速减小。在这一步操作中
在水中溶解度会迅速减小。在这一步操作中 的用量一般为略微过量,原因是
的用量一般为略微过量,原因是_______ 。
(6)在碱性条件下往母液B中通入 可将
可将 氧化为
氧化为 ,若
,若 (即用
(即用 表示
表示 ),请写出该反应的离子方程式:
),请写出该反应的离子方程式:_______ 。
 )的工艺流程如下:
)的工艺流程如下: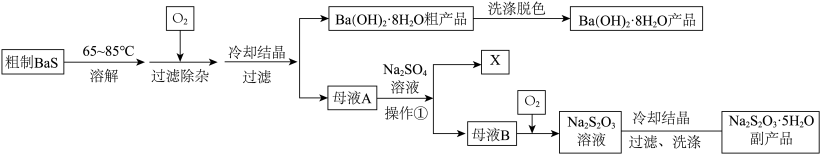
Ⅰ.
 是黄色的离子,其化学性质与
是黄色的离子,其化学性质与 类似,具有一定的还原性,在酸性环境下会分解。
类似,具有一定的还原性,在酸性环境下会分解。Ⅱ.
 在碱性环境下稳定,在酸性环境下会分解。
在碱性环境下稳定,在酸性环境下会分解。 在水中溶解度很小。
在水中溶解度很小。回答下列问题:
(1)制备BaS的方法是在高温下用无烟煤粉(主要成分为C)还原重晶石(
 ),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为
),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(2)粗制BaS溶解于温热水中配制成BaS溶液,往其中通入
 可发生反应生成
可发生反应生成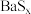 和
和 。下图是
。下图是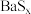 和
和 的溶解度随温度变化曲线,根据后面的流程推测,图中
的溶解度随温度变化曲线,根据后面的流程推测,图中 的溶解度曲线。
的溶解度曲线。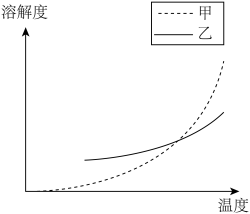
 中的x可变,当
中的x可变,当 时,
时,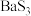 晶体的晶胞如下:
晶体的晶胞如下:
 ,则
,则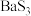 的密度为
的密度为 (用含a、b、c、
(用含a、b、c、 的式子表示)。
的式子表示)。(4)
 粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有
粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有a.NaClO溶液 b.稀
 溶液 c.KI溶液
溶液 c.KI溶液(5)往母液A中加入
 溶液可得到副产品X,X的化学式为
溶液可得到副产品X,X的化学式为 在水中溶解度会迅速减小。在这一步操作中
在水中溶解度会迅速减小。在这一步操作中 的用量一般为略微过量,原因是
的用量一般为略微过量,原因是(6)在碱性条件下往母液B中通入
 可将
可将 氧化为
氧化为 ,若
,若 (即用
(即用 表示
表示 ),请写出该反应的离子方程式:
),请写出该反应的离子方程式:
您最近一年使用:0次
解题方法
10 . 一种皂化废料含有CaCO3、Ca(OH)2、Mg(OH)2和SiO2,对其进行综合利用可得到碳酸镁和轻质碳酸钙,实现“变废为宝”。其工艺流程如图所示,下列说法错误 的是

| A.“溶解浸取”时可用稀盐酸代替氯化铵,且后续流程不变 |
B.“碳化I”发生的主要反应为Ca2++2NH3•H2O+CO2=CaCO3↓+2NH +H2O +H2O |
| C.此工艺中可循环使用NH4Cl和CO2,实现“变废为宝” |
| D.此工艺不产生有毒有害物质,且有利于实现“碳达峰,碳中和” |
您最近一年使用:0次



