名校
解题方法
1 . 铅用途广泛,是电气工业部门制造蓄电池、汽油添加剂和电缆的原材料。工业上常用铅精矿(主要成分是PbS以及少量Zn、Fe、SiO2、MgO、Al2O3)通过如图所示工业流程制取铅。

已知:①PbS在稀硫酸中不会溶解
②常温下,相关金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)滤渣1的成分是___________ ;酸浸后的分离操作是___________ 。
(2)溶液3可以是___________。
(3)反应4中铅单质在___________ 极产生,对应的电极反应式为___________ ;若转移2 mol电子,则生成的铅___________ 克。
(4)已知溶液4的溶质是化合物且为绿色氧化剂,写出反应3的化学方程式___________ 。
(5)根据题目所给信息,请计算出
___________ 。

已知:①PbS在稀硫酸中不会溶解
②常温下,相关金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 6.5 | 2.2 | 5.4 | 9.5 | 3.5 |
完全沉淀( )的pH )的pH | 9.7 | 3.2 | 6.4 | 11.0 | 4.7 |
(1)滤渣1的成分是
(2)溶液3可以是___________。
| A.盐酸 | B.氢氧化钠溶液 | C.食盐水 | D.氯化铵溶液 |
(3)反应4中铅单质在
(4)已知溶液4的溶质是化合物且为绿色氧化剂,写出反应3的化学方程式
(5)根据题目所给信息,请计算出

您最近一年使用:0次
名校
2 . 化工产品中,含氯物质众多,其用途广泛。回答下列问题:
(1)如图为氯及其化合物的“价-类”二维图。缺失的物质B为_______ (填化学式)。

(2)次氯酸钠是一种含氯物质,取含次氯酸钠14.9g/L的“84”消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为_______ mol/L。
(3)电石渣[主要成分为Ca(OH)2]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取KClO3的工艺流程如图所示:

已知:Ca(ClO3)2易溶于水。
①“一系列操作”为_______ 、_______ 。
②“转化”发生反应的离子方程式为_______ 。
(1)如图为氯及其化合物的“价-类”二维图。缺失的物质B为

(2)次氯酸钠是一种含氯物质,取含次氯酸钠14.9g/L的“84”消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
(3)电石渣[主要成分为Ca(OH)2]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取KClO3的工艺流程如图所示:

已知:Ca(ClO3)2易溶于水。
①“一系列操作”为
②“转化”发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 明矾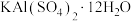 在日常生活中用途非常广泛。用废铝灰(含Al、
在日常生活中用途非常广泛。用废铝灰(含Al、 、Fe、
、Fe、 、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
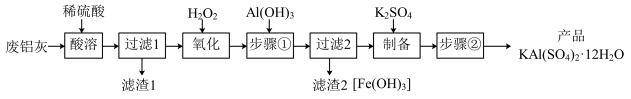
已知: 开始沉淀到沉淀完全时溶液的pH为1.9~3.7;
开始沉淀到沉淀完全时溶液的pH为1.9~3.7; 开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
(1)“酸溶”时, 溶解的离子方程式为
溶解的离子方程式为_____ 。
(2)“氧化”时,发生反应的离子方程式为_____ 。
(3)“步骤①”调节pH约为3.7的目的是_____ ;检验“过滤2”滤液中是否含 可用试剂
可用试剂_____ 。
(4)“步骤②”包含的操作有_____ 、_____ 、过滤、洗涤及干燥。
(5)已知废铝灰中铝元素的含量为a%,则mkg废铝灰理论上可制得明矾_____ kg。
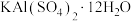 在日常生活中用途非常广泛。用废铝灰(含Al、
在日常生活中用途非常广泛。用废铝灰(含Al、 、Fe、
、Fe、 、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
已知:
 开始沉淀到沉淀完全时溶液的pH为1.9~3.7;
开始沉淀到沉淀完全时溶液的pH为1.9~3.7; 开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
开始沉淀到完全沉淀时溶液的pH为5.5~8.5。(1)“酸溶”时,
 溶解的离子方程式为
溶解的离子方程式为(2)“氧化”时,发生反应的离子方程式为
(3)“步骤①”调节pH约为3.7的目的是
 可用试剂
可用试剂(4)“步骤②”包含的操作有
(5)已知废铝灰中铝元素的含量为a%,则mkg废铝灰理论上可制得明矾
您最近一年使用:0次
名校
4 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:

已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水; 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入 的作用是
的作用是___________ (用离子反应方程式表示)。
(2)操作Ⅱ为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是___________ 。
(3)“滤液1”中是否存在 ,可用
,可用___________ 检验。
(4)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________  。
。
(5)操作V是___________ 、冷却结晶、过滤、洗涤。
(6) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为___________ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水; 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 |  |  |  |  |  |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全(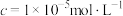 )时的pH )时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入
 的作用是
的作用是(2)操作Ⅱ为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(3)“滤液1”中是否存在
 ,可用
,可用(4)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(5)操作V是
(6)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
名校
5 . 二硫化碳( )是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在
)是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在 条件下发生反应可制得
条件下发生反应可制得 ,根据所给信息,回答下列问题。
,根据所给信息,回答下列问题。
反应原理:
反应装置: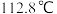 ,沸点
,沸点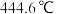 ;
; 的熔点
的熔点 ,沸点
,沸点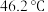 。
。
(1)装置A的名称是___________ ,加热装置A之前,需要先通入一段时间的 ,其目的是
,其目的是___________ (写出一点即可)。
(2)装置B的用途是___________ ,吸收尾气中的硫化氢可使用的试剂是___________ (填试剂名称)。
(3)反应过程中轻轻摇动装置A,使液态硫附着在装置A的内壁上,这样作的目的是___________ 。
(4)实验结束后,将制得的产品用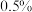 的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出
的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出 利用无水氯化钙处理后,再经过操作a可获得高纯的
利用无水氯化钙处理后,再经过操作a可获得高纯的 。利用高锰酸钾溶液洗涤是为了除去溶在
。利用高锰酸钾溶液洗涤是为了除去溶在 中的
中的___________ (写化学式),用无水氯化钙处理 的目的是
的目的是___________ ,操作a是___________ (写操作名称)。
(5)工业利用上述原理生产 时,常将副产品
时,常将副产品 利用克劳斯法转化为
利用克劳斯法转化为 ,从而实现循环利用,该方法分两步进行:
,从而实现循环利用,该方法分两步进行: 、
、___________ (写出化学方程式)。
 )是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在
)是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在 条件下发生反应可制得
条件下发生反应可制得 ,根据所给信息,回答下列问题。
,根据所给信息,回答下列问题。反应原理:

反应装置:

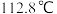 ,沸点
,沸点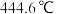 ;
; 的熔点
的熔点 ,沸点
,沸点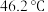 。
。(1)装置A的名称是
 ,其目的是
,其目的是(2)装置B的用途是
(3)反应过程中轻轻摇动装置A,使液态硫附着在装置A的内壁上,这样作的目的是
(4)实验结束后,将制得的产品用
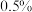 的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出
的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出 利用无水氯化钙处理后,再经过操作a可获得高纯的
利用无水氯化钙处理后,再经过操作a可获得高纯的 。利用高锰酸钾溶液洗涤是为了除去溶在
。利用高锰酸钾溶液洗涤是为了除去溶在 中的
中的 的目的是
的目的是(5)工业利用上述原理生产
 时,常将副产品
时,常将副产品 利用克劳斯法转化为
利用克劳斯法转化为 ,从而实现循环利用,该方法分两步进行:
,从而实现循环利用,该方法分两步进行: 、
、
您最近一年使用:0次
2024-03-08更新
|
110次组卷
|
4卷引用:陕西省延安市黄龙县中学2023-2024学年高三下学期开学考试理综试卷-高中化学
6 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、Al2O3、SiO2和铁的氧化物)为原料,采用酸溶法制取 和
和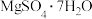 ,工业流程如图所示:
,工业流程如图所示: 易溶于水,
易溶于水, 和NiOOH不溶于水:
和NiOOH不溶于水: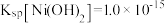 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“浸取”时需将矿样研磨的目的是_______ ,“滤渣1”的成分_______ (填化学式)。
(2)“滤液1”中加入 的作用是
的作用是________ (用离子反应方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是______ 。
(4)“滤液1”中是否存在 ,可用
,可用_______ 检验。
(5)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为______ mol/L。
(6)操作Ⅴ是_________ 、过滤、洗涤。
 和
和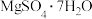 ,工业流程如图所示:
,工业流程如图所示:
 易溶于水,
易溶于水, 和NiOOH不溶于水:
和NiOOH不溶于水: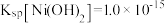 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 |  |  |  |  |  |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全(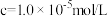 )时的pH )时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“浸取”时需将矿样研磨的目的是
(2)“滤液1”中加入
 的作用是
的作用是(3)操作II为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(4)“滤液1”中是否存在
 ,可用
,可用(5)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为(6)操作Ⅴ是
您最近一年使用:0次
2024-01-22更新
|
95次组卷
|
2卷引用:内蒙古赤峰实验中学2023-2024学年高二下学期开学化学试题
名校
解题方法
7 . 化工专家侯德榜发明的侯氏制碱法,其工艺流程图如下:
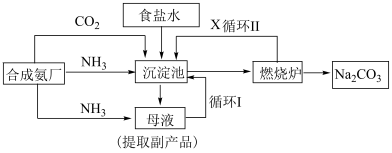
Ⅰ.根据以上流程回答下列问题:
(1)“侯氏制碱法”中的“碱”为___________ (填化学式),其用途有___________ (写一种)。
(2)生产时,先向饱和NaCl溶液中通入较多的NH3(溶液显碱性),再通入足量的CO2,其原因是下列中的___________ 。(填选项)
A.NH3比CO2更易制取
B.使CO2更易被吸收,加快反应速率
C.CO2的密度比NH3大
(3)从沉淀池中分离出NaHCO3晶体的方法是___________ 。
(4)燃烧炉中发生反应的化学方程式为___________ ,循环Ⅱ中X的分子式为___________ 。
Ⅱ.产品分析:
(5)碳酸钠中可能含有氯化钠,检验的操作和现象为___________ 。
(6)把6.0 g含有少量NaCl杂质的Na2CO3样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量Na2O2固体,Na2O2增重1.4 g,回答下列问题:
①气体与Na2O2反应的化学方程式为___________ 。
②产品纯度(质量分数)为___________ (保留3位有效数字)。

Ⅰ.根据以上流程回答下列问题:
(1)“侯氏制碱法”中的“碱”为
(2)生产时,先向饱和NaCl溶液中通入较多的NH3(溶液显碱性),再通入足量的CO2,其原因是下列中的
A.NH3比CO2更易制取
B.使CO2更易被吸收,加快反应速率
C.CO2的密度比NH3大
(3)从沉淀池中分离出NaHCO3晶体的方法是
(4)燃烧炉中发生反应的化学方程式为
Ⅱ.产品分析:
(5)碳酸钠中可能含有氯化钠,检验的操作和现象为
(6)把6.0 g含有少量NaCl杂质的Na2CO3样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量Na2O2固体,Na2O2增重1.4 g,回答下列问题:
①气体与Na2O2反应的化学方程式为
②产品纯度(质量分数)为
您最近一年使用:0次
2023-12-25更新
|
123次组卷
|
3卷引用:广东省惠东荣超中学2023-2024学年高一下学期开学质量检测化学试题
名校
解题方法
8 . 金、银是生活中常见的贵重金属,用途非常广泛。工业上常利用氰化法从一种含金矿石(成分为Au、Ag、Fe2O3和其它不溶性杂质)中提取金。工艺流程如图:

已知:①Zn+ O2 +H2O=Zn(OH)2
O2 +H2O=Zn(OH)2
② Zn2+(aq)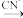 Zn(CN)2(s)
Zn(CN)2(s)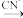 Zn(CN)
Zn(CN) (aq)
(aq)
(1)步骤2中浸出应选用_______ (填盐酸、硫酸或硝酸)。
(2)步骤4浸出的目的是将单质Au转化为 进入溶液,该反应的离子方程式为
进入溶液,该反应的离子方程式为_______ 。
(3)步骤4中为提高金的浸出速率可适当升高温度,但温度过高浸出速率反而会降低,原因是_______ 。
(4)步骤6的目的是_______ 。
(5)步骤7置换的总反应为:2Au(CN) +3Zn+4CN-+2H2O=2Au+2Zn(CN)
+3Zn+4CN-+2H2O=2Au+2Zn(CN) +ZnO
+ZnO +2H2↑
+2H2↑
①在置换过程中,为防止生成Zn(CN)2沉淀影响置换速率,应采取的措施是_______ 。
②关于步骤7,以下说法正确的是(填字母)_______ 。
a.步骤7进行前要先脱氧,否则会增加锌的用量
b.该反应最好在强酸性环境下进行
c.脱金贫液含有大量Zn2+
(6)脱金贫液(主要含有CN-)会破坏环境,可通过化学方法转化为无毒废水净化排放。碱性条件下,用NaClO将贫液中的CN-氧化成无毒的CO 和N2,该反应的离子方程式为
和N2,该反应的离子方程式为_______ 。

已知:①Zn+
 O2 +H2O=Zn(OH)2
O2 +H2O=Zn(OH)2② Zn2+(aq)
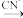 Zn(CN)2(s)
Zn(CN)2(s)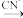 Zn(CN)
Zn(CN) (aq)
(aq)(1)步骤2中浸出应选用
(2)步骤4浸出的目的是将单质Au转化为
 进入溶液,该反应的离子方程式为
进入溶液,该反应的离子方程式为(3)步骤4中为提高金的浸出速率可适当升高温度,但温度过高浸出速率反而会降低,原因是
(4)步骤6的目的是
(5)步骤7置换的总反应为:2Au(CN)
 +3Zn+4CN-+2H2O=2Au+2Zn(CN)
+3Zn+4CN-+2H2O=2Au+2Zn(CN) +ZnO
+ZnO +2H2↑
+2H2↑①在置换过程中,为防止生成Zn(CN)2沉淀影响置换速率,应采取的措施是
②关于步骤7,以下说法正确的是(填字母)
a.步骤7进行前要先脱氧,否则会增加锌的用量
b.该反应最好在强酸性环境下进行
c.脱金贫液含有大量Zn2+
(6)脱金贫液(主要含有CN-)会破坏环境,可通过化学方法转化为无毒废水净化排放。碱性条件下,用NaClO将贫液中的CN-氧化成无毒的CO
 和N2,该反应的离子方程式为
和N2,该反应的离子方程式为
您最近一年使用:0次
2021-04-09更新
|
718次组卷
|
5卷引用:北京市首都师范大学附属中学2023-2024学年高一下学期开学化学试题
北京市首都师范大学附属中学2023-2024学年高一下学期开学化学试题北京市首都师范大学附属中学2023-2024学年高一下学期3月月考化学(选考)试题吉林省长春市普通高中2021届高三4月质量监测(三)理综化学试卷题(已下线)2021年高考化学押题预测卷(辽宁卷)(03)(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)



