1 . 下列实验操作不正确的是
| A.提纯淀粉胶体中的NaCl:渗析 |
| B.除去NaCl溶液中的NaHCO3:加NaOH |
| C.分离CaCO3和NaCl混合物:溶解过滤 |
| D.用NaCl溶液制备NaCl固体:蒸发结晶 |
您最近一年使用:0次
2023-10-14更新
|
360次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一上学期10月月考化学试题
2 . 硼酸( )是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含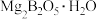 、
、 及少量
及少量 、
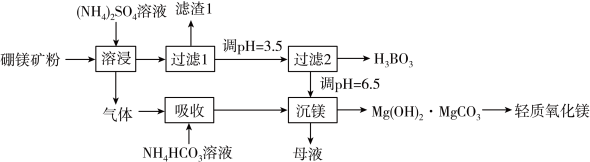
、 )为原料生产硼酸及轻质氧化镁的工艺流程如下:
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
已知:
回答下列问题:
(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式___________ 。
(2)“滤渣1”的主要成分有___________ (填化学式)。为检验“过滤1”后的滤液中是否含有 离子,可选用的化学试剂是
离子,可选用的化学试剂是___________ (填化学式)。
(3)已知 的电离方程式为
的电离方程式为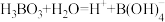 ,可知
,可知 为
为___________ 元弱酸,请写出 与足量
与足量 溶液反应的离子方程式
溶液反应的离子方程式___________ ;“过滤2”前,将溶液pH调节至3.5的目的是___________ 。
(4)“沉镁”后分离生成的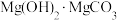 沉淀的操作为
沉淀的操作为___________ ,母液经加热后可返回___________ (填“溶浸”“吸收”或“沉镁”)工序循环使用。高温焙烧碱式碳酸镁可制备轻质氧化镁,写出化学方程式___________ 。
 )是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含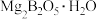 、
、 及少量
及少量 、
、 )为原料生产硼酸及轻质氧化镁的工艺流程如下:
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
已知:

回答下列问题:
(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式
(2)“滤渣1”的主要成分有
 离子,可选用的化学试剂是
离子,可选用的化学试剂是(3)已知
 的电离方程式为
的电离方程式为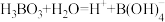 ,可知
,可知 为
为 与足量
与足量 溶液反应的离子方程式
溶液反应的离子方程式(4)“沉镁”后分离生成的
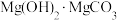 沉淀的操作为
沉淀的操作为
您最近一年使用:0次
名校
解题方法
3 . 高铁酸钾(K2FeO4)是一种环保、高效饮水处理剂,利用铁屑制备的简略流程如图所示:

请回答下列问题:
(1)反应Ⅰ的生成物中可能含有的金属阳离子是___________ (用离子符号表示),如何检验该离子___________ 。
(2)操作A和操作B相同,其操作名称是___________ ;由操作B判断该生产条件下物质的溶解性:Na2FeO4___________ K2FeO4 (填“>”或“<”)。
(3)溶液C可与氯气反应制取漂白液,其离子方程式为___________ 。
(4)当生产过程中制得2mol的K2FeO4时,反应Ⅱ中转移的电子数为___________ 。
(5)反应Ⅱ中用到NaOH,若某同学做实验时要用到200mL 0.1mol/L NaOH溶液,现进行配制,则:
①配制该浓度的溶液需用托盘天平称量NaOH固体的质量为___________ g;
②配制过程中,下列操作导致所配溶液浓度偏大的是___________ (填标号)。
a.转移溶液时有少许液体溅出
b.溶解后,将溶液直接转移到容量瓶中
c.定容时俯视刻度线
d.定容摇匀后,发现液面下降,继续加水至刻度线

请回答下列问题:
(1)反应Ⅰ的生成物中可能含有的金属阳离子是
(2)操作A和操作B相同,其操作名称是
(3)溶液C可与氯气反应制取漂白液,其离子方程式为
(4)当生产过程中制得2mol的K2FeO4时,反应Ⅱ中转移的电子数为
(5)反应Ⅱ中用到NaOH,若某同学做实验时要用到200mL 0.1mol/L NaOH溶液,现进行配制,则:
①配制该浓度的溶液需用托盘天平称量NaOH固体的质量为
②配制过程中,下列操作导致所配溶液浓度偏大的是
a.转移溶液时有少许液体溅出
b.溶解后,将溶液直接转移到容量瓶中
c.定容时俯视刻度线
d.定容摇匀后,发现液面下降,继续加水至刻度线
您最近一年使用:0次
4 . 下列除杂(括号内为杂质)方法正确的是
①FeCl2 (CuCl2):加入过量铁粉,过滤
②甲烷(乙烯):光照条件下通入Cl2,气液分离
③乙醇(水):加足量生石灰,蒸馏
④苯甲酸(氯化钠):将固体混合物在较高温下溶解,趁热过滤,再将滤液降温结晶,过滤、洗涤、干燥
①FeCl2 (CuCl2):加入过量铁粉,过滤
②甲烷(乙烯):光照条件下通入Cl2,气液分离
③乙醇(水):加足量生石灰,蒸馏
④苯甲酸(氯化钠):将固体混合物在较高温下溶解,趁热过滤,再将滤液降温结晶,过滤、洗涤、干燥
| A.①②③ | B.②③④ | C.①③④ | D.①②④ |
您最近一年使用:0次
名校
5 .  是一种常见的氧化剂,工业上利用软锰矿
是一种常见的氧化剂,工业上利用软锰矿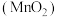 制备高锰酸钾的流程如下,在实验室中模拟该流程制备
制备高锰酸钾的流程如下,在实验室中模拟该流程制备 ,并对产物纯度进行测定。
,并对产物纯度进行测定。
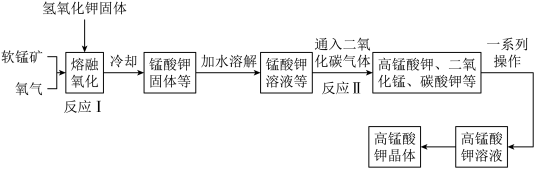
回答下列问题:
(1)反应Ⅰ需要的温度约为400℃,应选择的加热仪器为_______ 。
A酒精灯 B.电磁炉 C.电吹风
(2)加水溶解步骤必须要用到的玻璃仪器有_______。
(3)若要除去 、
、 溶液中的
溶液中的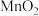 ,应进行操作
,应进行操作_______ (填操作名称)。
(4)由 溶液获的
溶液获的 晶体的一系列操作为:蒸发浓缩至饱和、
晶体的一系列操作为:蒸发浓缩至饱和、_______ 、过滤、洗涤、干燥(填操作名称)。
(5)研究表明,反应Ⅰ分两步进行:
第一步反应生成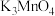 ,反应方程式为
,反应方程式为_______ 。
第二步反应方程式为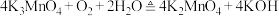
(6)写出反应Ⅱ的离子方程式_______ 。
(7)所得产品中只含有杂质 ,通过元素分析仪测定出产品中所有氧原子的质量分数为40.48%,产品的纯度为
,通过元素分析仪测定出产品中所有氧原子的质量分数为40.48%,产品的纯度为_______ %(保留两位小数)。
 是一种常见的氧化剂,工业上利用软锰矿
是一种常见的氧化剂,工业上利用软锰矿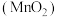 制备高锰酸钾的流程如下,在实验室中模拟该流程制备
制备高锰酸钾的流程如下,在实验室中模拟该流程制备 ,并对产物纯度进行测定。
,并对产物纯度进行测定。
回答下列问题:
(1)反应Ⅰ需要的温度约为400℃,应选择的加热仪器为
A酒精灯 B.电磁炉 C.电吹风
(2)加水溶解步骤必须要用到的玻璃仪器有_______。
| A.烧杯 | B.玻璃棒 | C.量筒 | D.酒精灯 |
 、
、 溶液中的
溶液中的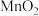 ,应进行操作
,应进行操作(4)由
 溶液获的
溶液获的 晶体的一系列操作为:蒸发浓缩至饱和、
晶体的一系列操作为:蒸发浓缩至饱和、(5)研究表明,反应Ⅰ分两步进行:
第一步反应生成
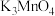 ,反应方程式为
,反应方程式为第二步反应方程式为
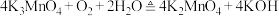
(6)写出反应Ⅱ的离子方程式
(7)所得产品中只含有杂质
 ,通过元素分析仪测定出产品中所有氧原子的质量分数为40.48%,产品的纯度为
,通过元素分析仪测定出产品中所有氧原子的质量分数为40.48%,产品的纯度为
您最近一年使用:0次
名校
6 . 某固体混合物,可能含有CaO、 、
、 、
、 、NaCl中的几种,为检验其成分,做了如下实验:
、NaCl中的几种,为检验其成分,做了如下实验:
①取一定量固体溶于足量水,搅拌后得到无色透明溶液和白色沉淀,过滤得到滤液Ⅰ和沉淀Ⅰ,沉淀质量为10.00g。
②向滤液Ⅰ中加入过量的 溶液,产生白色沉淀,过滤得到滤液Ⅱ和沉淀Ⅱ,沉淀质量为43.00g。
溶液,产生白色沉淀,过滤得到滤液Ⅱ和沉淀Ⅱ,沉淀质量为43.00g。
③向沉淀Ⅱ中加入过量的盐酸,仍有固体未溶解,过滤得到沉淀Ⅲ,沉淀质量为23.30g。
④向滤液Ⅱ中加入硝酸酸化后,再加入过量的 溶液,得到大量白色沉淀,过滤得到沉淀Ⅳ,沉淀质量为71.75g。
溶液,得到大量白色沉淀,过滤得到沉淀Ⅳ,沉淀质量为71.75g。
已知:溶液中有 、
、 时,
时, 更容易和
更容易和 形成沉淀。
形成沉淀。
回答下列问题:
(1)通过实验①可知,一定不存在的是_______ (填化学式,下同)。
(2)沉淀Ⅰ、沉淀Ⅱ分别是_______ 、_______ 。
(3)本实验需要多次过滤,过滤需要用到得玻璃仪器有_______。
(4)写出实验④反应的离子方程式_______ 。
(5)该固体中一定含有_______ (填化学式),质量之比为_______ 。
 、
、 、
、 、NaCl中的几种,为检验其成分,做了如下实验:
、NaCl中的几种,为检验其成分,做了如下实验:①取一定量固体溶于足量水,搅拌后得到无色透明溶液和白色沉淀,过滤得到滤液Ⅰ和沉淀Ⅰ,沉淀质量为10.00g。
②向滤液Ⅰ中加入过量的
 溶液,产生白色沉淀,过滤得到滤液Ⅱ和沉淀Ⅱ,沉淀质量为43.00g。
溶液,产生白色沉淀,过滤得到滤液Ⅱ和沉淀Ⅱ,沉淀质量为43.00g。③向沉淀Ⅱ中加入过量的盐酸,仍有固体未溶解,过滤得到沉淀Ⅲ,沉淀质量为23.30g。
④向滤液Ⅱ中加入硝酸酸化后,再加入过量的
 溶液,得到大量白色沉淀,过滤得到沉淀Ⅳ,沉淀质量为71.75g。
溶液,得到大量白色沉淀,过滤得到沉淀Ⅳ,沉淀质量为71.75g。已知:溶液中有
 、
、 时,
时, 更容易和
更容易和 形成沉淀。
形成沉淀。回答下列问题:
(1)通过实验①可知,一定不存在的是
(2)沉淀Ⅰ、沉淀Ⅱ分别是
(3)本实验需要多次过滤,过滤需要用到得玻璃仪器有_______。
| A.烧杯 | B.玻璃棒 | C.漏斗 | D.酒精灯 |
(5)该固体中一定含有
您最近一年使用:0次
解题方法
7 . 下列基本实验操作正确的是
| A | B | C | D |
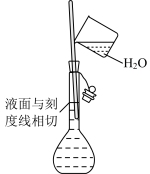 | 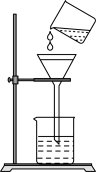 | 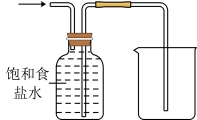 | 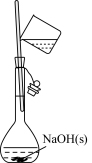 |
| 配制溶液 | 过滤 | 收集氯气 | 配制 的 的 溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-13更新
|
224次组卷
|
9卷引用:重庆市三峡名校联盟2022-2023学年高一上学期联考化学试题
重庆市三峡名校联盟2022-2023学年高一上学期联考化学试题山西省吕梁市2021-2022学年高一上学期期末考试化学试题广东省名校联盟2021-2022学年高一上学期期末考试化学试题河北省秦皇岛市2021-2022学年高一上学期期末统一考试化学试题河北省廊坊市2021-2022学年高一上学期期末统一考试化学试题(已下线)2.3.4 配制一定物质的量浓度的溶液-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)湖南省衡阳市祁东县2021-2022学年高一上学期期末考试化学试题云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题河北省秦皇岛市青龙满族自治县实验中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
8 . 要除去下列物质中的少量杂质(括号内为杂质),下列实验方案设计中,不合理的是
| A.CO(CO2):将气体先通入氢氧化钠溶液,再通过浓硫酸 |
| B.NaCl溶液(NaOH):加入过量的H2SO4溶液 |
| C.CaCO3(CaCl2):加水溶解→过滤→洗涤→干燥 |
| D.KCl溶液(K2CO3):加入适量的稀盐酸 |
您最近一年使用:0次
2022-06-17更新
|
146次组卷
|
4卷引用:重庆市第十八中学2022-2023学年高一上学期10月月考化学试题
重庆市第十八中学2022-2023学年高一上学期10月月考化学试题重庆西南大学附属中学校2023-2024学年高一上学期定时检测(一)化学试题重庆市第十八中学2023-2024学年高一上学期11月期中化学试题(已下线)第04讲 初中化学实验-【暑假自学课】2022年新高一化学暑假精品课(沪科版2020必修第一册)
9 . 下列各组实验装置、所用试剂、实验现象及结论都正确的是
| A | B | C | D |
 | 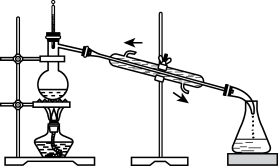 | 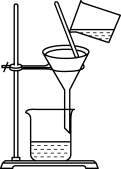 |  |
| 分离苯萃取碘水后已分层的有机层和水层 | 从三氯甲烷和四氯甲烷混合物中蒸馏出三氯甲烷 | 趁热过滤提纯苯甲酸 | 萃取时,将所需试剂加入分液漏斗,塞上玻璃塞,按如图所示方式用力振荡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-21更新
|
143次组卷
|
2卷引用:重庆市名校联盟2021-2022学年高二下学期第一次联合考试化学试题
10 . 中国女药学家屠呦呦因发现青蒿素对疟疾的治疗作用而成为2015年诺贝尔生理学或医学奖获得者之一、青蒿素为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为 ℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为
℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为
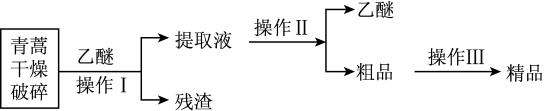
下列有关此工艺操作不正确的是
 ℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为
℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为
下列有关此工艺操作不正确的是
| A.破碎的目的是提高青蒿素的浸取率 | B.操作I是萃取 |
| C.操作II是蒸馏 | D.操作III是重结晶 |
您最近一年使用:0次
2022-03-21更新
|
225次组卷
|
3卷引用:重庆市缙云教育联盟2021-2022学年高二5月质量检测化学试题



