解题方法
1 . 硫酸四氨合铜晶体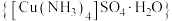 常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
实验(一)制备 ,装置如图所示。
,装置如图所示。___________ 。该反应中浓硫酸表现出的性质有___________ 。
(2)持续反应一段时间后C装置中的现象为___________ 。
(3)将A装置中混合物缓慢倒入装有水的烧杯中,再加入过量的 ,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到
,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到 晶体。
晶体。
①不能向A装置的混合物中加入水,其原因是___________ 。
② 的作用是
的作用是___________ 。
实验(二)制备硫酸四氨合铜晶体。
 中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是
中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是___________ (写出离子方程式)。
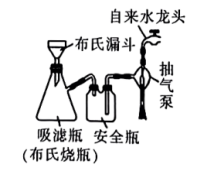
(5)相对普通过滤,利用图2装置分离晶体,其突出优点有___________ (答一条即可)。
实验(三)测定硫酸四氨合铜晶体纯度。
取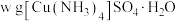 样品溶于蒸馏水配制成
样品溶于蒸馏水配制成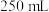 溶液,准确量取
溶液,准确量取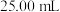 配制溶液,滴加适量的稀硫酸,充分反应。加入过量
配制溶液,滴加适量的稀硫酸,充分反应。加入过量 溶液,滴加3滴淀粉溶液,用
溶液,滴加3滴淀粉溶液,用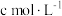
 溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗
溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗 溶液
溶液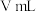 。相关反应:
。相关反应: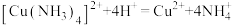 ,
, ,
,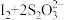
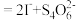 。
。
(6)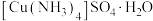 产品的纯度为
产品的纯度为___________ 。若①摇动锥形瓶时间过长,空气进入较多;②滴加稀硫酸过多,则上述两种情况可能会导致测得结果___________ (填字母)。(已知: 在酸性条件下不稳定,会发生歧化反应)
在酸性条件下不稳定,会发生歧化反应)
A.①偏高 ②偏低 B.①偏低 ②偏高 C.①偏高 ②偏高 D.①偏低 ②偏低
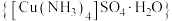 常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。实验(一)制备
 ,装置如图所示。
,装置如图所示。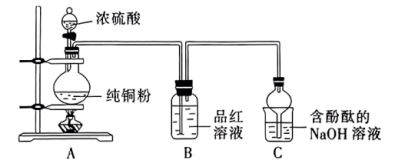
(2)持续反应一段时间后C装置中的现象为
(3)将A装置中混合物缓慢倒入装有水的烧杯中,再加入过量的
 ,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到
,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到 晶体。
晶体。①不能向A装置的混合物中加入水,其原因是
②
 的作用是
的作用是实验(二)制备硫酸四氨合铜晶体。
| 步骤 | 实验操作及主要现象 |
 | 取一定量 晶体溶于蒸馏水得到 晶体溶于蒸馏水得到 溶液 溶液 |
 | 向步骤 溶液中滴加一定量的氨水,产生蓝色沉淀;继续滴加氨水,蓝色沉淀逐渐溶解,最终得到深蓝色的透明溶液 溶液中滴加一定量的氨水,产生蓝色沉淀;继续滴加氨水,蓝色沉淀逐渐溶解,最终得到深蓝色的透明溶液 |
 | 向步骤 所得溶液中滴加 所得溶液中滴加 的乙醇,静置析出深蓝色晶体,用下图装置过滤 的乙醇,静置析出深蓝色晶体,用下图装置过滤 |
 | 取步骤 中晶体,用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,然后将其在 中晶体,用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,然后将其在 左右小心烘干,得到 左右小心烘干,得到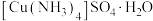 |
 中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是
中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是(5)相对普通过滤,利用图2装置分离晶体,其突出优点有
实验(三)测定硫酸四氨合铜晶体纯度。
取
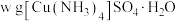 样品溶于蒸馏水配制成
样品溶于蒸馏水配制成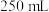 溶液,准确量取
溶液,准确量取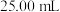 配制溶液,滴加适量的稀硫酸,充分反应。加入过量
配制溶液,滴加适量的稀硫酸,充分反应。加入过量 溶液,滴加3滴淀粉溶液,用
溶液,滴加3滴淀粉溶液,用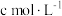
 溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗
溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗 溶液
溶液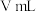 。相关反应:
。相关反应: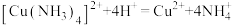 ,
, ,
,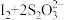
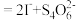 。
。(6)
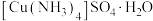 产品的纯度为
产品的纯度为 在酸性条件下不稳定,会发生歧化反应)
在酸性条件下不稳定,会发生歧化反应)A.①偏高 ②偏低 B.①偏低 ②偏高 C.①偏高 ②偏高 D.①偏低 ②偏低
您最近一年使用:0次
2 . 回答下列问题:
Ⅰ.图为常见的气体发生装置,回答下列问题:___________ ,选用装置___________ 。
Ⅱ.某同学设计实验探究NO和Cu反应的氧化产物,装置如图所示(部分夹持装置未画出)。___________ ,a管的作用是___________ 。
(3)装置B中试剂为___________ ,装置E的作用是___________ 。
(4)若D中产物为CuO和 的混合物,为测定其组成,取混合物5.92g与足量稀硝酸反应,测得生成448mL(标准状况下)NO气体,则混合物中CuO和
的混合物,为测定其组成,取混合物5.92g与足量稀硝酸反应,测得生成448mL(标准状况下)NO气体,则混合物中CuO和 的物质的量之比为
的物质的量之比为___________ 。
Ⅰ.图为常见的气体发生装置,回答下列问题:
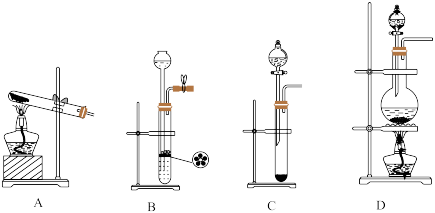
Ⅱ.某同学设计实验探究NO和Cu反应的氧化产物,装置如图所示(部分夹持装置未画出)。

(3)装置B中试剂为
(4)若D中产物为CuO和
 的混合物,为测定其组成,取混合物5.92g与足量稀硝酸反应,测得生成448mL(标准状况下)NO气体,则混合物中CuO和
的混合物,为测定其组成,取混合物5.92g与足量稀硝酸反应,测得生成448mL(标准状况下)NO气体,则混合物中CuO和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解题方法
3 . 硫及其化合物是十分重要的化工原料。
(1)某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):__________ (填字母)。
②已知开始时量气管读数为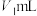 ,最终读数为
,最终读数为 (均折合成标准状况,且
(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为__________ 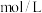 。
。
(2)已知 具有还原性,可以还原
具有还原性,可以还原 ,也可以与
,也可以与 发生反应。
发生反应。
①将 通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明
通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明 与
与 反应无
反应无 生成,可能发生反应的化学方程式为
生成,可能发生反应的化学方程式为__________ 。
②将 通入装有碘水(含淀粉)的洗气瓶中,若
通入装有碘水(含淀粉)的洗气瓶中,若__________ ,说明还原性: ,写出该反应的离子方程式:
,写出该反应的离子方程式:__________ 。
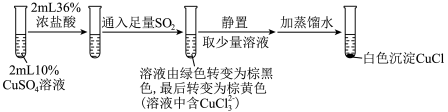
(3)为探究 在盐酸中与Cu、
在盐酸中与Cu、 的反应,某实验小组设计如图实验。
的反应,某实验小组设计如图实验。
实验Ⅰ: ,实验Ⅰ中得到的黑色固体为
,实验Ⅰ中得到的黑色固体为 。
。
①实验Ⅰ通入 时反应的离子方程式为
时反应的离子方程式为__________ ,实验Ⅱ通入 时反应的离子方程式为
时反应的离子方程式为__________ 。
②实验Ⅱ若消耗__________  ,则生成
,则生成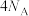 个
个 。
。
(1)某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):
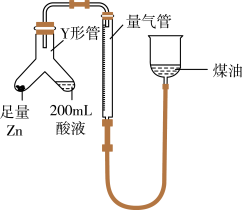
②已知开始时量气管读数为
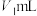 ,最终读数为
,最终读数为 (均折合成标准状况,且
(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为 。
。(2)已知
 具有还原性,可以还原
具有还原性,可以还原 ,也可以与
,也可以与 发生反应。
发生反应。①将
 通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明
通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明 与
与 反应无
反应无 生成,可能发生反应的化学方程式为
生成,可能发生反应的化学方程式为②将
 通入装有碘水(含淀粉)的洗气瓶中,若
通入装有碘水(含淀粉)的洗气瓶中,若 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(3)为探究
 在盐酸中与Cu、
在盐酸中与Cu、 的反应,某实验小组设计如图实验。
的反应,某实验小组设计如图实验。实验Ⅰ:
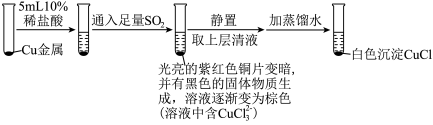
 ,实验Ⅰ中得到的黑色固体为
,实验Ⅰ中得到的黑色固体为 。
。①实验Ⅰ通入
 时反应的离子方程式为
时反应的离子方程式为 时反应的离子方程式为
时反应的离子方程式为②实验Ⅱ若消耗
 ,则生成
,则生成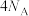 个
个 。
。
您最近一年使用:0次
名校
解题方法
4 . 贵州是国内唯一兼具高海拔、低纬度、寡日照、多云雾适宜种茶制茶条件的茶区,是国内业界公认的高品质绿茶重要产地。茶叶中有两种含量最多的功效成分,一是咖啡因,它易溶于水、乙醇、氯仿,二是茶多酚,是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。实验室提取茶多酚主要实验步骤如下:
②提取:称取10g茶叶末,用滤纸包好,按如图所示装置进行提取操作。

③分离:将提取液分别过滤后合并滤液,并将滤液按1∶2的体积比与氯仿混合,并搅拌均匀,再用分液漏斗静止分层。取上层液按1∶2体积比加入乙酸乙酯,混合均匀后搅拌3~5分钟,然后倒入分液漏斗中静置,最后分层,操作2次,合并萃取液,用水浴加热减压蒸馏除去乙酸乙酯。
④浓缩:趁热将残液移入洁净干燥的蒸发皿,用蒸汽浴继续浓缩至近干
⑤结晶:冷却至室温,移入冰箱冷冻干燥,得到白色粉末状的茶多酚粗制品。将粗制品用蒸馏水进行1~2次重结晶,得到茶多酚精品。
回答下列问题:
(1)步骤2中滤纸包好的茶叶末装入___________ 中,圆底烧瓶内加___________ 和适量乙醇,通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在90℃。为使恒压漏斗内液面高出茶叶包约0.5cm,并保持约1h,可行的操作方法是___________ 。
(2)步骤3中氯仿的作用是___________ 。
(3)下列关于萃取过程中振摇操作的示意图,正确的是___________ (填序号)。
A. B.
B.  C.
C.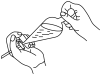
(4)与常压蒸馏相比,减压蒸馏的优点是___________ 。
(5)在酸性介质中,茶多酚能将 还原为
还原为 ,
, 与
与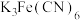 生成的深蓝色配位化合物
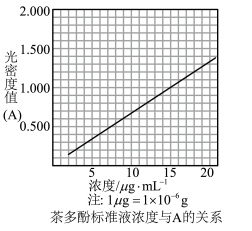
生成的深蓝色配位化合物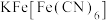 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量 和
和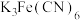 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值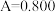 ,则产品的纯度是
,则产品的纯度是___________ (以质量分数表示)。
①准备工作:称取适量干燥的绿茶样品,并将其粉碎成细粉末。
②提取:称取10g茶叶末,用滤纸包好,按如图所示装置进行提取操作。

③分离:将提取液分别过滤后合并滤液,并将滤液按1∶2的体积比与氯仿混合,并搅拌均匀,再用分液漏斗静止分层。取上层液按1∶2体积比加入乙酸乙酯,混合均匀后搅拌3~5分钟,然后倒入分液漏斗中静置,最后分层,操作2次,合并萃取液,用水浴加热减压蒸馏除去乙酸乙酯。
④浓缩:趁热将残液移入洁净干燥的蒸发皿,用蒸汽浴继续浓缩至近干
⑤结晶:冷却至室温,移入冰箱冷冻干燥,得到白色粉末状的茶多酚粗制品。将粗制品用蒸馏水进行1~2次重结晶,得到茶多酚精品。
回答下列问题:
(1)步骤2中滤纸包好的茶叶末装入
(2)步骤3中氯仿的作用是
(3)下列关于萃取过程中振摇操作的示意图,正确的是
A.
 B.
B.  C.
C.
(4)与常压蒸馏相比,减压蒸馏的优点是
(5)在酸性介质中,茶多酚能将
 还原为
还原为 ,
, 与
与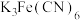 生成的深蓝色配位化合物
生成的深蓝色配位化合物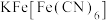 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量
 和
和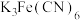 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值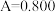 ,则产品的纯度是
,则产品的纯度是
您最近一年使用:0次
名校
5 . 利用莫尔盐制备草酸亚铁晶体 的实验及样品纯度的检验实验设计如下,回答下列问题:
的实验及样品纯度的检验实验设计如下,回答下列问题:
已知: 时,
时, 易被氧气氧化。
易被氧气氧化。
Ⅰ.莫尔盐 的制备
的制备
实验步骤:将绿矾与适量的硫酸铵固体混合溶于水中,加入适量的稀硫酸调节 至
至 ,蒸发浓缩,趁热过滤,冷却结晶,过滤、洗涤、干燥,得产品。
,蒸发浓缩,趁热过滤,冷却结晶,过滤、洗涤、干燥,得产品。
(1)用稀硫酸调溶液 至
至 的目的是
的目的是_______ 。
Ⅱ.草酸亚铁晶体的制备
实验步骤:将莫尔盐溶于适量稀硫酸并装入三颈烧瓶中,通过仪器 滴加草酸溶液,水浴加热,充分反应后过滤,洗涤,得淡黄色固体草酸亚铁晶体。
滴加草酸溶液,水浴加热,充分反应后过滤,洗涤,得淡黄色固体草酸亚铁晶体。 的名称是
的名称是_______ ,导管A的作用是_______ 。
Ⅲ.草酸亚铁晶体样品纯度的检验
草酸亚铁晶体样品中可能含有的杂质为 ,采用
,采用 滴定法测定该样品的组成,实验步骤如下:
滴定法测定该样品的组成,实验步骤如下:
①准确称取 草酸亚铁晶体样品,溶于稀硫酸中,配成
草酸亚铁晶体样品,溶于稀硫酸中,配成 溶液。
溶液。
②取 ①中所得的溶液,用
①中所得的溶液,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 。③向滴定后的溶液中加入适量锌粉,充分反应后过滤,洗涤,洗涤液并入滤液中。
。③向滴定后的溶液中加入适量锌粉,充分反应后过滤,洗涤,洗涤液并入滤液中。
④继续用 标准溶液滴定步骤③中所得滤液至终点,消耗
标准溶液滴定步骤③中所得滤液至终点,消耗 标准溶液
标准溶液 。
。
已知: ;
;
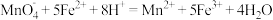 。
。
(3)步骤②中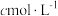 的
的 溶液装在
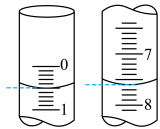
溶液装在_______ (填“酸式滴定管”或“碱式滴定管”)中;步骤④中若滴定开始和结束时,滴定管中的液面如下图所示,则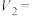
_______ 。_______ ;步骤③中加入锌粉的目的是_______ 。
(5)草酸亚铁晶体样品的纯度为_______ (用含 的式子表示)。
的式子表示)。
 的实验及样品纯度的检验实验设计如下,回答下列问题:
的实验及样品纯度的检验实验设计如下,回答下列问题:已知:
 时,
时, 易被氧气氧化。
易被氧气氧化。Ⅰ.莫尔盐
 的制备
的制备实验步骤:将绿矾与适量的硫酸铵固体混合溶于水中,加入适量的稀硫酸调节
 至
至 ,蒸发浓缩,趁热过滤,冷却结晶,过滤、洗涤、干燥,得产品。
,蒸发浓缩,趁热过滤,冷却结晶,过滤、洗涤、干燥,得产品。(1)用稀硫酸调溶液
 至
至 的目的是
的目的是Ⅱ.草酸亚铁晶体的制备
实验步骤:将莫尔盐溶于适量稀硫酸并装入三颈烧瓶中,通过仪器
 滴加草酸溶液,水浴加热,充分反应后过滤,洗涤,得淡黄色固体草酸亚铁晶体。
滴加草酸溶液,水浴加热,充分反应后过滤,洗涤,得淡黄色固体草酸亚铁晶体。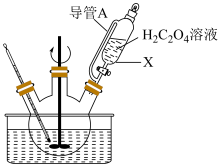
 的名称是
的名称是Ⅲ.草酸亚铁晶体样品纯度的检验
草酸亚铁晶体样品中可能含有的杂质为
 ,采用
,采用 滴定法测定该样品的组成,实验步骤如下:
滴定法测定该样品的组成,实验步骤如下:①准确称取
 草酸亚铁晶体样品,溶于稀硫酸中,配成
草酸亚铁晶体样品,溶于稀硫酸中,配成 溶液。
溶液。②取
 ①中所得的溶液,用
①中所得的溶液,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 。③向滴定后的溶液中加入适量锌粉,充分反应后过滤,洗涤,洗涤液并入滤液中。
。③向滴定后的溶液中加入适量锌粉,充分反应后过滤,洗涤,洗涤液并入滤液中。④继续用
 标准溶液滴定步骤③中所得滤液至终点,消耗
标准溶液滴定步骤③中所得滤液至终点,消耗 标准溶液
标准溶液 。
。已知:
 ;
;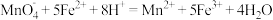 。
。(3)步骤②中
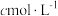 的
的 溶液装在
溶液装在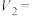
(5)草酸亚铁晶体样品的纯度为
 的式子表示)。
的式子表示)。
您最近一年使用:0次
2024-02-27更新
|
135次组卷
|
3卷引用:贵州省黔东南苗族侗族自治州黔东南州九校联考2023-2024学年高三下学期开学化学试题
解题方法
6 . 地球上没有垃圾,只有放错地方的资源。某化学兴趣小组对厨余垃圾中的鸡蛋壳进行再利用。主要实验步骤如下:
Ⅰ.鸡蛋壳预处理
将鸡蛋壳洗净干燥后研磨成粉,高温煅烧后加水得到石灰乳。
Ⅱ.制备葡萄糖酸钙
在石灰乳中边搅拌边缓缓加入葡萄糖酸溶液至pH为6~7,充分反应后过滤,将滤液蒸发浓缩、冷却结晶得到葡萄糖酸钙晶体。
Ⅲ.制备营养强化剂G
取3.00g葡萄糖酸钙晶体,用蒸馏水溶解,边搅拌边逐滴加入适量ZnSO4溶液,待反应完成后减压过滤;滤液转入烧杯中,加入适量95%乙醇,充分搅拌至晶体析出,减压过滤得到G的粗产物2.60g;将粗产物提纯后,得到G的晶体1.56g。
已知:①葡萄糖酸分子式为C6H12O7,结构简式为: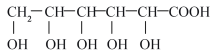
②提纯回收率指提纯后产物的质量占粗产物质量的百分比。
回答下列问题:
(1)步骤Ⅰ中研磨鸡蛋壳所需的仪器是_______ (选填“蒸发皿”“研钵”或“坩埚”)。
(2)步骤Ⅱ中用pH试纸测定溶液pH的操作方法是_______ 。
(3)步骤Ⅱ中涉及的化学反应方程式是_______ 。
(4)步骤Ⅲ中ZnSO4溶液需逐滴加入的目的是_______ ;提纯粗产物采用的方法是_______ 。
(5)下图中减压过滤装置是_______ (填标号);与常压过滤相比,减压过滤的优点是_______ 。

(6)营养强化剂G的名称是_______ ;G的提纯回收率是_______ %。
Ⅰ.鸡蛋壳预处理
将鸡蛋壳洗净干燥后研磨成粉,高温煅烧后加水得到石灰乳。
Ⅱ.制备葡萄糖酸钙
在石灰乳中边搅拌边缓缓加入葡萄糖酸溶液至pH为6~7,充分反应后过滤,将滤液蒸发浓缩、冷却结晶得到葡萄糖酸钙晶体。
Ⅲ.制备营养强化剂G
取3.00g葡萄糖酸钙晶体,用蒸馏水溶解,边搅拌边逐滴加入适量ZnSO4溶液,待反应完成后减压过滤;滤液转入烧杯中,加入适量95%乙醇,充分搅拌至晶体析出,减压过滤得到G的粗产物2.60g;将粗产物提纯后,得到G的晶体1.56g。
已知:①葡萄糖酸分子式为C6H12O7,结构简式为:
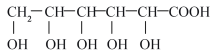
②提纯回收率指提纯后产物的质量占粗产物质量的百分比。
回答下列问题:
(1)步骤Ⅰ中研磨鸡蛋壳所需的仪器是
(2)步骤Ⅱ中用pH试纸测定溶液pH的操作方法是
(3)步骤Ⅱ中涉及的化学反应方程式是
(4)步骤Ⅲ中ZnSO4溶液需逐滴加入的目的是
(5)下图中减压过滤装置是

(6)营养强化剂G的名称是
您最近一年使用:0次
名校
解题方法
7 . 碘化钾( )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:
步骤Ⅰ:取含碘废液,调节溶液 为
为 ,加入一定量
,加入一定量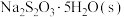 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;
步骤Ⅱ:在 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),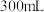 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约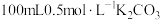 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;
步骤Ⅲ:用氢碘酸调滤液A的 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中的控温方法为___________ , 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为___________ 。
(2)步骤Ⅱ中铁粉转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)步骤Ⅲ中,仪器的名称是___________ ,现象是___________ 。
(4)产品中KI含量的测定
称取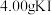 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入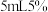 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。
①用 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是___________ ,在滴定时 溶液应盛放在
溶液应盛放在___________ (“酸式”或“碱式”)滴定管。
②样品中 的质量分数为
的质量分数为___________ 。
 )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:步骤Ⅰ:取含碘废液,调节溶液
 为
为 ,加入一定量
,加入一定量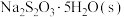 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;步骤Ⅱ:在
 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),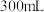 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约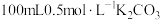 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;步骤Ⅲ:用氢碘酸调滤液A的
 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。回答下列问题:
(1)步骤Ⅰ中的控温方法为
 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为(2)步骤Ⅱ中铁粉转化为
 ,该反应的化学方程式为
,该反应的化学方程式为(3)步骤Ⅲ中,仪器的名称是
(4)产品中KI含量的测定
称取
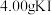 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入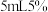 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。①用
 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是 溶液应盛放在
溶液应盛放在②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024-01-02更新
|
209次组卷
|
2卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
8 . 铁酸锌(ZnFe2O4)是一种重要的磁性材料与催化剂,实验室可以通过前驱固相法制备铁酸锌,具体步骤如下:
Ⅰ.7.840 g (NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)与2.870 g ZnSO4·7H2O(M=287 g·mol-1)溶于100 mL水中,加热至75℃。
Ⅱ.加热足量0.002 mol/L(NH4)2C2O4溶液到75℃与Ⅰ中溶液混合。
Ⅲ.将混合液在90-100℃加热搅拌5 min,生成固体前驱物[ZnFe2(C2O4)3·6H2O]。
Ⅳ.待混合溶液冷却进行过滤,用冷的蒸馏水洗涤。
Ⅴ.将过滤得到的固体前驱物干燥2 h,然后在700℃灼烧2 h,得到产品1.928 g。
(1)下列仪器在步骤Ⅰ中需使用的是___________ (填标号),无需使用的是___________ (填名称)。
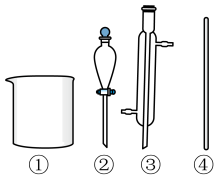
(2)步骤Ⅱ中采用的加热方式是___________ 加热。
(3)步骤Ⅲ中发生的离子反应方程式为___________ 。
(4)步骤Ⅳ中检验固体前驱物洗涤干净的操作和现象为___________ 。
(5)步骤Ⅴ中固体前驱物在高温条件下发生分解,生成三种无色气体,该反应的化学方程式为___________ 。
(6)本实验的产率为___________ 。
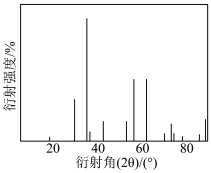
(7)将所得产品用X射线衍射法检测后,得到X射线衍射图谱如图所示,则ZnFe2O4属于___________ (填“晶体”或“非晶体”)。
Ⅰ.7.840 g (NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)与2.870 g ZnSO4·7H2O(M=287 g·mol-1)溶于100 mL水中,加热至75℃。
Ⅱ.加热足量0.002 mol/L(NH4)2C2O4溶液到75℃与Ⅰ中溶液混合。
Ⅲ.将混合液在90-100℃加热搅拌5 min,生成固体前驱物[ZnFe2(C2O4)3·6H2O]。
Ⅳ.待混合溶液冷却进行过滤,用冷的蒸馏水洗涤。
Ⅴ.将过滤得到的固体前驱物干燥2 h,然后在700℃灼烧2 h,得到产品1.928 g。
(1)下列仪器在步骤Ⅰ中需使用的是

(2)步骤Ⅱ中采用的加热方式是
(3)步骤Ⅲ中发生的离子反应方程式为
(4)步骤Ⅳ中检验固体前驱物洗涤干净的操作和现象为
(5)步骤Ⅴ中固体前驱物在高温条件下发生分解,生成三种无色气体,该反应的化学方程式为
(6)本实验的产率为
(7)将所得产品用X射线衍射法检测后,得到X射线衍射图谱如图所示,则ZnFe2O4属于

您最近一年使用:0次
名校
9 . 某小组为了探究硫酸的性质,设计如下实验:
回答下列问题:
(1)实验①没有明显现象的原因是___________ ;改变一个条件,为使实验①中的反应持续发生,改变条件是___________ 。
(2)为了引发实验②中的反应,宜采取的措施是___________ ;实验后,观察产物水溶液的颜色,其操作方法是___________ 。
(3)实验④产生的气体是___________ (填化学式),比较实验③和④可知,从氧化还原角度分析,H+的作用是___________ ;写出该反应的离子方程式:___________ 。
(4)向实验④所得溶液中加入过量NaOH溶液得到沉淀M,用元素分析仪分析,M为铜的氧化物,提纯干燥后的M在惰性气体氛围下加热,12 g M完全分解为10 g CuO。M的化学式为___________ ;M能与稀硫酸酸化的KI溶液反应生成白色沉淀CuI(碘化亚铜),在滤液中加入淀粉溶液,溶液变蓝色。写出M和稀硫酸酸化的KI溶液反应的离子方程式:___________ 。
| 序号 | 操作 | 现象 |
| ① | 常温下,在铁片中加入过量的浓硫酸 | 没有明显现象 |
| ② | 常温下,在铜片上加入过量的浓硫酸 | 没有明显现象 |
| ③ | 在铜和过量30%H2O2的混合溶液中加入Na2SO4溶液 | 没有明显现象 |
| ④ | 在铜和过量30%H2O2的混合溶液中加入稀硫酸 | 溶液变蓝色,并产生气泡 |
(1)实验①没有明显现象的原因是
(2)为了引发实验②中的反应,宜采取的措施是
(3)实验④产生的气体是
(4)向实验④所得溶液中加入过量NaOH溶液得到沉淀M,用元素分析仪分析,M为铜的氧化物,提纯干燥后的M在惰性气体氛围下加热,12 g M完全分解为10 g CuO。M的化学式为
您最近一年使用:0次
2023-10-22更新
|
73次组卷
|
4卷引用:贵州省部分中学2023-2024学年高三上学期第四次月考化学试题
解题方法
10 .  (三氯化六氨合钴)属于经典配合物,实验室以
(三氯化六氨合钴)属于经典配合物,实验室以 为原料制备
为原料制备 的方法和过程如下:
的方法和过程如下:
Ⅰ.制备 。
。
已知:钴单质与氯气在加热条件下反应可制得纯净 ,钴单质在300℃以上易被氧气氧化;
,钴单质在300℃以上易被氧气氧化; 的熔点为86℃,易潮解。
的熔点为86℃,易潮解。
制备装置如图:
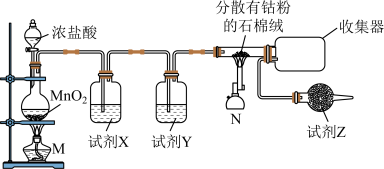
(1)试剂X是___________ ;试剂Z的作用为___________ 。
(2)上述装置制取氯气的化学方程式为___________ 。
Ⅱ.制备 ——配合、氧化。
——配合、氧化。
步骤ⅰ:在锥形瓶中,将4g 固体溶于8.4mL水中,再加入6g研细的
固体溶于8.4mL水中,再加入6g研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。
步骤ⅱ:将上述混合溶液转移至三颈烧瓶中,加入研细的活性炭和浓氨水,再逐滴加入 溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
(3)滴加 时若速度过快,产物中会含有
时若速度过快,产物中会含有 杂质,原因为
杂质,原因为___________ 。
(4)水浴加热温度控制在50~60℃,温度不宜过高的原因是___________ 。
Ⅲ.测定 产品纯度。
产品纯度。
(5)用如图装置测定产品中 的含量(部分装置已省略):
的含量(部分装置已省略):

①蒸氨:取 样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的
样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的 通入盛有
通入盛有
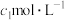
 标准溶液的锥形瓶中。液封装置2的作用是
标准溶液的锥形瓶中。液封装置2的作用是___________ 。
②滴定:将液封装置2中的水倒入锥形瓶后,使用甲基橙作指示剂,用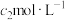
 溶液滴定剩余的
溶液滴定剩余的 ,到达滴定终点时消耗
,到达滴定终点时消耗
 溶液。滴定终点的现象为
溶液。滴定终点的现象为___________ 。
 (三氯化六氨合钴)属于经典配合物,实验室以
(三氯化六氨合钴)属于经典配合物,实验室以 为原料制备
为原料制备 的方法和过程如下:
的方法和过程如下:Ⅰ.制备
 。
。已知:钴单质与氯气在加热条件下反应可制得纯净
 ,钴单质在300℃以上易被氧气氧化;
,钴单质在300℃以上易被氧气氧化; 的熔点为86℃,易潮解。
的熔点为86℃,易潮解。制备装置如图:

(1)试剂X是
(2)上述装置制取氯气的化学方程式为
Ⅱ.制备
 ——配合、氧化。
——配合、氧化。步骤ⅰ:在锥形瓶中,将4g
 固体溶于8.4mL水中,再加入6g研细的
固体溶于8.4mL水中,再加入6g研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。步骤ⅱ:将上述混合溶液转移至三颈烧瓶中,加入研细的活性炭和浓氨水,再逐滴加入
 溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。(3)滴加
 时若速度过快,产物中会含有
时若速度过快,产物中会含有 杂质,原因为
杂质,原因为(4)水浴加热温度控制在50~60℃,温度不宜过高的原因是
Ⅲ.测定
 产品纯度。
产品纯度。(5)用如图装置测定产品中
 的含量(部分装置已省略):
的含量(部分装置已省略):
①蒸氨:取
 样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的
样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的 通入盛有
通入盛有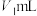
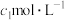
 标准溶液的锥形瓶中。液封装置2的作用是
标准溶液的锥形瓶中。液封装置2的作用是②滴定:将液封装置2中的水倒入锥形瓶后,使用甲基橙作指示剂,用
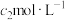
 溶液滴定剩余的
溶液滴定剩余的 ,到达滴定终点时消耗
,到达滴定终点时消耗
 溶液。滴定终点的现象为
溶液。滴定终点的现象为
您最近一年使用:0次



