1 . 三氯甲苯(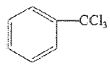 )可用于制取农药、染料等有机物,可利用甲苯的取代反应进行制备。
)可用于制取农药、染料等有机物,可利用甲苯的取代反应进行制备。
物质 | 熔点/℃ | 沸点/℃ | 密度/g· | 摩尔质量/g· |
甲苯 | -94.9 | 110.6 | 0.87 | 92 |
三氯甲苯 | -7.5 | 219.0 | 1.36 | 195.5 |
如图组装实验仪器,检验装置气密性后将138.0mL甲苯加入N中,__________,加热至100~110℃后通氯气反应1h。

(1)仪器N的名称是
(2)将甲苯加入三颈烧瓶后的操作是
(3)实验时,
(4)该实验采用
(5)反应结束后,混合溶液用
①蒸馏水 ②饱和
 溶液 ③饱和
溶液 ③饱和 溶液
溶液(6)粗产品经蒸馏后得138.0g三氯甲苯。该反应的产率最接近于
A.30% B.50% C.70%
您最近一年使用:0次
2024-05-30更新
|
177次组卷
|
3卷引用:湖北省黄冈中学2024届高三下学期5月第三次模拟考试化学试题
解题方法
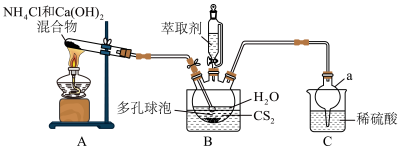
2 . 硫脲 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。
(1)仪器a的名称为__________ 。
(2)从结构角度分析,硫脲可溶于水的原因是__________ 。
(3)多孔球泡的作用是__________ 。
(4)B中反应完全的标志是__________ 。
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为__________ (填标号)。
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:
取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为__________ 。
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成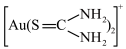 ,反应的离子方程式为
,反应的离子方程式为_______ 。溶解金的过程伴随着溶液变红的现象,原因可能为硫脲发生异构化生成__________ (填化学式)。
 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。
(1)仪器a的名称为
(2)从结构角度分析,硫脲可溶于水的原因是
(3)多孔球泡的作用是
(4)B中反应完全的标志是
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:

取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成
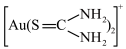 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
2024-05-29更新
|
172次组卷
|
3卷引用:湖北省武汉市2024届高三毕业生四月调研考试(二模)化学试题
3 . 环己酮(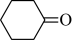 )是重要的化工原料和有机溶剂,可用于制造合成橡胶、合成纤维和药品等。实验室用次氯酸钠氧化法制备环已酮的原理与操作流程如下。
)是重要的化工原料和有机溶剂,可用于制造合成橡胶、合成纤维和药品等。实验室用次氯酸钠氧化法制备环已酮的原理与操作流程如下。
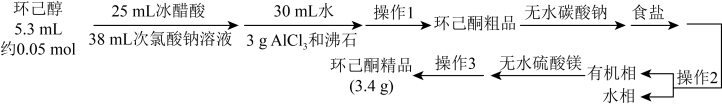
①环己酮的密度比水的密度小,能与水形成恒沸混合物,沸点为95℃。
②31℃时,环己酮在水中的溶解度为2.4 g。
回答下列问题:
(1)环己醇与次氯酸钠溶液反应的离子方程式为
(2)“操作1”和“操作3”是蒸馏,其蒸馏装置中用到的冷凝管是
A.  B.
B.  C.
C. 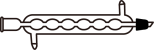
(4)实验中加入无水硫酸镁的目的是
(5)制备环己酮粗品时:
①加入次氯酸钠溶液后,用淀粉-碘化钾试纸检验,试纸应呈蓝色,否则应再补加次氯酸钠溶液,其目的是
②次氯酸钠溶液的浓度可用间接碘量法测定。用移液管移取10.00mL次氯酸钠溶液于500mL容量瓶中,加蒸馏水至刻度线,摇匀后移取25.00mL该溶液于250mL锥形瓶中,加入50mL0.1 mol·L-1盐酸和2g碘化钾,用0.1mol·L-1硫代硫酸钠标准溶液滴定析出的碘。在滴定接近终点时加入1mL0.2%淀粉溶液。析出碘的反应的离子方程式为
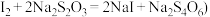
(6)本实验环己酮的产率最接近_______(填字母)。
| A.50% | B.60% | C.70% | D.80% |
您最近一年使用:0次
解题方法
4 . 某实验小组设计一体化实验,通过量气法测定阿伏加德罗常数,同时制得 并探究其性质.回答下列问题:
并探究其性质.回答下列问题:
I.测定阿伏加德罗常数同时制得 .实验装置如图所示:
.实验装置如图所示:___________ ,阴极发生的电极反应式是___________ ;
(2)烧杯中最终会看到___________ 色沉淀;
(3)在一定电流强度下电解一段时间,收集到的气体体积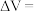
___________  (用含
(用含 的式子表示).将
的式子表示).将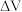 换算成标准状况下的体积记为
换算成标准状况下的体积记为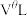 ,已知电路中通过的总电量为
,已知电路中通过的总电量为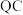 ,1个电子所带的电量为
,1个电子所带的电量为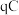 ,则阿伏伽德罗常数
,则阿伏伽德罗常数
___________ (用含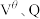 和q的表达式表示)。
和q的表达式表示)。
Ⅱ.探究 的性质.实验小组将上述电解得到的产物
的性质.实验小组将上述电解得到的产物 洗涤干净后,进行如下实验:
洗涤干净后,进行如下实验: 白色,
白色,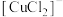 无色,
无色, 黄色.
黄色.
(4)检验电解产物 洗净需要用到的试剂是
洗净需要用到的试剂是___________ ;
(5)解释溶液颜色由无色变为黄色的原因___________ (用离子方程式表示);
Ⅲ.测量电解产物 的含量。
的含量。
(6)称取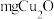 样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性
样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性 溶液,使
溶液,使 全部转化为
全部转化为 ,加入过量
,加入过量 溶液,然后用
溶液,然后用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 .(己知:
.(己知: )
)
则测得电解产物中 的含量为
的含量为___________  。
。
 并探究其性质.回答下列问题:
并探究其性质.回答下列问题:I.测定阿伏加德罗常数同时制得
 .实验装置如图所示:
.实验装置如图所示:
(2)烧杯中最终会看到
(3)在一定电流强度下电解一段时间,收集到的气体体积
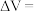
 (用含
(用含 的式子表示).将
的式子表示).将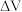 换算成标准状况下的体积记为
换算成标准状况下的体积记为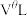 ,已知电路中通过的总电量为
,已知电路中通过的总电量为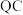 ,1个电子所带的电量为
,1个电子所带的电量为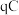 ,则阿伏伽德罗常数
,则阿伏伽德罗常数
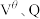 和q的表达式表示)。
和q的表达式表示)。Ⅱ.探究
 的性质.实验小组将上述电解得到的产物
的性质.实验小组将上述电解得到的产物 洗涤干净后,进行如下实验:
洗涤干净后,进行如下实验: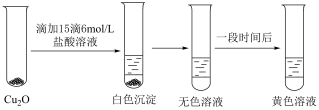
 白色,
白色,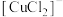 无色,
无色, 黄色.
黄色.(4)检验电解产物
 洗净需要用到的试剂是
洗净需要用到的试剂是(5)解释溶液颜色由无色变为黄色的原因
Ⅲ.测量电解产物
 的含量。
的含量。(6)称取
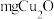 样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性
样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性 溶液,使
溶液,使 全部转化为
全部转化为 ,加入过量
,加入过量 溶液,然后用
溶液,然后用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 .(己知:
.(己知: )
)则测得电解产物中
 的含量为
的含量为 。
。
您最近一年使用:0次
名校
解题方法
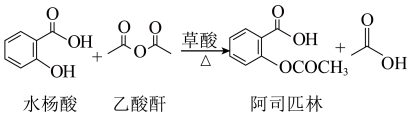
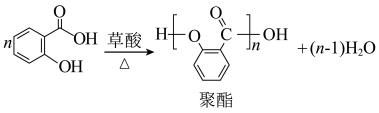
5 . 乙酰水杨酸(俗称阿司匹林),是常用的解热镇痛药。实验室选择草酸绿色催化剂制备阿司匹林。
【实验原理】
主反应:
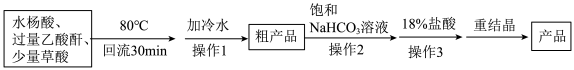
【实验流程】
(1)制备过程中采用的合适加热方式是______ 。
(2)“加冷水”后,发生反应的化学方程式为______ 。
(3)“操作2”中加入饱和 溶液的目的是
溶液的目的是______ 。
(4)“操作3”中缓慢加入过量18%的盐酸,充分搅拌直至______ (填现象变化),再冷却结晶。
(5)为检验所获得的产品中是否含有水杨酸,可选用的试剂为______ 。
(6)为提高产品的产率,下列装置可能会用到的有______ 。 ,则该产品的纯度是
,则该产品的纯度是_____________ (以质量分数表示)。
【实验原理】
主反应:
| 名词 | 熔点/℃ | 溶解性 |
| 水杨酸 | 157~159 | 溶于水和乙醇 |
| 乙酸酐 | -73.1 | 易水解 |
| 乙酰水杨酸 | 135 | 微溶冷水,可溶热水,易溶于乙醇 |
(1)制备过程中采用的合适加热方式是
(2)“加冷水”后,发生反应的化学方程式为
(3)“操作2”中加入饱和
 溶液的目的是
溶液的目的是(4)“操作3”中缓慢加入过量18%的盐酸,充分搅拌直至
(5)为检验所获得的产品中是否含有水杨酸,可选用的试剂为
(6)为提高产品的产率,下列装置可能会用到的有
 ,则该产品的纯度是
,则该产品的纯度是
您最近一年使用:0次
2024-04-11更新
|
483次组卷
|
2卷引用:湖北省圆创联盟2024届高三三月联合测评(一模)化学试卷
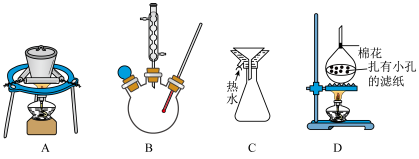
6 . 磺酰胺[SO2(NH2)2]易溶于醇,溶于热水,不溶于冷水,在酸性、中性、碱性水溶液中性质稳定,主要用于制造医药、农药、染料等。制备磺酰胺的装置如下,其原理为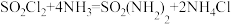 。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。
。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。
Ⅰ.磺酰胺的制备____________ 。
(2)装置B中盛放的试剂为____________ (填字母)。
a.碱石灰 b.浓硫酸 c.P2O5 d.无水CaCl2
(3)写出 SO2Cl2水解的化学方程式:____________ 。
(4)装置C中多孔球泡的作用是____________ 。
Ⅱ.用如下装置测定产品SO2(NH2)2的含量(假设只含NH4Cl杂质,部分装置已省略)____________ ,单向阀的作用是____________ 。
(6)滴定:将液封装置2中的水放入锥形瓶中,再将锥形瓶中的溶液倒入容量瓶中配制成500 mL的溶液,取20 mL溶液用c2 mol/L的NaOH标准溶液滴定过量的H2SO4,共消耗NaOH标准溶液V2 mL,产品中SO2(NH2)2的含量是____________ (列出计算式)。
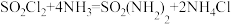 。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。
。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。Ⅰ.磺酰胺的制备

(2)装置B中盛放的试剂为
a.碱石灰 b.浓硫酸 c.P2O5 d.无水CaCl2
(3)写出 SO2Cl2水解的化学方程式:
(4)装置C中多孔球泡的作用是
Ⅱ.用如下装置测定产品SO2(NH2)2的含量(假设只含NH4Cl杂质,部分装置已省略)
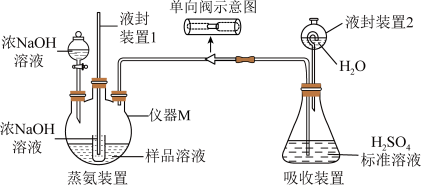
(6)滴定:将液封装置2中的水放入锥形瓶中,再将锥形瓶中的溶液倒入容量瓶中配制成500 mL的溶液,取20 mL溶液用c2 mol/L的NaOH标准溶液滴定过量的H2SO4,共消耗NaOH标准溶液V2 mL,产品中SO2(NH2)2的含量是
您最近一年使用:0次
2024-03-21更新
|
599次组卷
|
6卷引用:湖北省黄冈中学2024届高三下学期5月第二次模拟考试化学试卷
湖北省黄冈中学2024届高三下学期5月第二次模拟考试化学试卷黑龙江省部分学校2024届高三第二次模拟考试化学试题2024届云南省楚雄彝族自治州高三下学期二模理综试题-高中化学(已下线)提升练08 化学实验综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题黑龙江省牡丹江市第二高级中学2023-2024学年高三下学期考前热身卷化学(一)
名校
7 . DMSO( )是一种无色粘稠液体,广泛用作溶剂和反应试剂。实验模拟“
)是一种无色粘稠液体,广泛用作溶剂和反应试剂。实验模拟“ 氧化法”制备DMSO粗品的装置如图所示(部分夹持和加热装置省略)。
氧化法”制备DMSO粗品的装置如图所示(部分夹持和加热装置省略)。

已知:Ⅰ.DMSO与 的相关数据如下表
的相关数据如下表
Ⅱ. 微热易分解为NO、
微热易分解为NO、 和
和 。
。
实验过程:①连接好装置,检查装置的气密性,装好药品。打开活塞b,通入 ,打开活塞a,滴加稀硫酸,微热三颈烧瓶A。将A仪器中制得的足量气体通入31.00mL二甲基硫醚中,控制温度为60~80℃,反应一段时间得到DMSO粗品,
,打开活塞a,滴加稀硫酸,微热三颈烧瓶A。将A仪器中制得的足量气体通入31.00mL二甲基硫醚中,控制温度为60~80℃,反应一段时间得到DMSO粗品,
②粗品经减压蒸馏后共收集到24.11mLDMSO纯品。
回答下列问题:
(1)B中盛放的试剂是______ (填名称);仪器X的进水口为______ (填“d”或“c”)口。
(2)多孔球泡的主要作用是______ 。
(3)关闭活塞b,装置A中产生的气体通入装置C中发生反应后,气体成分不变。生成DMSO的化学方程式是______ 。
(4)D装置吸收尾气的优点是______ 。
(5)实验中通入过量 的目的是
的目的是______ (答两点)。
(6)DMSO被誉为“万能溶剂”,其易溶于水的主要原因是______ 。
(7)本实验的产率是______ %(结果保留2位小数)。
 )是一种无色粘稠液体,广泛用作溶剂和反应试剂。实验模拟“
)是一种无色粘稠液体,广泛用作溶剂和反应试剂。实验模拟“ 氧化法”制备DMSO粗品的装置如图所示(部分夹持和加热装置省略)。
氧化法”制备DMSO粗品的装置如图所示(部分夹持和加热装置省略)。
已知:Ⅰ.DMSO与
 的相关数据如下表
的相关数据如下表相对分子质量 | 熔点 | 沸点 | 密度 | |
DMSO | 78 | 18.4℃ | 189℃ | 1.10 |
| 62 | -83.2℃ | 37.5℃ | 0.85 |
 微热易分解为NO、
微热易分解为NO、 和
和 。
。实验过程:①连接好装置,检查装置的气密性,装好药品。打开活塞b,通入
 ,打开活塞a,滴加稀硫酸,微热三颈烧瓶A。将A仪器中制得的足量气体通入31.00mL二甲基硫醚中,控制温度为60~80℃,反应一段时间得到DMSO粗品,
,打开活塞a,滴加稀硫酸,微热三颈烧瓶A。将A仪器中制得的足量气体通入31.00mL二甲基硫醚中,控制温度为60~80℃,反应一段时间得到DMSO粗品,②粗品经减压蒸馏后共收集到24.11mLDMSO纯品。
回答下列问题:
(1)B中盛放的试剂是
(2)多孔球泡的主要作用是
(3)关闭活塞b,装置A中产生的气体通入装置C中发生反应后,气体成分不变。生成DMSO的化学方程式是
(4)D装置吸收尾气的优点是
(5)实验中通入过量
 的目的是
的目的是(6)DMSO被誉为“万能溶剂”,其易溶于水的主要原因是
(7)本实验的产率是
您最近一年使用:0次
名校
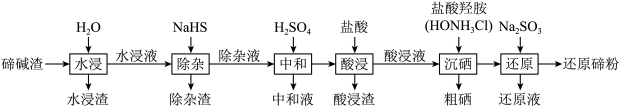
8 . 硒和碲是重要的稀散元素,都可以作为半导体材料。一种从碲碱渣(碲和硒的含量较高,还含有少量Cu、Pb等元素)分离硒回收碲的工艺流程如下: 、
、 及少量可溶性的铜、铅化合物等。
及少量可溶性的铜、铅化合物等。
② 为两性氧化物,微溶于水。
为两性氧化物,微溶于水。
③亚硒酸为二元弱酸,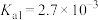
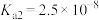
回答下列问题:
(1)硒与氧同族,基态Se原子价电子排布式为______ 。
(2)“除杂渣”的主要成分为______ 。
(3)“中和”时控制pH为4~5,生成 沉淀,若硫酸过量,将导致Te的回收率下降的原因是
沉淀,若硫酸过量,将导致Te的回收率下降的原因是______ 。
(4)“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的pH为2,此时溶液中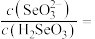
______ 。
(5)“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式______ 。
(6)碘量法测定“粗硒”中硒的含量,过程如下:
取0.1000g粗硒,加入足量硫酸和硝酸,充分反应生成 ,再加热至90℃使过量的硝酸挥发;继续向
,再加热至90℃使过量的硝酸挥发;继续向 溶液中加入过量的KI溶液,生成Se和
溶液中加入过量的KI溶液,生成Se和 ;然后滴入2滴淀粉溶液,用0.4000mol/L
;然后滴入2滴淀粉溶液,用0.4000mol/L 溶液滴定(
溶液滴定( )。重复上述操作2次,消耗的
)。重复上述操作2次,消耗的 溶液的平均体积为12.50mL。①判断滴定至终点的方法是
溶液的平均体积为12.50mL。①判断滴定至终点的方法是______ 。
②该粗硒的纯度为______ 。
 、
、 及少量可溶性的铜、铅化合物等。
及少量可溶性的铜、铅化合物等。②
 为两性氧化物,微溶于水。
为两性氧化物,微溶于水。③亚硒酸为二元弱酸,
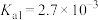
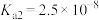
回答下列问题:
(1)硒与氧同族,基态Se原子价电子排布式为
(2)“除杂渣”的主要成分为
(3)“中和”时控制pH为4~5,生成
 沉淀,若硫酸过量,将导致Te的回收率下降的原因是
沉淀,若硫酸过量,将导致Te的回收率下降的原因是(4)“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的pH为2,此时溶液中
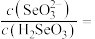
(5)“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式
(6)碘量法测定“粗硒”中硒的含量,过程如下:
取0.1000g粗硒,加入足量硫酸和硝酸,充分反应生成
 ,再加热至90℃使过量的硝酸挥发;继续向
,再加热至90℃使过量的硝酸挥发;继续向 溶液中加入过量的KI溶液,生成Se和
溶液中加入过量的KI溶液,生成Se和 ;然后滴入2滴淀粉溶液,用0.4000mol/L
;然后滴入2滴淀粉溶液,用0.4000mol/L 溶液滴定(
溶液滴定( )。重复上述操作2次,消耗的
)。重复上述操作2次,消耗的 溶液的平均体积为12.50mL。①判断滴定至终点的方法是
溶液的平均体积为12.50mL。①判断滴定至终点的方法是②该粗硒的纯度为
您最近一年使用:0次
2024-03-17更新
|
428次组卷
|
2卷引用:湖北省七市州教科研协作体2024届高三下学期二模化学试题
9 . 碱式碳酸铜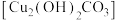 俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
Ⅰ.配制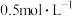 CuSO4溶液和
CuSO4溶液和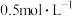 Na2CO3溶液各500 mL
Na2CO3溶液各500 mL
Ⅱ.探究CuSO4溶液和Na2CO3溶液的合适配比
取10 mL CuSO4溶液,按照不同的CuSO4和Na2CO3的物质的量之比进行混合,在合适温度的水浴锅中搅拌反应,沉淀生成的速率、颜色和质量如下表所示:
Ⅲ.探究反应的温度
取30 mL CuSO4溶液,选择合适配比的CuSO4和Na2CO3溶液混合均匀,分别放在不同温度的水浴锅中反应,沉淀生成的速率、颜色和质量如下表所示:
Ⅳ.碱式碳酸铜的制备
取60 mL CuSO4溶液,根据上面实验确定的反应物最合适比例及最适宜温度制取产物,待沉淀完全后减压过滤,洗涤,干燥。
回答下列问题
(1)步骤Ⅰ中,配制 CuSO4溶液时,不需要使用下列仪器中的
CuSO4溶液时,不需要使用下列仪器中的___________ (填仪器名称),还需要补充的玻璃仪器是___________ 。(填仪器名称)___________ ;反应产生“绿色沉淀”碱式碳酸铜的离子反应方程式为___________ 。
(3)步骤Ⅱ中产生蓝色沉淀的成分是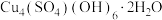 ,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是
,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是___________ 。
(4)步骤Ⅲ中反应的最适宜温度应为___________ ,“实验组⑧”中产物沉淀“绿色偏暗”的原因可能是___________ 。
(5)步骤Ⅳ中检验沉淀是否洗净的操作为___________ 。
(6)计算产品含铜量。称取0.5 g样品于100 mL小烧杯中,加入20 mL蒸馏水,再加入0.8 mL 6 mol/L的硫酸使其完全溶解,冷却至室温后,转移到250 mL容量瓶中,定容,摇匀。取20.00 mL上述配好的溶液与过量KI完全反应后,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜的质量分数为___________ (已知 ,
, )。
)。
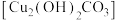 俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:Ⅰ.配制
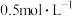 CuSO4溶液和
CuSO4溶液和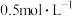 Na2CO3溶液各500 mL
Na2CO3溶液各500 mLⅡ.探究CuSO4溶液和Na2CO3溶液的合适配比
取10 mL CuSO4溶液,按照不同的CuSO4和Na2CO3的物质的量之比进行混合,在合适温度的水浴锅中搅拌反应,沉淀生成的速率、颜色和质量如下表所示:
| 实验组 | ① | ② | ③ | ④ |
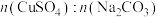 | 1:0.8 | 1:1 | 1:1.2 | 1:1.4 |
| 沉淀生成速率 | 最慢 | 较慢 | 快 | 很快 |
| 产物沉淀量/g | 0.501 | 0.428 | 0.549 | 0.527 |
| 沉淀颜色 | 蓝色 | 蓝色 | 绿色 | 绿色 |
取30 mL CuSO4溶液,选择合适配比的CuSO4和Na2CO3溶液混合均匀,分别放在不同温度的水浴锅中反应,沉淀生成的速率、颜色和质量如下表所示:
| 实验组 | ⑤ | ⑥ | ⑦ | ⑧ |
| 温度/℃ | 25 | 65 | 75 | 85 |
| 沉淀生成速率 | 最慢 | 较慢 | 快 | 很快 |
| 产物沉淀量/g | 无 | 1.303 | 1.451 | 1.28 |
| 沉淀颜色 | 蓝色 | 绿色 | 绿色 | 绿色(偏暗) |
取60 mL CuSO4溶液,根据上面实验确定的反应物最合适比例及最适宜温度制取产物,待沉淀完全后减压过滤,洗涤,干燥。
回答下列问题
(1)步骤Ⅰ中,配制
 CuSO4溶液时,不需要使用下列仪器中的
CuSO4溶液时,不需要使用下列仪器中的

(3)步骤Ⅱ中产生蓝色沉淀的成分是
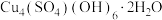 ,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是
,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是(4)步骤Ⅲ中反应的最适宜温度应为
(5)步骤Ⅳ中检验沉淀是否洗净的操作为
(6)计算产品含铜量。称取0.5 g样品于100 mL小烧杯中,加入20 mL蒸馏水,再加入0.8 mL 6 mol/L的硫酸使其完全溶解,冷却至室温后,转移到250 mL容量瓶中,定容,摇匀。取20.00 mL上述配好的溶液与过量KI完全反应后,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜的质量分数为
 ,
, )。
)。
您最近一年使用:0次
名校
解题方法
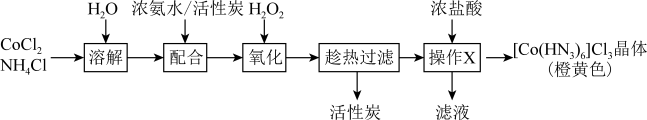
10 . 三氯化六氨合钴([Co(NH3)6] Cl3)是一种重要的化工产品。实验室以 为原料制备三氯六氨合钴的方法如下,回答下列问题:
为原料制备三氯六氨合钴的方法如下,回答下列问题:
Ⅰ.制备氯化钴
已知 易潮解,可用高熔点金属钴与氯气反应制取。实验室提供下图装置进行组合(连接用橡胶管省略):
易潮解,可用高熔点金属钴与氯气反应制取。实验室提供下图装置进行组合(连接用橡胶管省略):___________ 。
(2)装置C中试剂Y为___________ 。
(3)球形干燥管中试剂的作用为___________ 。
Ⅱ.制备三氯化六氨合钴___________ 。
(5)利用CoCl2、NH4Cl、浓氨水、 制备[Co(NH3)6] Cl3的总反应化学方程式为
制备[Co(NH3)6] Cl3的总反应化学方程式为___________ 。
(6)操作 中,加入浓盐酸的作用是
中,加入浓盐酸的作用是___________ 。
Ⅲ.测定钴含量
准确称量3.0000g样品[Co(NH3)6]Cl3,加入 溶液至样品恰好完全溶解,配成250mL溶液。已知Co3+将
溶液至样品恰好完全溶解,配成250mL溶液。已知Co3+将 氧化成
氧化成 ,自身被还原成
,自身被还原成 ,用淀粉溶液作指示剂,用0.1000mol/L
,用淀粉溶液作指示剂,用0.1000mol/L 溶液滴定生成的
溶液滴定生成的 ,消耗
,消耗 溶液的体积如下(已知:
溶液的体积如下(已知: )。
)。
(7)计算样品中钴元素的质量分数为___________  (保留至小数点后两位)。
(保留至小数点后两位)。
 为原料制备三氯六氨合钴的方法如下,回答下列问题:
为原料制备三氯六氨合钴的方法如下,回答下列问题:Ⅰ.制备氯化钴
已知
 易潮解,可用高熔点金属钴与氯气反应制取。实验室提供下图装置进行组合(连接用橡胶管省略):
易潮解,可用高熔点金属钴与氯气反应制取。实验室提供下图装置进行组合(连接用橡胶管省略):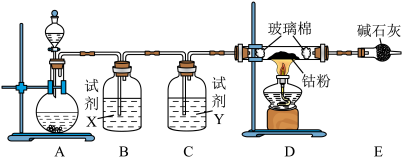
(2)装置C中试剂Y为
(3)球形干燥管中试剂的作用为
Ⅱ.制备三氯化六氨合钴
(5)利用CoCl2、NH4Cl、浓氨水、
 制备[Co(NH3)6] Cl3的总反应化学方程式为
制备[Co(NH3)6] Cl3的总反应化学方程式为(6)操作
 中,加入浓盐酸的作用是
中,加入浓盐酸的作用是Ⅲ.测定钴含量
准确称量3.0000g样品[Co(NH3)6]Cl3,加入
 溶液至样品恰好完全溶解,配成250mL溶液。已知Co3+将
溶液至样品恰好完全溶解,配成250mL溶液。已知Co3+将 氧化成
氧化成 ,自身被还原成
,自身被还原成 ,用淀粉溶液作指示剂,用0.1000mol/L
,用淀粉溶液作指示剂,用0.1000mol/L 溶液滴定生成的
溶液滴定生成的 ,消耗
,消耗 溶液的体积如下(已知:
溶液的体积如下(已知: )。
)。| 滴定次数 | 待测溶液的体积 | 消耗标准溶液的体积 | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 11.00 |
| 2 | 25.00 | 11.00 | 21.01 |
| 3 | 25.00 | 21.01 | 31.00 |
(7)计算样品中钴元素的质量分数为
 (保留至小数点后两位)。
(保留至小数点后两位)。
您最近一年使用:0次
2024-01-25更新
|
400次组卷
|
2卷引用:湖北省宜荆荆随恩2023-2024学年高三上学期1月联考化学试题






