12-13高一·全国·课时练习
解题方法
1 . 化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性良好)。请回答:
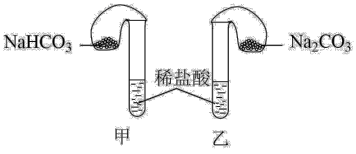
(1)各组反应开始时,____________ (甲、乙)装置中的气球体积先变大,该装置中反应的化学反应方程式是_____________ 。
(2)当试管中不再有气体生成时,三组实验出现不同现象,试分析原因并填写下表的空格。

(1)各组反应开始时,
(2)当试管中不再有气体生成时,三组实验出现不同现象,试分析原因并填写下表的空格。
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第①组 | 0.42gNaHCO3 0.53gNa2CO3 3mL 4mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V甲(CO2)= V乙(CO2) |
| 第②组 | 0.3gNaHCO3 0.3gNa2CO3 3mL 4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | A: |
| 第③组 | 0.6gNaHCO3 0.6gNa2CO3 3mL 2 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | B: |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用化学方程式表示) C: |
您最近一年使用:0次
名校
2 . 乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:


实验步骤:
①在A中加入4.4g的异戊醇、6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。
②反应结束后,将反应液冷却至室温再倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤并分液。
③在分出的有机相中加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是_______ 。
(2)在洗涤操作中,第一次水洗的主要目的是_______ ,第二次水洗的主要目的是_______ 。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_______ (填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酣从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_______ 。
(5)在蒸馏操作中,仪器选择及安装都正确的是_______ (填标号)。
a. b.
b. c.
c. d.
d.
(6)本实验的产率是_______ 。

| 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

实验步骤:
①在A中加入4.4g的异戊醇、6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。
②反应结束后,将反应液冷却至室温再倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤并分液。
③在分出的有机相中加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是
(2)在洗涤操作中,第一次水洗的主要目的是
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酣从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是
(5)在蒸馏操作中,仪器选择及安装都正确的是
a.
 b.
b. c.
c. d.
d.
(6)本实验的产率是
您最近一年使用:0次
2022-06-06更新
|
226次组卷
|
2卷引用:(人教2019)选择性必修3第三章 第四节 羧酸 羧酸衍生物 课时2
2014·北京海淀·二模
名校
3 . 研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。

(1)仪器A的名称为______ ;A中反应的离子方程式为_______ 。
(2)甲同学将A中产生的气体通入下列溶液:
①实验a中的现象为 ___ 。
②不能证明产生的气体中含有HCl的实验是__ (填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因:___________ 。
(4)已知:2S2O +I2=S4O
+I2=S4O + 2I - 。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
+ 2I - 。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl 2 。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 molL -1 Na2O3 溶液滴定生成的I2,达滴定终点时消耗Na2 S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 molL -1 AgNO3 溶液滴定所得溶液中的Cl-。X中的HClO不会影响I的测定结果,原因是__ 。由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 molL -1 AgNO3 溶液的体积应大于 __ mL(用含V的代数式表示)。

(1)仪器A的名称为
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | |
| b | AgNO3 溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有HCl的实验是
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因:
(4)已知:2S2O
 +I2=S4O
+I2=S4O + 2I - 。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
+ 2I - 。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。 I.测定X中溶解的Cl 2 。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 molL -1 Na2O3 溶液滴定生成的I2,达滴定终点时消耗Na2 S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 molL -1 AgNO3 溶液滴定所得溶液中的Cl-。X中的HClO不会影响I的测定结果,原因是
您最近一年使用:0次
2016-12-09更新
|
1273次组卷
|
3卷引用:2013-2014北京市海淀区高三第二学期二模理综化学试卷
(已下线)2013-2014北京市海淀区高三第二学期二模理综化学试卷北京市清华大学附属中学2018届高三10月月考化学试题人教版2017-2018学年高一化学必修1:4.2 富集在海水中的元素-氯 同步测试2
名校
4 . 某科学小组制备硝基苯的实验装置如图,有关信息如下表:
实验步骤如下:
取100 mL烧杯,用20 mL浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心地加入B中。把0.2mol(15.6 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,使溶液混合均匀。在50~60 °C下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 °C馏分,得到纯硝基苯18g。
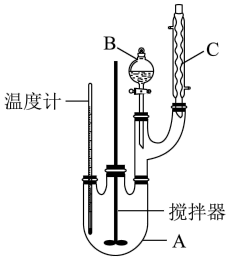
回答下列问题:
(1)图中B仪器的名称为___________ ,图 中装置C的作用是___________ 。
(2)制备硝基苯的化学方程式为___________ 。
(3)为了使反应在50~60°C下进行,常用的加热方式是___________ 。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是___________ (用化学方程式说明),实验室常用氢氧化钠溶液除去该有色物质,涉及的离子方程式为___________ 。
(4)将粗产品置于分液漏斗中加水,振荡后静置,产物应在___________ (填“ 上”或“下”)层。
(5)本实验所得到的硝基苯的产率是___________ (结果保留 3位有效数字)。
| 物质 | 熔点/°C | 沸点/°C | 密度 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 不溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | — | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | — | 338 | 1.84 | 易溶于水 |
取100 mL烧杯,用20 mL浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心地加入B中。把0.2mol(15.6 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,使溶液混合均匀。在50~60 °C下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 °C馏分,得到纯硝基苯18g。

回答下列问题:
(1)图中B仪器的名称为
(2)制备硝基苯的化学方程式为
(3)为了使反应在50~60°C下进行,常用的加热方式是
(4)将粗产品置于分液漏斗中加水,振荡后静置,产物应在
(5)本实验所得到的硝基苯的产率是
您最近一年使用:0次
2022-06-01更新
|
450次组卷
|
3卷引用:江苏省泰州中学2021-2022学年高一下学期第二次月度检测化学试题
江苏省泰州中学2021-2022学年高一下学期第二次月度检测化学试题(已下线)【知识图鉴】单元讲练测选择性必修3第2单元02基础练广东省深圳市龙岗区德琳学校2021-2022学年高二下学期期中考试化学试题
解题方法
5 . 某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电离率。饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%

甲方案:利用甲、乙装置测定饱和食盐水的电解率
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的U形管左端的实验现象为_____ ; 该电解池总反应的化学方程式为_______ ;
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为________ 连______ (填A、B、C、D、E等导管口),则洗气瓶a中发生反应的离子方程式为_______ ;
乙方案:利用甲、丙装置测定饱和食盐水的电解率
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率。
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则该干燥装置应与______ 口连接(填A、B、C、D、E等导管口)。
②另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?_____ (填“同意”或“不同意”)请说明理由 ____ 。
丙方案:只利用甲装置测定饱和食盐水的电解率
(4)若电解150mL饱和食盐水一段时间,测得溶液的pH为14,求饱和食盐水的电解率_______ (保留一位小数,假设电解前后溶液体积不变,饱和食盐水密度约为1.33g/mL,溶解度为36.0g)。

甲方案:利用甲、乙装置测定饱和食盐水的电解率
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的U形管左端的实验现象为
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为
乙方案:利用甲、丙装置测定饱和食盐水的电解率
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率。
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则该干燥装置应与
②另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?
丙方案:只利用甲装置测定饱和食盐水的电解率
(4)若电解150mL饱和食盐水一段时间,测得溶液的pH为14,求饱和食盐水的电解率
您最近一年使用:0次
2016-12-09更新
|
545次组卷
|
2卷引用:2016届山东省实验中学高三上学期第三次诊断考试化学试卷
2014·河南商丘·二模
名校
6 . 某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)为快速得到乙醇气体,可采取的方法是___________ ;若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是___________ (填写编号);
a.取下小试管 b.移去酒精灯 c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中出现的现象为___________ 。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。

①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+,检验该溶液中的Fe2+的方法是___________ ;关于M中铁元素价态的判断正确的是___________ (填写编号)。
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3和+2价铁,可能有0价铁
(4)若M的成分可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下:

①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是___________ (填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中 =
=___________ 。
(1)为快速得到乙醇气体,可采取的方法是
a.取下小试管 b.移去酒精灯 c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中出现的现象为
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。

①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+,检验该溶液中的Fe2+的方法是
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3和+2价铁,可能有0价铁
(4)若M的成分可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下:

①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中
 =
=
您最近一年使用:0次
2016-12-09更新
|
1336次组卷
|
3卷引用:2014届河南省商丘市高三第二次模拟考试理综化学试卷
名校
解题方法
7 . 铁器时代是人类发展史中一个极为重要的时代,铁及其化合物在人类的生产、生活中都起了巨大的作用。
(1)有“中华第一剑”之称的虢国玉柄铁剑是我国目前出土的最早冶炼铁,玉柄铁剑,剑断锈连,剑身表面的铁锈的主要成分是___ (填标号)。
(2)长期放置的FeSO4溶液易被氧化而变质,实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是___ (用离子方程式表示)。
(3)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液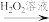 溶液I
溶液I 沉淀II
沉淀II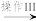 Fe2O3
Fe2O3
①H2O2溶液的作用是___ 。
②“溶液I”的溶质为___ (填化学式),写出由“溶液I”到“沉淀II”反应的离子方程式:___ 。
③“操作III”的名称为___ 。
(4)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。

①将下列实验操作步骤正确排序:__ (填标号);重复上述操作步骤,直至装置A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量装置A
f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=___ (列出计算式即可)。
(1)有“中华第一剑”之称的虢国玉柄铁剑是我国目前出土的最早冶炼铁,玉柄铁剑,剑断锈连,剑身表面的铁锈的主要成分是
| A.Fe | B.FeO | C.Fe3O4 | D.Fe2O3 |
(3)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液
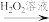 溶液I
溶液I 沉淀II
沉淀II Fe2O3
Fe2O3①H2O2溶液的作用是
②“溶液I”的溶质为
③“操作III”的名称为
(4)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。

①将下列实验操作步骤正确排序:
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量装置A
f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=
您最近一年使用:0次
2021-12-17更新
|
564次组卷
|
4卷引用:河北省百所学校大联考2021-2022学年高一12月联考化学试题
河北省百所学校大联考2021-2022学年高一12月联考化学试题(已下线)第三章 铁 金属材料(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)河北省保定市唐县第一中学2022-2023学年高一上学期第三次考试化学试题河北省定州市第二中学2022-2023学年高一上学期12月月考化学试题
8 . 实验室用图示仪器连接起来制备纯净的二氧化碳并测定其相对分子质量,现用含少量FeS的大理石和盐酸反应制备CO2气体,实验步骤如下:

(1)将橡皮塞B塞在A烧瓶口,并用皮筋套在烧瓶的瓶劲处标记橡皮塞入瓶颈的深度,准确称量其质量为m1 g。连接整套装置,其顺序是:___________ 。
(2)将导管G插入烧瓶A中,并用向___________ (上/下)排气法收集CO2气体,检验CO2气体是否充满烧瓶,迅速用橡皮塞塞好烧瓶瓶口,并称其质量为m2 g。
(3)将烧瓶口橡皮筋取下,向烧瓶注水至标记线,再将水小心倒入量筒,测量出水的体积为V1 mL;将该体积换算成标准状况下的体积为V2 mL。请写出CO2相对分子量的计算表达式是___________ ;若不将气体净化和干燥,所测定的CO2相对分子量的数值将会___________ (偏高/偏低),其原因是___________ 。

(1)将橡皮塞B塞在A烧瓶口,并用皮筋套在烧瓶的瓶劲处标记橡皮塞入瓶颈的深度,准确称量其质量为m1 g。连接整套装置,其顺序是:
(2)将导管G插入烧瓶A中,并用向
(3)将烧瓶口橡皮筋取下,向烧瓶注水至标记线,再将水小心倒入量筒,测量出水的体积为V1 mL;将该体积换算成标准状况下的体积为V2 mL。请写出CO2相对分子量的计算表达式是
您最近一年使用:0次
名校
9 . 乙酰苯胺( )具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺可通过苯胺(
)具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺可通过苯胺(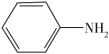 )和乙酸反应制得,该反应是放热的可逆反应。
)和乙酸反应制得,该反应是放热的可逆反应。
已知:I.苯胺在空气中易被氧化。
II.可能用到的有关性质如下:
I.制备乙酰苯胺的实验步骤如下:
步骤1:在制备装置加入9.2 mL苯胺、17.4 mL冰醋酸、0.1 g锌粉及少量水。
步骤2:小火加热回流1 h。
步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250 mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),制得粗乙酰苯胺。
II.乙酰苯胺的提纯
将上述制得的粗乙酰苯胺固体移人500 mL烧杯中,加入100 mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5 min,趁热过滤。待滤液冷却至室温,有晶体析出,称量产品为10.8 g。
回答下列问题:
(1)写出制备乙酰苯胺的化学方程式___________ 。
(2)将三种试剂混合时,最后加入的试剂是___________ 。
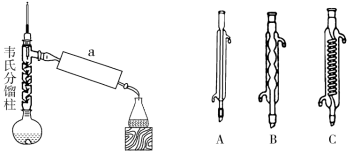
(3)步骤2:小火加热回流1 h,装置如图所示。a处使用的仪器为___________ (填“A”、“B”或“C”),该仪器的名称是___________ 。
(4)步骤I反应体系的温度控制在100℃~105℃,目的是___________ 。
(5)步骤II中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是___________ 。这种提纯乙酰苯胺的方法叫___________ 。
(6)乙酰苯胺的产率是____________ (精确到小数点后1位),导致实际值低于理论值的原因不可能是___________ (填字母标号)。
A.没有等充分冷却就开始过滤 B.在抽滤时,有产物残留在烧杯壁
C.乙酰苯胺中的乙酸未除干净 D.抽滤时乙酰苯胺有部分溶于水中
 )具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺可通过苯胺(
)具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺可通过苯胺( )和乙酸反应制得,该反应是放热的可逆反应。
)和乙酸反应制得,该反应是放热的可逆反应。已知:I.苯胺在空气中易被氧化。
II.可能用到的有关性质如下:
| 名称 | 相对分子质量 | 性状 | 密度g/cm3 | 熔点/℃ | 沸点/℃ | 溶解度 | |
| g/100水 | g/100g乙醇 | ||||||
| 苯胺 | 93 | 棕黄色油状液体 | 1.02 | -6.3 | 184 | 微溶 | ∞ |
| 冰醋酸 | 60 | 无色透明液体 | 1.05 | 16.6 | 117.9 | ∞ | ∞ |
| 乙酰苯胺 | 135 | 无色片状晶体 | 1.21 | 155~156 | 280~290 | 温度高,溶解度大 | 较水中大 |
步骤1:在制备装置加入9.2 mL苯胺、17.4 mL冰醋酸、0.1 g锌粉及少量水。
步骤2:小火加热回流1 h。
步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250 mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),制得粗乙酰苯胺。
II.乙酰苯胺的提纯
将上述制得的粗乙酰苯胺固体移人500 mL烧杯中,加入100 mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5 min,趁热过滤。待滤液冷却至室温,有晶体析出,称量产品为10.8 g。
回答下列问题:
(1)写出制备乙酰苯胺的化学方程式
(2)将三种试剂混合时,最后加入的试剂是
(3)步骤2:小火加热回流1 h,装置如图所示。a处使用的仪器为

(4)步骤I反应体系的温度控制在100℃~105℃,目的是
(5)步骤II中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是
(6)乙酰苯胺的产率是
A.没有等充分冷却就开始过滤 B.在抽滤时,有产物残留在烧杯壁
C.乙酰苯胺中的乙酸未除干净 D.抽滤时乙酰苯胺有部分溶于水中
您最近一年使用:0次
2021-08-30更新
|
651次组卷
|
4卷引用:山东省济宁市2020-2021学年高二下学期期末考试化学试题
山东省济宁市2020-2021学年高二下学期期末考试化学试题(已下线)1.2 有机化合物的结构特点(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修3)山东省济宁市邹城市第二中学2021-2022学年高二下学期6月月考化学试题山东省威海乳山市第一中学2021-2022学年高二下学期4月疫情复习测试化学试题
10 . 呋喃甲酸是一种抗生素,在食品工业中作防腐剂,也作涂料添加剂、医药、香料等中间体,可用呋喃甲醛制备,其实验原理和制备步骤如下:

步骤③提纯过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥。
已知:①呋喃甲酸在100℃升华,133℃熔融, 沸腾并在此温度下脱羧;
沸腾并在此温度下脱羧;
②呋喃沸点为 ,易溶于水
,易溶于水
③无水氯化钙能与醇形成复合物。
(1)步骤①的关键是控制温度,其措施有磁力搅拌、___________ 和___________ 。
(2)步骤②中干燥所使用的干燥剂可选用___________ (填序号)。
A.98%浓硫酸 B.无水硫酸镁 C.无水氯化钙
(3)呋喃甲酸在A、B、C三种溶剂中溶解度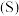 随温度变化的曲线如图。步骤③提纯时,合适的溶解溶剂是
随温度变化的曲线如图。步骤③提纯时,合适的溶解溶剂是___________ ,理由是___________ 。

(4)利用呋喃甲酸可以制取八甲基四氧杂夸特烯。

①仪器 的名称是
的名称是___________ ,装置 的作用是
的作用是___________ 。
②脱羧装置中用冰盐浴的目的是___________ 。
③可通过测定沸点确定产品为八甲基四氧杂夸特烯,还可采用的检测方法有___________ 。
④若用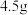 呋喃甲酸制得了
呋喃甲酸制得了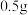 八甲基四氧杂夸特烯(
八甲基四氧杂夸特烯( ),则产率为
),则产率为___________ (保留4位有效数字)。

步骤③提纯过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥。
已知:①呋喃甲酸在100℃升华,133℃熔融,
 沸腾并在此温度下脱羧;
沸腾并在此温度下脱羧;②呋喃沸点为
 ,易溶于水
,易溶于水③无水氯化钙能与醇形成复合物。
(1)步骤①的关键是控制温度,其措施有磁力搅拌、
(2)步骤②中干燥所使用的干燥剂可选用
A.98%浓硫酸 B.无水硫酸镁 C.无水氯化钙
(3)呋喃甲酸在A、B、C三种溶剂中溶解度
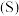 随温度变化的曲线如图。步骤③提纯时,合适的溶解溶剂是
随温度变化的曲线如图。步骤③提纯时,合适的溶解溶剂是
(4)利用呋喃甲酸可以制取八甲基四氧杂夸特烯。

①仪器
 的名称是
的名称是 的作用是
的作用是②脱羧装置中用冰盐浴的目的是
③可通过测定沸点确定产品为八甲基四氧杂夸特烯,还可采用的检测方法有
④若用
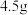 呋喃甲酸制得了
呋喃甲酸制得了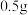 八甲基四氧杂夸特烯(
八甲基四氧杂夸特烯( ),则产率为
),则产率为
您最近一年使用:0次



