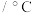1 . 纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,具体步骤如下:
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
步骤ⅱ.制备纯碱
在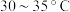 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸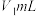 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。
已知:相关物质的溶解度如下
说明:“—”表示该物质在相应温度下已开始分解。
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为________________ ;
(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为________________ ;
(3)步骤ⅱ中,选择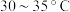 水浴的原因为
水浴的原因为________________ ;
(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为________________ ;
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的________ (填仪器名称);________ ;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为________________ ;选择指示剂N时,滴定终点溶液颜色变化为________________ ;
(7)产品中碳酸氢钠的质量分数为________ (用含字母的代数式表示)。
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和
 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。步骤ⅱ.制备纯碱
在
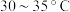 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用
 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸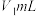 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。已知:相关物质的溶解度如下
温度 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 15.8 | 21.0 | 27.0 | — | — | — | — |
| 8.15 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为
 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为
(3)步骤ⅱ中,选择
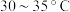 水浴的原因为
水浴的原因为(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的
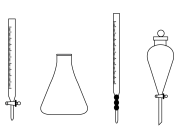
(7)产品中碳酸氢钠的质量分数为
您最近一年使用:0次
7日内更新
|
153次组卷
|
3卷引用:河北省石家庄市2024届普通高中学校高三毕业年级教学质量检测(三)化学试卷
2 . 某学习小组在实验室模拟工业制备硫氰化钾并测定产品中KSCN的含量。制备原理: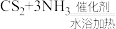
 (反应较缓慢)、
(反应较缓慢)、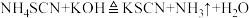 。
。
已知: 不溶于水,密度比水大;
不溶于水,密度比水大; 不溶于
不溶于 ;
; 在300℃左右分解。具体步骤如下:
在300℃左右分解。具体步骤如下:
Ⅰ.连接实验仪器,并检查装置的气密性。
Ⅱ.称取氯化铵、消石灰,经系列操作,将产生的气体通过碱石灰干燥。
Ⅲ.将干燥后的气体缓缓通入盛有 、
、 和固体催化剂的三颈烧瓶中,水浴加热较长时间直至油层消失。
和固体催化剂的三颈烧瓶中,水浴加热较长时间直至油层消失。
Ⅳ.移开水浴,将三颈烧瓶继续加热至105℃,一段时间后,缓缓滴入适量的KOH溶液并继续保持液温105℃。
Ⅴ.过滤三颈烧瓶中的混合物,将滤液蒸发浓缩、冷却结晶,再过滤、洗涤、干燥,得到KSCN晶体。
回答下列问题:
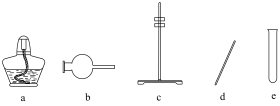
(1)步骤Ⅱ中用到的部分实验仪器如下:_______ ,“系列操作”中,为加快制备气体速率而进行的操作为_______ 。
(2)步骤Ⅲ中,“加热较长时间”的原因是_______ 。
(3)步骤Ⅳ中,将三颈烧瓶继续加热至105℃一段时间,该过程中发生反应的化学方程式为_____ ,实验时需将三颈烧瓶中逸出的尾气进行处理,下列试剂中最合适的是_______ (填标号)。
A.饱和食盐水 B.酸性 溶液 C.饱和NaHS溶液
溶液 C.饱和NaHS溶液
(4)步骤Ⅴ中,第一次过滤的目的是_______ 。
(5)测定晶体中KSCN的含量:称取4.0g样品,配成250mL溶液。量取75.00mL溶液并加入适量稀硝酸调节pH,再加入几滴 溶液,然后将溶液等分成三份,用0.1000mol/L
溶液,然后将溶液等分成三份,用0.1000mol/L  标准溶液分别滴定,达到滴定终点时平均消耗24.00mL
标准溶液分别滴定,达到滴定终点时平均消耗24.00mL  溶液。
溶液。
①滴定时发生的反应: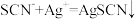 (白色)。则判断到达滴定终点的现象是
(白色)。则判断到达滴定终点的现象是________ 。
②晶体中KSCN的质量分数为_______ %(计算结果保留1位小数)。
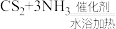
 (反应较缓慢)、
(反应较缓慢)、 。
。已知:
 不溶于水,密度比水大;
不溶于水,密度比水大; 不溶于
不溶于 ;
; 在300℃左右分解。具体步骤如下:
在300℃左右分解。具体步骤如下:Ⅰ.连接实验仪器,并检查装置的气密性。
Ⅱ.称取氯化铵、消石灰,经系列操作,将产生的气体通过碱石灰干燥。
Ⅲ.将干燥后的气体缓缓通入盛有
 、
、 和固体催化剂的三颈烧瓶中,水浴加热较长时间直至油层消失。
和固体催化剂的三颈烧瓶中,水浴加热较长时间直至油层消失。Ⅳ.移开水浴,将三颈烧瓶继续加热至105℃,一段时间后,缓缓滴入适量的KOH溶液并继续保持液温105℃。
Ⅴ.过滤三颈烧瓶中的混合物,将滤液蒸发浓缩、冷却结晶,再过滤、洗涤、干燥,得到KSCN晶体。
回答下列问题:
(1)步骤Ⅱ中用到的部分实验仪器如下:
(2)步骤Ⅲ中,“加热较长时间”的原因是
(3)步骤Ⅳ中,将三颈烧瓶继续加热至105℃一段时间,该过程中发生反应的化学方程式为
A.饱和食盐水 B.酸性
 溶液 C.饱和NaHS溶液
溶液 C.饱和NaHS溶液(4)步骤Ⅴ中,第一次过滤的目的是
(5)测定晶体中KSCN的含量:称取4.0g样品,配成250mL溶液。量取75.00mL溶液并加入适量稀硝酸调节pH,再加入几滴
 溶液,然后将溶液等分成三份,用0.1000mol/L
溶液,然后将溶液等分成三份,用0.1000mol/L  标准溶液分别滴定,达到滴定终点时平均消耗24.00mL
标准溶液分别滴定,达到滴定终点时平均消耗24.00mL  溶液。
溶液。①滴定时发生的反应:
 (白色)。则判断到达滴定终点的现象是
(白色)。则判断到达滴定终点的现象是②晶体中KSCN的质量分数为
您最近一年使用:0次
解题方法
3 . 硫酸镍( ,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备
,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备 的工艺流程如下:
的工艺流程如下: 等多种离子;
等多种离子;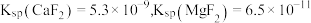 ,离子浓度
,离子浓度 即可认为沉淀完全.
即可认为沉淀完全.
回答下列问题:
(1)“滤渣1”的主要成分是________ (写化学式);
(2)NaHS作“除铜”沉淀剂的缺点是_______ ;
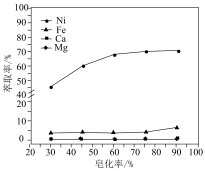
(3)对萃取剂进行皂化是一种强化萃取的常见方法,“萃镍”时加入HBL110萃取剂的同时加入NaOH溶液对萃取剂进行皂化,可以提高镍萃取率,从平衡移动的角度分析原因_____________ .萃取剂皂化率对金属阳离子的萃取率影响如图所示,皂化率最佳取值为_________ .结合图中信息分析,实际生产中将“滤液A”返回至“萃取”工序的原因为__________________ ;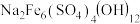 ],“除铁”的离子方程式为
],“除铁”的离子方程式为________ ;
(5)若溶液中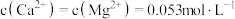 ,“除
,“除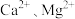 ”时,缓慢滴加NaF溶液,则先产生的沉淀1是
”时,缓慢滴加NaF溶液,则先产生的沉淀1是________ (填化学式),当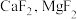 开始共沉淀时,溶液中“沉淀1”是否沉淀完全?
开始共沉淀时,溶液中“沉淀1”是否沉淀完全?____________ (填“是”或“否”);
(6)滴定法测定 产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为
产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为 的
的 标准液滴定,重复操作2~3次,平均消耗
标准液滴定,重复操作2~3次,平均消耗 标准液17.60mL;
标准液17.60mL;
已知:ⅰ. ;ⅱ.紫脲酸胺:紫色试剂,遇
;ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。
显橙黄色。
①滴定至终点时溶液颜色变化为___________ ;
②样品中镍元素的质量分数为__________ %(保留3位有效数字)。
 ,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备
,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备 的工艺流程如下:
的工艺流程如下: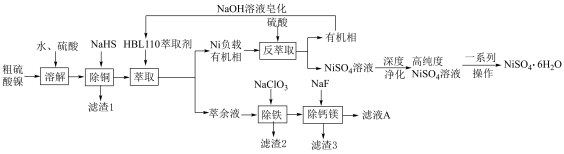
 等多种离子;
等多种离子;②HBL110萃取剂是由酯类有机物B与磺酸类有机物HA按一定比例混合组成,萃取 原理为:
原理为: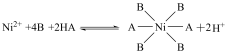 ;
;
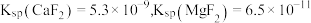 ,离子浓度
,离子浓度 即可认为沉淀完全.
即可认为沉淀完全.回答下列问题:
(1)“滤渣1”的主要成分是
(2)NaHS作“除铜”沉淀剂的缺点是
(3)对萃取剂进行皂化是一种强化萃取的常见方法,“萃镍”时加入HBL110萃取剂的同时加入NaOH溶液对萃取剂进行皂化,可以提高镍萃取率,从平衡移动的角度分析原因
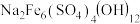 ],“除铁”的离子方程式为
],“除铁”的离子方程式为(5)若溶液中
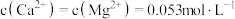 ,“除
,“除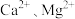 ”时,缓慢滴加NaF溶液,则先产生的沉淀1是
”时,缓慢滴加NaF溶液,则先产生的沉淀1是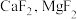 开始共沉淀时,溶液中“沉淀1”是否沉淀完全?
开始共沉淀时,溶液中“沉淀1”是否沉淀完全?(6)滴定法测定
 产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为
产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为 的
的 标准液滴定,重复操作2~3次,平均消耗
标准液滴定,重复操作2~3次,平均消耗 标准液17.60mL;
标准液17.60mL;已知:ⅰ.
 ;ⅱ.紫脲酸胺:紫色试剂,遇
;ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。
显橙黄色。①滴定至终点时溶液颜色变化为
②样品中镍元素的质量分数为
您最近一年使用:0次
2024-05-29更新
|
130次组卷
|
2卷引用:河北省衡水市2024届高三下学期高考预测卷化学试题
4 . 工业锌粉常用于制造防锈漆等,其主要成分为金属锌,还有少量含锌化合物及其他杂质,锌单质的含量及锌元素的总量影响着工业锌粉的等级。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:_________ 。
(2)酸性介质中电沉积制锌粉:以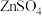 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
①阴极的电极反应有_________ 。
②制得65g锌粉时,电解质溶液中 的物质的量至少增加
的物质的量至少增加_________ mol。
(3)离子液体电沉积制锌:80℃时,将 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:_________ 。
i.二甲酚橙(In)与 反应:
反应:
EDTA与 反应:
反应: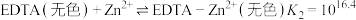
ii. 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
(4)滴定终点时的现象是_________ 。
(5)计算样品中锌元素的质量分数还需要的实验数据有_________ 。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入
 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:(2)酸性介质中电沉积制锌粉:以
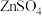 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。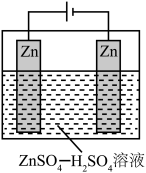

①阴极的电极反应有
②制得65g锌粉时,电解质溶液中
 的物质的量至少增加
的物质的量至少增加(3)离子液体电沉积制锌:80℃时,将
 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因: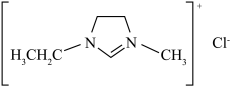

i.二甲酚橙(In)与
 反应:
反应:
EDTA与
 反应:
反应: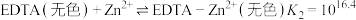
ii.
 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。(4)滴定终点时的现象是
(5)计算样品中锌元素的质量分数还需要的实验数据有
您最近一年使用:0次
名校
解题方法
5 . 过二硫酸钾( )具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
)具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
Ⅰ. 中含有过氧键,与过氧化氢相似,可以和
中含有过氧键,与过氧化氢相似,可以和 发生氧化还原反应,由此构成原电池装置(质子交换膜只允许
发生氧化还原反应,由此构成原电池装置(质子交换膜只允许 通过),如图。
通过),如图。______ (填“a”或“b”)极,b极的电极反应式为______________________ 。
(2)下列关于a,b极的电极材料合理的是________ (填标号)。
Ⅱ.制备过二硫酸钾( )。
)。
往 溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃,
溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃, 以结晶析出,溶液中含有硫酸氢盐。
以结晶析出,溶液中含有硫酸氢盐。
(3)制备 的化学方程式为
的化学方程式为_____________________ 。
Ⅲ.产品提纯。
在450mL 0.5 KOH水溶液中,边搅拌边加入
KOH水溶液中,边搅拌边加入 粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使
粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使 重新结晶,再在90~95℃下气流干燥,即得成品。
重新结晶,再在90~95℃下气流干燥,即得成品。
(4)现用KOH固体配制上述KOH水溶液,需称量_________ g KOH固体,所需仪器如图所示,其中不需要的仪器是________________ (填标号),还缺少的仪器为_______________________ (写仪器名称)。 (
(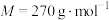 )含量测定。
)含量测定。
取a g样品全部溶解在烧杯中,加入20.00mL 0.1
 溶液,恰好完全反应。
溶液,恰好完全反应。
(5)反应生成 写出该反应的离子方程式:
写出该反应的离子方程式:________________ 。
(6)此样品中 的质量分数为
的质量分数为________________ 。
 )具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
)具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:Ⅰ.
 中含有过氧键,与过氧化氢相似,可以和
中含有过氧键,与过氧化氢相似,可以和 发生氧化还原反应,由此构成原电池装置(质子交换膜只允许
发生氧化还原反应,由此构成原电池装置(质子交换膜只允许 通过),如图。
通过),如图。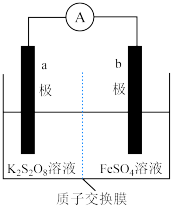
(2)下列关于a,b极的电极材料合理的是
选项 | a极 | b极 |
A | Pt | Pt |
B | 石墨 | 石墨 |
C | 石墨 | Zn |
D | Al | Cu |
Ⅱ.制备过二硫酸钾(
 )。
)。往
 溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃,
溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃, 以结晶析出,溶液中含有硫酸氢盐。
以结晶析出,溶液中含有硫酸氢盐。(3)制备
 的化学方程式为
的化学方程式为Ⅲ.产品提纯。
在450mL 0.5
 KOH水溶液中,边搅拌边加入
KOH水溶液中,边搅拌边加入 粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使
粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使 重新结晶,再在90~95℃下气流干燥,即得成品。
重新结晶,再在90~95℃下气流干燥,即得成品。(4)现用KOH固体配制上述KOH水溶液,需称量

 (
(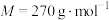 )含量测定。
)含量测定。取a g样品全部溶解在烧杯中,加入20.00mL 0.1

 溶液,恰好完全反应。
溶液,恰好完全反应。(5)反应生成
 写出该反应的离子方程式:
写出该反应的离子方程式:(6)此样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
6 . 硫化物含硫量的测定、脱硫是极具价值的重要课题。
(1) 是一种复合脱硫剂,可用于脱除煤气中的
是一种复合脱硫剂,可用于脱除煤气中的 。
。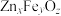 晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的
晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为__________ 。
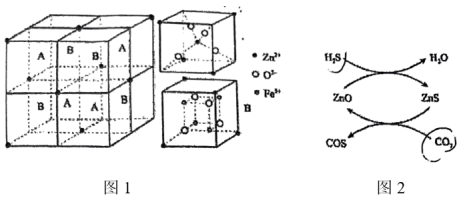
②一定温度下将一定比例 和
和 的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到
的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到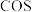 。研究表明
。研究表明 参与了
参与了 与
与 生成
生成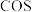 的反应,反应机理如图2所示,反应前后
的反应,反应机理如图2所示,反应前后 的质量不变,该反应过程可描述为
的质量不变,该反应过程可描述为__________ 。
(2)稀土硫化物中硫含量的测定对其生产和质量控制具有重要意义。用如下方法对稀土硫化物中具有代表性的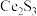 (
( 基态原子核外电子排布式为
基态原子核外电子排布式为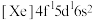 )样品硫含量进行测定。实验检测原理为
)样品硫含量进行测定。实验检测原理为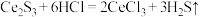
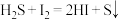
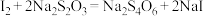
步骤1:称取0.1600g样品于反应瓶中,再准确滴加20.00mL 碘溶液;
碘溶液;
步骤2:缓慢滴加稍过量的稀盐酸(边滴加边摇动反应瓶),盖上瓶塞,剧烈摇动2min;
步骤3:滴入
 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液20.00mL。
溶液20.00mL。
① 元素最高正化合价为
元素最高正化合价为__________ 。
②步骤1中不能使用稀硝酸的原因是__________ 。
③该样品中硫的质量分数为__________ (写出计算过程)。
(1)
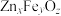 是一种复合脱硫剂,可用于脱除煤气中的
是一种复合脱硫剂,可用于脱除煤气中的 。
。
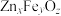 晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的
晶胞结构如图1所示(A、B交替排列,且A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为②一定温度下将一定比例
 和
和 的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到
的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到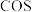 。研究表明
。研究表明 参与了
参与了 与
与 生成
生成 的反应,反应机理如图2所示,反应前后
的反应,反应机理如图2所示,反应前后 的质量不变,该反应过程可描述为
的质量不变,该反应过程可描述为(2)稀土硫化物中硫含量的测定对其生产和质量控制具有重要意义。用如下方法对稀土硫化物中具有代表性的
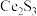 (
( 基态原子核外电子排布式为
基态原子核外电子排布式为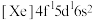 )样品硫含量进行测定。实验检测原理为
)样品硫含量进行测定。实验检测原理为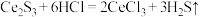
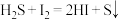
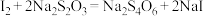
步骤1:称取0.1600g样品于反应瓶中,再准确滴加20.00mL
 碘溶液;
碘溶液;步骤2:缓慢滴加稍过量的稀盐酸(边滴加边摇动反应瓶),盖上瓶塞,剧烈摇动2min;
步骤3:滴入

 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液20.00mL。
溶液20.00mL。①
 元素最高正化合价为
元素最高正化合价为②步骤1中不能使用稀硝酸的原因是
③该样品中硫的质量分数为
您最近一年使用:0次
7 . 白云石的主要成分为 ,还含有少量的
,还含有少量的 和
和 。利用白云石制备碳酸钙和氧化镁,其主要流程的示意图如下。
。利用白云石制备碳酸钙和氧化镁,其主要流程的示意图如下。
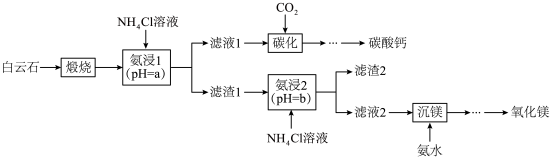
已知: 。
。
(1)组成 的四种元素,电负性由大到小的顺序是
的四种元素,电负性由大到小的顺序是___________ 。
(2)“氨浸1”在室温下进行,写出氯化铵浸取氧化钙总反应的离子方程式___________ 。
(3)两次“氨浸”的pH比较;a___________ b(填“>”“=”或“<”)。
(4)“碳化”时,测得碳酸钙的产率及碳酸钙中镁元素的含量随溶液pH的变化如图所示。
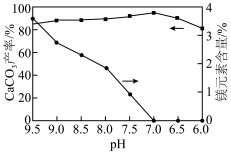

___________ 时,碳化效果最佳。低于该pH,碳酸钙的产率下降,其原因用离子方程式表示:___________ 。
(5)“沉镁”发生反应: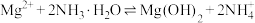 ,其平衡常数
,其平衡常数
___________ (用含氢氧化的 和
和 的
的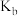 的代数式表示)。
的代数式表示)。
(6)制备过程除了充分利用 ,还可以循环利用的1种物质是
,还可以循环利用的1种物质是___________ (填化学式)。
(7)称取 试样置于烧杯中,加蒸馏水数滴润湿,盖一表面皿,滴加盐酸至固体完全溶解,定容在
试样置于烧杯中,加蒸馏水数滴润湿,盖一表面皿,滴加盐酸至固体完全溶解,定容在 的容量瓶内,用移液管吸取
的容量瓶内,用移液管吸取 待测液于锥形瓶中,加入相关试剂,摇匀后用
待测液于锥形瓶中,加入相关试剂,摇匀后用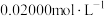 EDTA溶液滴定至终点(
EDTA溶液滴定至终点( 与EDTA以等物质的量比反应)。进行平行实验,测得平均消耗EDTA溶液
与EDTA以等物质的量比反应)。进行平行实验,测得平均消耗EDTA溶液 。产品中碳酸钙质量分数为
。产品中碳酸钙质量分数为___________ (列出计算式)。
(8)碳酸钙的某种晶胞结构如下图所示。

①每个晶胞中含有___________ 个“ ”单元。
”单元。
②每个阴离子团的配位数(紧邻的阳离子数)为___________ 。
 ,还含有少量的
,还含有少量的 和
和 。利用白云石制备碳酸钙和氧化镁,其主要流程的示意图如下。
。利用白云石制备碳酸钙和氧化镁,其主要流程的示意图如下。
已知:
 。
。(1)组成
 的四种元素,电负性由大到小的顺序是
的四种元素,电负性由大到小的顺序是(2)“氨浸1”在室温下进行,写出氯化铵浸取氧化钙总反应的离子方程式
(3)两次“氨浸”的pH比较;a
(4)“碳化”时,测得碳酸钙的产率及碳酸钙中镁元素的含量随溶液pH的变化如图所示。


(5)“沉镁”发生反应:
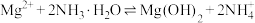 ,其平衡常数
,其平衡常数
 和
和 的
的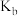 的代数式表示)。
的代数式表示)。(6)制备过程除了充分利用
 ,还可以循环利用的1种物质是
,还可以循环利用的1种物质是(7)称取
 试样置于烧杯中,加蒸馏水数滴润湿,盖一表面皿,滴加盐酸至固体完全溶解,定容在
试样置于烧杯中,加蒸馏水数滴润湿,盖一表面皿,滴加盐酸至固体完全溶解,定容在 的容量瓶内,用移液管吸取
的容量瓶内,用移液管吸取 待测液于锥形瓶中,加入相关试剂,摇匀后用
待测液于锥形瓶中,加入相关试剂,摇匀后用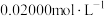 EDTA溶液滴定至终点(
EDTA溶液滴定至终点( 与EDTA以等物质的量比反应)。进行平行实验,测得平均消耗EDTA溶液
与EDTA以等物质的量比反应)。进行平行实验,测得平均消耗EDTA溶液 。产品中碳酸钙质量分数为
。产品中碳酸钙质量分数为(8)碳酸钙的某种晶胞结构如下图所示。

①每个晶胞中含有
 ”单元。
”单元。②每个阴离子团的配位数(紧邻的阳离子数)为
您最近一年使用:0次
名校
解题方法
8 . 贵州是国内唯一兼具高海拔、低纬度、寡日照、多云雾适宜种茶制茶条件的茶区,是国内业界公认的高品质绿茶重要产地。茶叶中有两种含量最多的功效成分,一是咖啡因,它易溶于水、乙醇、氯仿,二是茶多酚,是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。实验室提取茶多酚主要实验步骤如下:
②提取:称取10g茶叶末,用滤纸包好,按如图所示装置进行提取操作。

③分离:将提取液分别过滤后合并滤液,并将滤液按1∶2的体积比与氯仿混合,并搅拌均匀,再用分液漏斗静止分层。取上层液按1∶2体积比加入乙酸乙酯,混合均匀后搅拌3~5分钟,然后倒入分液漏斗中静置,最后分层,操作2次,合并萃取液,用水浴加热减压蒸馏除去乙酸乙酯。
④浓缩:趁热将残液移入洁净干燥的蒸发皿,用蒸汽浴继续浓缩至近干
⑤结晶:冷却至室温,移入冰箱冷冻干燥,得到白色粉末状的茶多酚粗制品。将粗制品用蒸馏水进行1~2次重结晶,得到茶多酚精品。
回答下列问题:
(1)步骤2中滤纸包好的茶叶末装入___________ 中,圆底烧瓶内加___________ 和适量乙醇,通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在90℃。为使恒压漏斗内液面高出茶叶包约0.5cm,并保持约1h,可行的操作方法是___________ 。
(2)步骤3中氯仿的作用是___________ 。
(3)下列关于萃取过程中振摇操作的示意图,正确的是___________ (填序号)。
A. B.
B.  C.
C.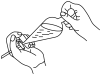
(4)与常压蒸馏相比,减压蒸馏的优点是___________ 。
(5)在酸性介质中,茶多酚能将 还原为
还原为 ,
, 与
与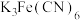 生成的深蓝色配位化合物
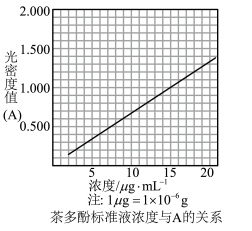
生成的深蓝色配位化合物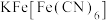 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量 和
和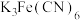 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值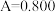 ,则产品的纯度是
,则产品的纯度是___________ (以质量分数表示)。
①准备工作:称取适量干燥的绿茶样品,并将其粉碎成细粉末。
②提取:称取10g茶叶末,用滤纸包好,按如图所示装置进行提取操作。

③分离:将提取液分别过滤后合并滤液,并将滤液按1∶2的体积比与氯仿混合,并搅拌均匀,再用分液漏斗静止分层。取上层液按1∶2体积比加入乙酸乙酯,混合均匀后搅拌3~5分钟,然后倒入分液漏斗中静置,最后分层,操作2次,合并萃取液,用水浴加热减压蒸馏除去乙酸乙酯。
④浓缩:趁热将残液移入洁净干燥的蒸发皿,用蒸汽浴继续浓缩至近干
⑤结晶:冷却至室温,移入冰箱冷冻干燥,得到白色粉末状的茶多酚粗制品。将粗制品用蒸馏水进行1~2次重结晶,得到茶多酚精品。
回答下列问题:
(1)步骤2中滤纸包好的茶叶末装入
(2)步骤3中氯仿的作用是
(3)下列关于萃取过程中振摇操作的示意图,正确的是
A.
 B.
B.  C.
C.
(4)与常压蒸馏相比,减压蒸馏的优点是
(5)在酸性介质中,茶多酚能将
 还原为
还原为 ,
, 与
与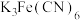 生成的深蓝色配位化合物
生成的深蓝色配位化合物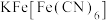 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量
 和
和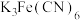 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值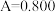 ,则产品的纯度是
,则产品的纯度是
您最近一年使用:0次
解题方法
9 .  加热到
加热到 以上迅速分解生成
以上迅速分解生成 和
和 .可采用量气法测定样品中
.可采用量气法测定样品中 的含量,量气装置如右图所示(假设杂质不产生气体).
的含量,量气装置如右图所示(假设杂质不产生气体).
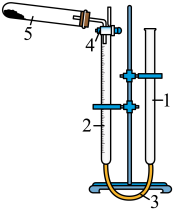
1.水准管;2.量气管;3.乳胶连接管;4.三通活塞;5.装有样品的试管
(1)下列关于使用量气装置的注意事项中,正确的是____________ (填标号)。
A.使用前需要检漏
B.初始读数时量气管与水准管液面要齐平
C.实验结束停止加热后立即读数
D.读数时视线与溶液的凹液面相切
E.最终读数时量气管与水准管液面不需齐平
(2)某同学准确称量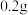 烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到
烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到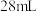 气体(已换算成标准状况).计算样品中
气体(已换算成标准状况).计算样品中 的质量分数
的质量分数________ (写出计算过程)。
 加热到
加热到 以上迅速分解生成
以上迅速分解生成 和
和 .可采用量气法测定样品中
.可采用量气法测定样品中 的含量,量气装置如右图所示(假设杂质不产生气体).
的含量,量气装置如右图所示(假设杂质不产生气体).
1.水准管;2.量气管;3.乳胶连接管;4.三通活塞;5.装有样品的试管
(1)下列关于使用量气装置的注意事项中,正确的是
A.使用前需要检漏
B.初始读数时量气管与水准管液面要齐平
C.实验结束停止加热后立即读数
D.读数时视线与溶液的凹液面相切
E.最终读数时量气管与水准管液面不需齐平
(2)某同学准确称量
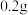 烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到
烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到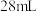 气体(已换算成标准状况).计算样品中
气体(已换算成标准状况).计算样品中 的质量分数
的质量分数
您最近一年使用:0次
2024高三下·全国·专题练习
10 . 制备的泄盐样品中MgSO4·7H2O的含量可用EDTA二钠盐(用Na2H2Y表示)进行测定,实验测定方法如下:
则制得的泄盐样品中MgSO4·7H2O的质量分数为___________ 。
| 实验测定方法 | 涉及的反应 |
| ①在1.5 g样品中加入足量的EDTA二钠盐溶液,配成pH=9~10的100.00 mL甲溶液 | Mg2++H2Y2-=MgH2Y |
| ②取25.00 mL甲溶液于锥形瓶中,用含0.100 mol·L-1 Zn2+的标准液进行滴定,消耗20.00 mL含Zn2+标准液 | Zn2++H2Y2-=ZnH2Y |
| ③再取25.00 mL甲溶液于另一锥形瓶中,调节pH为5~6,用含0.100 mol·L-1 Zn2+的标准液进行滴定,消耗35.00 mL含Zn2+标准液 | Zn2++MgH2Y=Mg2++ZnH2Y、Zn2++H2Y2-=ZnH2Y |
您最近一年使用:0次