1 . 上世纪30~40年代,侯德榜率技术团队突破外国公司垄断的索维尔制碱法的生成工艺,另辟蹊径,发明了侯氏联合制碱法,开创了世界制碱工业的新纪元。已知侯氏制碱法的主要原理为:
a. NaCl + NH3 + H2O + CO2 = NH4Cl + NaHCO3↓
b.2NaHCO3 Na2CO3 + CO2↑+ H2O
Na2CO3 + CO2↑+ H2O
(1)如图是某化学兴趣小组模拟“侯氏制碱法”制取NaHCO3的部分装置。为了提高CO2的利用率,须先向___________ (填“a”或“b”)管通入NH3,装置c中的试剂为___________ (填“碱石灰”“浓硫酸” 或“无水氯化钙”)。

(2)实验室给该兴趣小组提供了一份Na2CO3样品,为测定其纯度,小组成员设计了如下实验装置: B装置中盛有m1g碳酸钠样品( 假设杂质不参加反应,原装置中的CO2含量忽略不计,忽略CO2的溶解,各装置内反应完全)。实验室可供选择的试剂和药品还有Zn粒、稀硫酸、稀盐酸、CaCO3(s)。
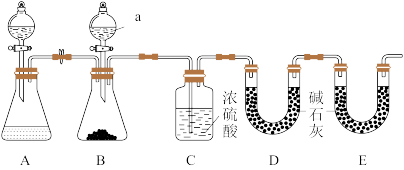
①仪器a的名称是___________ ,仪器a中所盛放的最佳试剂为___________ ,原因是___________ 。
②装置A的作用是___________ 。
③装置B中发生反应的离子方程式为___________ 。
④若无装置E,实验测定结果将___________ (填“偏高”“偏低”或“不变”),其原因是___________ 。若实验后,装置D增重m2g,则该碳酸钠样品的质量分数为___________ (用含m1、m2的代数式表示)。
a. NaCl + NH3 + H2O + CO2 = NH4Cl + NaHCO3↓
b.2NaHCO3
 Na2CO3 + CO2↑+ H2O
Na2CO3 + CO2↑+ H2O(1)如图是某化学兴趣小组模拟“侯氏制碱法”制取NaHCO3的部分装置。为了提高CO2的利用率,须先向

(2)实验室给该兴趣小组提供了一份Na2CO3样品,为测定其纯度,小组成员设计了如下实验装置: B装置中盛有m1g碳酸钠样品( 假设杂质不参加反应,原装置中的CO2含量忽略不计,忽略CO2的溶解,各装置内反应完全)。实验室可供选择的试剂和药品还有Zn粒、稀硫酸、稀盐酸、CaCO3(s)。

①仪器a的名称是
②装置A的作用是
③装置B中发生反应的离子方程式为
④若无装置E,实验测定结果将
您最近一年使用:0次
名校
2 . Na2CO3和NaHCO3是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组 对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I :
(1)取两支试管分别加入各约1 g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡 试管,用手触摸试管底部,温度较高的是_______ (填化学式,下同)。
(2)继续向两支试管中分别加入10 mL水,充分振荡,最先溶解完全的是_______ ;再分别加入几滴酚猷试液,溶液变红,但颜色较浅的是_______ 。
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后, 接下来的操作是_______ ,试管A中盛放的药品是_______ ,澄清石灰水变混浊的是_______ (填“a”或“b”),写出澄清石灰水变混浊的离子反应方程式_______ ,当实验结束时应当先 _______ (填操作)。
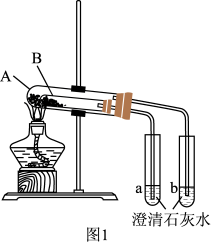
实验III:混合物中碳酸钠含量的测定
(4)按图2组装好仪器,检查装置气密性良好,称取3.00 g碳酸钠和碳酸氢钠的混合物,充分加热反应至恒重,称量剩余固体质量为2.38 g,则该混合物中碳酸钠的质量分数为_______ 。有同学提出:也可以利用澄清石灰水中生成的沉淀质量计算碳酸钠的含量,但是计算发现测量值明显偏大,可能的原因是_______ 。

实验I :
(1)取两支试管分别加入各约1 g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡 试管,用手触摸试管底部,温度较高的是
(2)继续向两支试管中分别加入10 mL水,充分振荡,最先溶解完全的是
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后, 接下来的操作是

实验III:混合物中碳酸钠含量的测定
(4)按图2组装好仪器,检查装置气密性良好,称取3.00 g碳酸钠和碳酸氢钠的混合物,充分加热反应至恒重,称量剩余固体质量为2.38 g,则该混合物中碳酸钠的质量分数为

您最近一年使用:0次
名校
解题方法
3 . 草酸(H2C2O4)是一种二元弱酸,主要做还原剂和漂白剂。广泛地应用于纺织印染、冶金、药物生产和化工生产。草酸与酸性KMnO4溶液发生反应:KMnO4 + H2C2O4 + H2SO4 = K2SO4 + MnSO4 + CO2,+ H2O (未配平)。某实验室根据以上原理测定某草酸样品的纯度。
(1)配平该反应:_______ 。
(2)配制 1 000 mL 0.0100 mol. L-1酸性 KMnO4溶液。
①用托盘天平称取_______ g KMnO4晶体,放入_______ 中(填仪器名称),加入少许水和稀硫酸溶解,冷却至_______ ;
②将溶液转移到_______ 中(填仪器名称),洗涤,并将洗涤液一并转入容量瓶中, 定容、摇匀。
准确称取 0.50 g 草酸样品配制成 100.00 mL 溶液,待用。
含量测定:
(3)移取 20.00 mL 酸性 KMnO4溶液,加入 25.00 mL 草酸样品溶液,溶液恰好完全褪色(假设其它杂质都不反应)。根据以上数据计算样品中草酸的质量分数为_______ 。
(4)误差分析 配制酸性 KMnO4溶液定容时如图所示操作,则所测样品中草酸的含_______ (填偏高、偏低或无影响)。

(1)配平该反应:
(2)配制 1 000 mL 0.0100 mol. L-1酸性 KMnO4溶液。
①用托盘天平称取
②将溶液转移到
准确称取 0.50 g 草酸样品配制成 100.00 mL 溶液,待用。
含量测定:
(3)移取 20.00 mL 酸性 KMnO4溶液,加入 25.00 mL 草酸样品溶液,溶液恰好完全褪色(假设其它杂质都不反应)。根据以上数据计算样品中草酸的质量分数为
(4)误差分析 配制酸性 KMnO4溶液定容时如图所示操作,则所测样品中草酸的含

您最近一年使用:0次
名校
解题方法
4 . 黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。回答下列问题:
(1)配制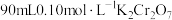 溶液
溶液
①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有___________ 、___________ 。
②计算,称量:需用天平称量___________ 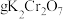 固体(
固体(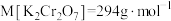 )。
)。
③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先___________ ,再改用胶头滴管加水至溶液凹液面最低处与刻度线相切。
④下列操作使结果偏低的是___________ 。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
①“步骤一”中加入过量铜粉的目的是___________ 。
②请配平步骤②中发生反应的离子反应方程式:___________
6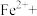 1
1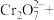 □
□ =□
=□ □
□ □
□ 。
。
③实验测得黑木耳中铁元素的质量分数为___________ 。
(1)配制
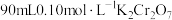 溶液
溶液①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有
②计算,称量:需用天平称量
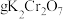 固体(
固体(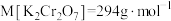 )。
)。③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先
④下列操作使结果偏低的是
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
| 步骤一 | 取112g黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 |
| 步骤二 | 过滤,向滤液中加入0.10mol/L酸性 溶液10mL时,恰好完全反应 溶液10mL时,恰好完全反应 |
②请配平步骤②中发生反应的离子反应方程式:
6
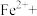 1
1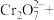 □
□ =□
=□ □
□ □
□ 。
。③实验测得黑木耳中铁元素的质量分数为
您最近一年使用:0次
2022-01-19更新
|
460次组卷
|
5卷引用:广东省佛山市2021-2022学年高一上学期高中教学质量检测化学试题
21-22高三上·江苏南通·阶段练习
名校
解题方法
5 . 工业上以黄铜矿(主要含 CuFeS2,还含FeS等)为原料可以制备Cu,流程如下:
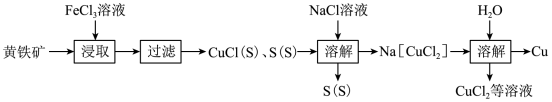
(1)写出“浸取”时 CuFeS2和FeCl3溶液反应的离子方程式:_______ 。
(2)“稀释”时反应的化学方程式为_______ 。
(3)用(NH4)2SO3还原CuCl2溶液也能获得CuCl,CuCl的产率随溶液pH变化如图所示。
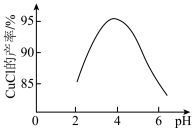
①pH约为4时,CuCl的产率最大。写出该条件下反应的离子方程式:_______ 。
②pH大于4或小于4时,CuCl的产率都会随pH的增大或减小而降低,原因是_______ 。
(4)“溶解”前需测定CuCl、S中CuCl的含量,实验过程为:称取0.8000g样品置于烧杯中,向其中加入稍过量的1.5mol·L-1 FeCl3溶液(CuCl+ FeCl3=CuCl2+FeCl2),充分反应后快速过滤,用蒸馏水洗涤烧杯、玻璃棒及滤渣2~3次,将滤液及洗涤滤液一并转移到锥形瓶中,用Ce(SO4)2标准溶液滴定至终点(Ce4++Fe2+=Fe3++Ce3+),消耗0.2000 mol·L-1 Ce(SO4)2标准溶液20.00mL。计算混合物中CuCl的质量分数_______ 。(写出计算过程)。

(1)写出“浸取”时 CuFeS2和FeCl3溶液反应的离子方程式:
(2)“稀释”时反应的化学方程式为
(3)用(NH4)2SO3还原CuCl2溶液也能获得CuCl,CuCl的产率随溶液pH变化如图所示。

①pH约为4时,CuCl的产率最大。写出该条件下反应的离子方程式:
②pH大于4或小于4时,CuCl的产率都会随pH的增大或减小而降低,原因是
(4)“溶解”前需测定CuCl、S中CuCl的含量,实验过程为:称取0.8000g样品置于烧杯中,向其中加入稍过量的1.5mol·L-1 FeCl3溶液(CuCl+ FeCl3=CuCl2+FeCl2),充分反应后快速过滤,用蒸馏水洗涤烧杯、玻璃棒及滤渣2~3次,将滤液及洗涤滤液一并转移到锥形瓶中,用Ce(SO4)2标准溶液滴定至终点(Ce4++Fe2+=Fe3++Ce3+),消耗0.2000 mol·L-1 Ce(SO4)2标准溶液20.00mL。计算混合物中CuCl的质量分数
您最近一年使用:0次
2022-01-17更新
|
407次组卷
|
3卷引用:江苏省如皋市2021-2022学年高三上学期教学质量调研(三)化学试题
(已下线)江苏省如皋市2021-2022学年高三上学期教学质量调研(三)化学试题江苏省镇江市第一中学2021~2022学年高二年级下学期期中考试化学试题江苏省南京、镇江市部分名校2021-2022学年高二下学期期中学情调查考试化学试题
名校
解题方法
6 . 下列有关各实验说法不正确的是
| A.配制60mL0.1mol/L硫酸铜溶液,需称取胆矾晶体2.5g |
| B.制取乙酸乙酯的实验中,饱和Na2CO3溶液可以换成饱和NaHCO3溶液 |
| C.测定硫酸铜晶体中结晶水的含量实验中,加热后坩埚和药品总质量应至少连续两次称量质量差小于0.1g |
| D.用质量分数98%的浓H2SO4配制0.5mol/LH2SO4溶液,量取浓硫酸时俯视读数,将导致实验结果偏高 |
您最近一年使用:0次
7 . 青铜是我国使用最早的合金,其中所含的铬元素能够提高其强度、硬度及耐磨度。使用硫酸亚铁铵滴定法可以测定青铜中铬元素的含量。
回答下列问题:
Ⅰ.配制1000mL
 溶液
溶液
(1)配制 溶液需要的玻璃仪器除烧杯、量筒、玻璃棒外,还有
溶液需要的玻璃仪器除烧杯、量筒、玻璃棒外,还有___________ (填仪器名称)。
(2)将7.84g {已知
{已知 }固体溶于稀硫酸,加水稀释至所需浓度。溶于稀硫酸的目的是
}固体溶于稀硫酸,加水稀释至所需浓度。溶于稀硫酸的目的是___________ 。
Ⅱ.青铜中铬元素含量的测定
i.称取1.00g青铜样品于250mL锥形瓶中,加入适量稀硝酸使其完全溶解,再加入适量过硫酸铵溶液,加热煮沸,使样品中的铬元素完全被氧化为 ,加蒸馏水至250mL,摇匀,冷却至室温。
,加蒸馏水至250mL,摇匀,冷却至室温。
ii.取25mL上述溶液置于锥形瓶中,滴入4滴N-苯代邻氨基苯甲酸指示剂,用
 溶液滴定(加入硫酸酸化),当
溶液滴定(加入硫酸酸化),当 (弱酸)转化为
(弱酸)转化为 时,溶液由紫红色变为黄绿色,达到滴定终点。
时,溶液由紫红色变为黄绿色,达到滴定终点。
(3)滴定时将 溶液加入
溶液加入_____ (填“酸式”或“碱式”)滴定管中,重复四次的实验数据如下表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则
_____ 。

(4)过程ii中发生反应的离子方程式为___________ 。
(5)样品中所含铬元素的质量分数为___________ 。
(6)上述实验过程中,若有部分 溶液被空气氧化,则测定结果将
溶液被空气氧化,则测定结果将_____ (填“偏高”“偏低”或“不变”)。检验 溶液是否被空气氧化可选择的试剂为
溶液是否被空气氧化可选择的试剂为___ (填序号)。
A. 溶液 B.KSCN溶液 C.
溶液 B.KSCN溶液 C. 溶液
溶液
回答下列问题:
Ⅰ.配制1000mL

 溶液
溶液(1)配制
 溶液需要的玻璃仪器除烧杯、量筒、玻璃棒外,还有
溶液需要的玻璃仪器除烧杯、量筒、玻璃棒外,还有(2)将7.84g
 {已知
{已知 }固体溶于稀硫酸,加水稀释至所需浓度。溶于稀硫酸的目的是
}固体溶于稀硫酸,加水稀释至所需浓度。溶于稀硫酸的目的是Ⅱ.青铜中铬元素含量的测定
i.称取1.00g青铜样品于250mL锥形瓶中,加入适量稀硝酸使其完全溶解,再加入适量过硫酸铵溶液,加热煮沸,使样品中的铬元素完全被氧化为
 ,加蒸馏水至250mL,摇匀,冷却至室温。
,加蒸馏水至250mL,摇匀,冷却至室温。ii.取25mL上述溶液置于锥形瓶中,滴入4滴N-苯代邻氨基苯甲酸指示剂,用

 溶液滴定(加入硫酸酸化),当
溶液滴定(加入硫酸酸化),当 (弱酸)转化为
(弱酸)转化为 时,溶液由紫红色变为黄绿色,达到滴定终点。
时,溶液由紫红色变为黄绿色,达到滴定终点。(3)滴定时将
 溶液加入
溶液加入
| 实验序号 | 消耗 溶液的体积/mL 溶液的体积/mL |
| 1 | 19.98 |
| 2 | 17.97 |
| 3 |  |
| 4 | 18.03 |

(4)过程ii中发生反应的离子方程式为
(5)样品中所含铬元素的质量分数为
(6)上述实验过程中,若有部分
 溶液被空气氧化,则测定结果将
溶液被空气氧化,则测定结果将 溶液是否被空气氧化可选择的试剂为
溶液是否被空气氧化可选择的试剂为A.
 溶液 B.KSCN溶液 C.
溶液 B.KSCN溶液 C. 溶液
溶液
您最近一年使用:0次
2021-12-03更新
|
207次组卷
|
2卷引用:山东省日照市五莲县2021-2022学年高二上学期期中考试化学试题
8 . 某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。实验室制取亚氯酸钠的装置如图所示:
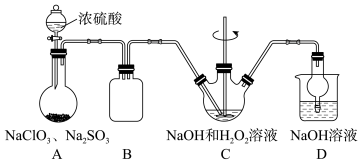
已知:ClO2浓度过高时易发生分解;
(1)装置A中工业上常用H2C2O4代替Na2SO3来制备ClO2,反应的化学方程式为2NaClO3+H2C2O4=Na2CO3+CO2↑+2ClO2↑+H2O,相比较而言,用H2C2O4制备ClO2,其优点为_______ 。
(2)装置C用于制备亚氯酸钠(NaClO2),装置C中发生的离子方程式为_______ 。装置C中反应为放热反应,在不改变反应物浓度和体积及搅拌速度的条件下,为了防止温度过高,实验中可采取的措施:缓慢滴加浓硫酸、_______ 。
(3)设计验证装置C中生成的NaClO2(混有少量H2O2)具有氧化性的实验方案:取反应后装置C中的溶液,调节溶液呈中性,_______ 。(已知:酸性条件下NaClO2将I-氧化为I2,实验中须使用的试剂:MnO2、稀硫酸溶液、KI—淀粉溶液)
(4)测定实验所得亚氯酸钠样品中的NaClO2含量(杂质不参与反应)的方法如下:准确称取4.500g亚氯酸钠样品,加入1.00mol·L-1稀硫酸至完全溶解配制成100.00mL溶液,取出10.00mL溶液于锥形瓶中,先加入1.000mol·L-1硫酸亚铁标准溶液30.00mL,充分反应后,再用0.1000mol·L-1酸性K2Cr2O7溶液滴定至终点,消耗酸性K2Cr2O7溶液20.00mL。过程中发生的方程式为:
NaClO2+4FeSO4+2H2SO4=NaCl+2Fe2(SO4)3+2H2O
6FeSO4+K2Cr2O7+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
计算样品中NaClO2的质量分数,写出计算过程______ 。

已知:ClO2浓度过高时易发生分解;
(1)装置A中工业上常用H2C2O4代替Na2SO3来制备ClO2,反应的化学方程式为2NaClO3+H2C2O4=Na2CO3+CO2↑+2ClO2↑+H2O,相比较而言,用H2C2O4制备ClO2,其优点为
(2)装置C用于制备亚氯酸钠(NaClO2),装置C中发生的离子方程式为
(3)设计验证装置C中生成的NaClO2(混有少量H2O2)具有氧化性的实验方案:取反应后装置C中的溶液,调节溶液呈中性,
(4)测定实验所得亚氯酸钠样品中的NaClO2含量(杂质不参与反应)的方法如下:准确称取4.500g亚氯酸钠样品,加入1.00mol·L-1稀硫酸至完全溶解配制成100.00mL溶液,取出10.00mL溶液于锥形瓶中,先加入1.000mol·L-1硫酸亚铁标准溶液30.00mL,充分反应后,再用0.1000mol·L-1酸性K2Cr2O7溶液滴定至终点,消耗酸性K2Cr2O7溶液20.00mL。过程中发生的方程式为:
NaClO2+4FeSO4+2H2SO4=NaCl+2Fe2(SO4)3+2H2O
6FeSO4+K2Cr2O7+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
计算样品中NaClO2的质量分数,写出计算过程
您最近一年使用:0次
名校
解题方法
9 . 高锰酸钾溶液常用于物质的定性检验与定量分析。
Ⅰ.实验室里欲用 固体来配制250mL 0.1
固体来配制250mL 0.1 的
的 溶液。(已知
溶液。(已知 的式量:158)
的式量:158)
(1)计算所需 固体的质量为
固体的质量为_____ g。
(2)下列操作中,容量瓶不具备的功能是___________。
(3)将C和B中空填完整,然后写出配制的正确操作顺序(字母表示,每个字母只能用一次) _____
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用电子天平称取一定质量的高锰酸钾固体,倒入烧杯中,加水溶解,用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入_____
D.将容量瓶盖紧,颠倒摇匀
E.改用_____ 加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)配制过程中,下列操作导致溶液浓度偏小的是___________(填序号)
Ⅱ.为了增强高锰酸钾溶液的氧化性,需要加入2mol/L的稀硫酸溶液。现用其测定某补血剂片中亚铁的含量:称取含 的补血剂片a克,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。
的补血剂片a克,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。
已知发生的化学反应为: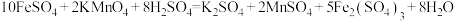
(5)加入的稀硫酸中c(H+)为_____  。
。
(6)则该补血剂中 的质量分数为
的质量分数为_____ (用a表示)
Ⅰ.实验室里欲用
 固体来配制250mL 0.1
固体来配制250mL 0.1 的
的 溶液。(已知
溶液。(已知 的式量:158)
的式量:158)(1)计算所需
 固体的质量为
固体的质量为(2)下列操作中,容量瓶不具备的功能是___________。
| A.配制一定体积准确浓度的溶液 | B.贮存溶液 |
| C.量取任意体积的溶液 | D.溶解固体溶质 |
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用电子天平称取一定质量的高锰酸钾固体,倒入烧杯中,加水溶解,用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入
D.将容量瓶盖紧,颠倒摇匀
E.改用
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)配制过程中,下列操作导致溶液浓度偏小的是___________(填序号)
| A.加水定容时俯视刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
Ⅱ.为了增强高锰酸钾溶液的氧化性,需要加入2mol/L的稀硫酸溶液。现用其测定某补血剂片中亚铁的含量:称取含
 的补血剂片a克,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。
的补血剂片a克,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。已知发生的化学反应为:
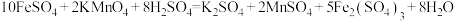
(5)加入的稀硫酸中c(H+)为
 。
。(6)则该补血剂中
 的质量分数为
的质量分数为
您最近一年使用:0次
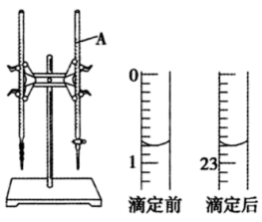
10 . 酸碱反应是生产生活实际中常见的反应之一、下图是用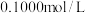 的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
请回答下列问题;
(1)仪器A的名称是___________ 。
(2)依上图所示,此次滴定盐酸消耗的体积为___________ mL。
(3)某实验小组同学的三次实验的实验数据如下表所示。
①此次滴定时选择的指示剂为___________ 。
②则待测NaOH溶液的平均浓度是___________  (保留四位有效数字)。
(保留四位有效数字)。
(4)对下列实验过程,因操作不正确而引起的误差,使待测NaOH溶液浓度偏高的有_______ (填序号)。
①酸式滴定管水洗后在装液前未用标准盐酸润洗2~3次
②开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
③锥形瓶未干燥,有少量蒸馏水
④盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
⑤放出碱液的滴定管开始有气泡,放出液体后气泡消失
⑥溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液,颜色无变化
⑦酸式滴定管滴定前仰视读数,滴定后俯视读数
⑧振荡锥形瓶时部分液体溅出
(5)某实验小组为测定某固体样品中 的含量,该物质的摩尔质量为
的含量,该物质的摩尔质量为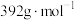 ,做了如下实验:
,做了如下实验:
测定原理: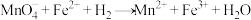 (方程式未配平)
(方程式未配平)
测定步骤:步骤一,准确称量20.00g样品,配制成100mL溶液。
步骤二,取所配溶液25.00mL于锥形瓶中,加稀 酸化,用
酸化,用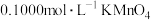 溶液滴定至终点,重复两次,平均消耗
溶液滴定至终点,重复两次,平均消耗 溶液16.00mL。
溶液16.00mL。
①如何判断到达滴定终点?___________ 。
②产品中 的质量分数为
的质量分数为___________ %(保留到小数点后一位)。
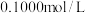 的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
请回答下列问题;
(1)仪器A的名称是
(2)依上图所示,此次滴定盐酸消耗的体积为
(3)某实验小组同学的三次实验的实验数据如下表所示。
| 实验编号 | 待测NaOH溶液的体积/mL | 滴定前盐酸的体积读数/mL | 滴定后盐酸的体积读数/mL |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 1.21 | 29.21 |
| 3 | 20.00 | 1.50 | 23.48 |
②则待测NaOH溶液的平均浓度是
 (保留四位有效数字)。
(保留四位有效数字)。(4)对下列实验过程,因操作不正确而引起的误差,使待测NaOH溶液浓度偏高的有
①酸式滴定管水洗后在装液前未用标准盐酸润洗2~3次
②开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
③锥形瓶未干燥,有少量蒸馏水
④盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
⑤放出碱液的滴定管开始有气泡,放出液体后气泡消失
⑥溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液,颜色无变化
⑦酸式滴定管滴定前仰视读数,滴定后俯视读数
⑧振荡锥形瓶时部分液体溅出
(5)某实验小组为测定某固体样品中
 的含量,该物质的摩尔质量为
的含量,该物质的摩尔质量为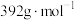 ,做了如下实验:
,做了如下实验:测定原理:
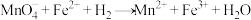 (方程式未配平)
(方程式未配平)测定步骤:步骤一,准确称量20.00g样品,配制成100mL溶液。
步骤二,取所配溶液25.00mL于锥形瓶中,加稀
 酸化,用
酸化,用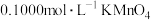 溶液滴定至终点,重复两次,平均消耗
溶液滴定至终点,重复两次,平均消耗 溶液16.00mL。
溶液16.00mL。①如何判断到达滴定终点?
②产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2021-12-05更新
|
284次组卷
|
2卷引用:辽宁省大连市2021-2022学年高二上学期期中考试化学试题



