名校
1 . 某研究小组探究酸碱性对 和
和 反应的影响。
反应的影响。
资料: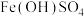 为黄色固体,难溶于水,可溶于酸。
为黄色固体,难溶于水,可溶于酸。
Ⅰ.无外加酸碱时,实验如下。
实验ⅰ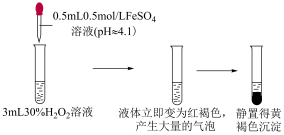
实验ⅱ
(1)根据_____ ,可证实实验ⅰ中红褐色液体为胶体。
(2)已知黄褐色沉淀中有 ,还可能存在
,还可能存在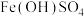 ,设计实验证实
,设计实验证实_____ 。(填操作和现象)
(3)结合化学用语,解释无外加酸碱时反应结束后 降低的原因
降低的原因_____ 。
Ⅱ.外加酸碱条件下,实验如下。
(4)根据实验ⅲ,推测立即产生大量气体的原因。
猜想一: 催化
催化 分解。
分解。
猜想二:_____ 。
设计实验_____ ,证实猜想一不是立即产生大量气体的主要原因。
(5) 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因
是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因_____ 。
主要反应机理:
注: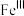 代表
代表 的化合价为+3
的化合价为+3
(6)已知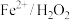 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于
体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 有强氧化性,根据以上实验探究,配制该体系最好控制在
有强氧化性,根据以上实验探究,配制该体系最好控制在_____ 条件下。
 和
和 反应的影响。
反应的影响。资料:
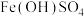 为黄色固体,难溶于水,可溶于酸。
为黄色固体,难溶于水,可溶于酸。Ⅰ.无外加酸碱时,实验如下。
实验ⅰ

实验ⅱ

(1)根据
(2)已知黄褐色沉淀中有
 ,还可能存在
,还可能存在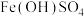 ,设计实验证实
,设计实验证实(3)结合化学用语,解释无外加酸碱时反应结束后
 降低的原因
降低的原因Ⅱ.外加酸碱条件下,实验如下。
| 实验编号 | 实验操作 | 现象 |
| ⅲ | 取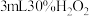 溶液于试管中,滴加 溶液于试管中,滴加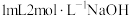 溶液,再滴加 溶液,再滴加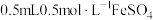 溶液 溶液 | 液体变为红褐色,立即产生大量气体,有液体喷出试管,最终产生大量红褐色沉淀 |
| ⅳ | 取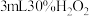 溶液于试管中,滴加 溶液于试管中,滴加 稀硫酸,再滴加 稀硫酸,再滴加 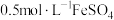 溶液 溶液 | 溶液呈黄色,有少量气泡产生,静置无沉淀产生 |
(4)根据实验ⅲ,推测立即产生大量气体的原因。
猜想一:
 催化
催化 分解。
分解。猜想二:
设计实验
(5)
 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因
是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因主要反应机理:
①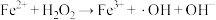 | ② ( ( 的水解) 的水解) |
③ | ④ |
⑤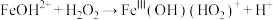 | ⑥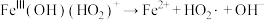 |
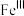 代表
代表 的化合价为+3
的化合价为+3(6)已知
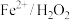 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于
体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 有强氧化性,根据以上实验探究,配制该体系最好控制在
有强氧化性,根据以上实验探究,配制该体系最好控制在
您最近一年使用:0次
2024-01-21更新
|
123次组卷
|
2卷引用:北京市丰台区2023-2024学年高二上学期期末考试化学试题
2 . 实验小组用如图装置探究 、
、 、
、 的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。 遇淀粉溶液变蓝
遇淀粉溶液变蓝
实验过程:
Ⅰ.打开弹簧夹 和
和 ,通入一段时间
,通入一段时间 ,再将导管插入
,再将导管插入 中,继续通入
中,继续通入 一段时间,然后夹紧
一段时间,然后夹紧 ;
;
Ⅱ.打开活塞 ,滴加一定量浓盐酸后关闭活塞
,滴加一定量浓盐酸后关闭活塞 ,给
,给 加热;
加热;
Ⅲ.当 中的溶液变为黄色时,停止加热,夹紧
中的溶液变为黄色时,停止加热,夹紧 ;
;
Ⅳ.打开活塞 ,将少量
,将少量 中溶液滴入
中溶液滴入 中,关闭活塞
中,关闭活塞 。
。
(1) 中发生反应的化学方程式是
中发生反应的化学方程式是______ 。
(2)浸有 溶液的棉花上发生反应的离子方程式是
溶液的棉花上发生反应的离子方程式是______ 。
(3) 中溶液变黄说明氧化性
中溶液变黄说明氧化性 ,反应的离子方程式是
,反应的离子方程式是______ 。
(4)为探究 和
和 的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测
的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测 中黄色溶液和
中黄色溶液和 中混合溶液中的
中混合溶液中的部分 微粒,结果如表所示(忽略空气中 的影响)。
的影响)。
①检验 中黄色溶液中含有
中黄色溶液中含有 的试剂是
的试剂是______ 。
②进一步检验 的实验操作及现象是
的实验操作及现象是______ 。
③能证明该实验条件下氧化性 的有
的有______ (填“甲”“乙”或“丙”)。不能证明的请说明理由:______ 。
 、
、 、
、 的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。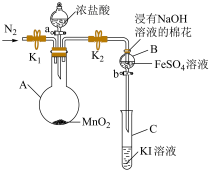
 遇淀粉溶液变蓝
遇淀粉溶液变蓝实验过程:
Ⅰ.打开弹簧夹
 和
和 ,通入一段时间
,通入一段时间 ,再将导管插入
,再将导管插入 中,继续通入
中,继续通入 一段时间,然后夹紧
一段时间,然后夹紧 ;
;Ⅱ.打开活塞
 ,滴加一定量浓盐酸后关闭活塞
,滴加一定量浓盐酸后关闭活塞 ,给
,给 加热;
加热;Ⅲ.当
 中的溶液变为黄色时,停止加热,夹紧
中的溶液变为黄色时,停止加热,夹紧 ;
;Ⅳ.打开活塞
 ,将少量
,将少量 中溶液滴入
中溶液滴入 中,关闭活塞
中,关闭活塞 。
。(1)
 中发生反应的化学方程式是
中发生反应的化学方程式是(2)浸有
 溶液的棉花上发生反应的离子方程式是
溶液的棉花上发生反应的离子方程式是(3)
 中溶液变黄说明氧化性
中溶液变黄说明氧化性 ,反应的离子方程式是
,反应的离子方程式是(4)为探究
 和
和 的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测
的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测 中黄色溶液和
中黄色溶液和 中混合溶液中的
中混合溶液中的 的影响)。
的影响)。
|
| |
甲 | 既有 | 有 |
乙 | 有 | 有 |
丙 | 有 | 有 |
 中黄色溶液中含有
中黄色溶液中含有 的试剂是
的试剂是②进一步检验
 的实验操作及现象是
的实验操作及现象是③能证明该实验条件下氧化性
 的有
的有
您最近一年使用:0次
2024-01-20更新
|
157次组卷
|
2卷引用:北京市西城区2023-2024学年高一上学期期末考试化学试卷
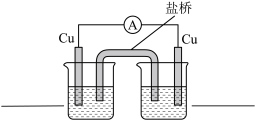
3 . 某化学小组以铜为阳极、石墨为阴极,研究在不同的电解质溶液中铜被氧化的价态及产物。实验装置如图所示(电源装置略去)。

资料:i.Cu2O为砖红色,CuCl为白色,CuOH为黄色且易分解
ii.[Cu(NH3)2]+为无色,在空气中易被氧化为深蓝色[Cu(NH3)4]2+
iii.25 ℃时,Ksp(CuCl)=1.2×10-6,Ksp(CuOH)= 1.2×10-14
实验记录如下:
(1)I中铜电极的电极反应式是___________ 。
(2)II中沉淀由黄色变为砖红色的化学方程式是___________ 。
(3)将III中所得白色沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为CuCl。

①证明III中所得白色沉淀中有Cu+的证据是___________ 。
②步骤iii的操作是___________ 。
(4)III中下端白色沉淀最终变为砖红色的原因是:白色沉淀为CuCl,___________ ,CuOH不稳定易分解为砖红色的Cu2O。
(5)IV中Cu未被氧化的原因是________ 。
(6)综上,铜被氧化的价态及产物与________ 有关。

资料:i.Cu2O为砖红色,CuCl为白色,CuOH为黄色且易分解
ii.[Cu(NH3)2]+为无色,在空气中易被氧化为深蓝色[Cu(NH3)4]2+
iii.25 ℃时,Ksp(CuCl)=1.2×10-6,Ksp(CuOH)= 1.2×10-14
实验记录如下:
| 实验 | 电解质溶液(3 mol/L) | 现象 | |
| 铜电极附近 | 石墨电极 | ||
| I | H2SO4 | 溶液变蓝 | 产生无色气泡,一段时间后有少量红色金属析出 |
| II | NaOH | 出现黄色浑浊,很快变为砖红色 | 产生无色气泡 |
| III | NaCl | 出现白色浑浊,浑浊向下扩散,一段时间后,下端白色沉淀变黄,最终为砖红色 | 产生无色气泡 |
| IV | KI | 迅速产生棕褐色的物质,滴入1 滴淀粉溶液, 立即变为蓝色;取出铜电极洗净检验,无变化 | 产生无色气泡 |
(2)II中沉淀由黄色变为砖红色的化学方程式是
(3)将III中所得白色沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为CuCl。

①证明III中所得白色沉淀中有Cu+的证据是
②步骤iii的操作是
(4)III中下端白色沉淀最终变为砖红色的原因是:白色沉淀为CuCl,
(5)IV中Cu未被氧化的原因是
(6)综上,铜被氧化的价态及产物与
您最近一年使用:0次
名校
4 . 某小组分别进行如下3组实验研究 与
与 的反应,实验记录如下:
的反应,实验记录如下:
已知:水溶液中, 为白色沉淀,
为白色沉淀,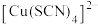 呈黄色。
呈黄色。 被称为“拟卤素”。
被称为“拟卤素”。
下列说法不正确的是
 与
与 的反应,实验记录如下:
的反应,实验记录如下:| 序号 | 实验 | 试剂 | 现象 |
| ① |  | 1滴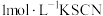 溶液 溶液 | 溶液迅速变绿,未见白色沉淀生成; 静置2小时后底部有少量白色沉淀 |
| ② | 先加入5滴 溶液,再加入1滴 溶液,再加入1滴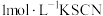 溶液 溶液 | 溶液变红,未见白色沉淀生成 | |
| ③ | 先加入5滴 溶液,再加入1滴 溶液,再加入1滴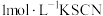 溶液 溶液 | 溶液变红,同时迅速生成白色沉淀,振荡后红色消失 |
 为白色沉淀,
为白色沉淀,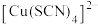 呈黄色。
呈黄色。 被称为“拟卤素”。
被称为“拟卤素”。下列说法不正确的是
A.①中生成白色沉淀的原因是: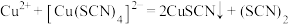 |
| B.由①可推知:①中生成配合物反应的反应速率大于氧化还原反应的 |
C.由②③可推知,结合 的能力: 的能力: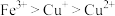 |
D.由①③可推知: 促进了 促进了 转化为 转化为 |
您最近一年使用:0次
2024-01-19更新
|
341次组卷
|
4卷引用:北京市海淀区2023-2024学年高三上学期期末考试化学试卷
5 . 氧化还原反应可拆分为氧化和还原两个“半反应”,某小组同学从“半反应”的角度探究反应规律。
(1)已知: 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。
①该转化的还原半反应是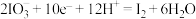 ,则相应的氧化半反应是
,则相应的氧化半反应是___________ 。
②分析上述还原半反应可知:增大 可促进
可促进 得到电子,使其
得到电子,使其___________ 性增强,进而与 发生反应。
发生反应。
(2)探究 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。
①有同学认为 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是___________ 。
用如下装置进行实验【硫酸与浓盐酸中 接近】。
接近】。
②甲实验的目的是___________ 。
③a.丙中气球变鼓是因为生成了___________ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:___________ 。
(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧 电极表面有
电极表面有 析出。
析出。
①该装置中左侧  电极作
电极作___________ (填“正”或“负”)极。
②写出该装置右侧 烧杯中的电极反应式___________ 。
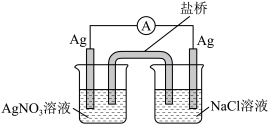
对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池__________ 。
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,并标出电子的移动方向 。
b.若不能,说明原因。
(1)已知:
 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。①该转化的还原半反应是
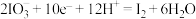 ,则相应的氧化半反应是
,则相应的氧化半反应是②分析上述还原半反应可知:增大
 可促进
可促进 得到电子,使其
得到电子,使其 发生反应。
发生反应。(2)探究
 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。①有同学认为
 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是用如下装置进行实验【硫酸与浓盐酸中
 接近】。
接近】。| 装置 | 序号 | 试管内药品 | 现象 |
 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 |  粉+硫酸 粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 |  粉+浓盐酸 粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在
 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧
 电极表面有
电极表面有 析出。
析出。①该装置中
 电极作
电极作②写出该装置

对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,
b.若不能,说明原因。
您最近一年使用:0次
解题方法
6 . 钠与水反应的实验过程如图①、②、③所示。

(1)将图②中的现象与解释用直线连接起来________ 。
(2)图③中滴加酚酞试液后,观察到溶液变红,说明有___________ 生成;
(3)钠与水反应的化学方程式是___________ 。

(1)将图②中的现象与解释用直线连接起来
| 实验现象 | 解释 |
| 钠熔成小球 | 产生了气体 |
| 钠四处游动,嘶嘶作响 | 钠的密度比水小 |
| 钠浮在水面上 | 钠与水反应放热且钠的熔点低 |
(2)图③中滴加酚酞试液后,观察到溶液变红,说明有
(3)钠与水反应的化学方程式是
您最近一年使用:0次
7 . 某小组同学进行Na2CO3和NaHCO3性质的探究,实验如下(夹持装置已略去,气密性已检验)。
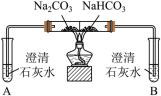
【实验一】
(1)实验I,能够证明Na2CO3的热稳定性强于NaHCO3的证据是___________ 。
(2)实验II,试剂a为___________ 。
(3)实验II,持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:___________ 。
【实验二】
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱。
(4)实验I中,溶解时吸收热量的物质是___________ (写化学式)。
(5)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为___________ ,(OH-未参与该反应的实验证据是___________ 。
(6)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,参与反应的离子有___________ 。
【实验一】
| 实验I | 实验II |
 |  |
(2)实验II,试剂a为
(3)实验II,持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:
【实验二】
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱。
| 编号 | 实验操作 | 实验数据 |
| 实验I | 测量下述实验过程的温度变化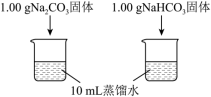 |  |
| 实验操作 | 实验数据 | |
| 实验II | 测量下述实验过程的pH变化 | ②和③中均产生白色沉淀。 各烧杯中pH变化如下图所示 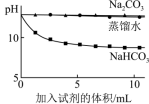 |
(5)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(6)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,参与反应的离子有
您最近一年使用:0次
8 . 某校化学实验兴趣小组同学设计了如图所示的实验装置,利用如下原理探究氯气的某些性质反应原理: .
.
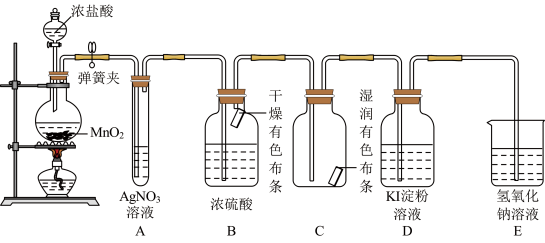
(1)A中产生现象是______ ,甲同学认为是 与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式
与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式______ 、______ ,乙同学则认为A中的现象不足以说明白色沉淀是 与水反应产生新物质的结果,理由是
与水反应产生新物质的结果,理由是______ .
(2)B和C中出现的不同现象可得出的结论是______ .
(3)装置D中产生的现象是______ ,该反应的基本反应类型是______ .
(4)E是尾气吸收装置,写出其中发生反应的离子方程式:______ ,丙同学将充分吸收了尾气之后的吸收液拿来做实验,向吸收液中滴加盐酸,产生了有刺激性气味的气体,写出该反应的离子方程式______ .
(5)工业上用氯气和石灰乳反应可制漂白粉,该反应方程式为:______ ,漂白粉需要密闭保存,原因是(用化学方程式表示)______ ,丁同学取漂白粉的溶液来做实验,向其中滴加碳酸钠溶液,观察到产生白色沉淀,请推测白色沉淀为______ (填化学式).
 .
.
(1)A中产生现象是
 与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式
与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式 与水反应产生新物质的结果,理由是
与水反应产生新物质的结果,理由是(2)B和C中出现的不同现象可得出的结论是
(3)装置D中产生的现象是
(4)E是尾气吸收装置,写出其中发生反应的离子方程式:
(5)工业上用氯气和石灰乳反应可制漂白粉,该反应方程式为:
您最近一年使用:0次
9 . 实验小组利用如下图所示的装置制备氯气及探究氯气的性质。
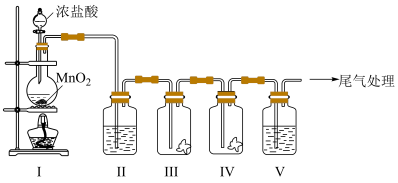
(1)I中制备氯气所发生反应的化学方程式是___________ 。
(2)Ⅱ的目的是除去氯气中的水蒸气,则瓶中盛放的试剂是___________ 。
(3)利用Ⅲ、IV装置探究氯气与水反应的产物。
①实验前,向Ⅲ、Ⅳ中均放入干燥的蓝色石蕊纸花,并向___________ (填Ⅲ或Ⅳ)中滴少量水将纸花润湿。
②实验时,根据Ⅲ中的纸花不变色及Ⅳ中___________ 现象,甲同学得出初步结论:氯气与水反应生成具有酸性 及漂白性 的物质。
③同学们分析后,认为用该实验装置得出“氯气与水反应有酸性物质生成”的结论不严谨,理由是___________ 。
(4)为推断氯气溶于水的产物并验证其光照分解的产物 ,利用数字传感器监测光照过程中某氯水的 、氯水中氯离子的浓度、装置中氧气的体积分数这三者随时间的变化,实验结果如下图所示:
、氯水中氯离子的浓度、装置中氧气的体积分数这三者随时间的变化,实验结果如下图所示:

支持“氯气与水反应有酸性物质生成”的实验证据是___________ ;
②结合此实验,氯气溶于水发生反应的化学方程式是___________ ;
③分析上述三条曲线的变化趋势,得出的结论是___________ 。

(1)I中制备氯气所发生反应的化学方程式是
(2)Ⅱ的目的是除去氯气中的水蒸气,则瓶中盛放的试剂是
(3)利用Ⅲ、IV装置探究氯气与水反应的产物。
①实验前,向Ⅲ、Ⅳ中均放入干燥的蓝色石蕊纸花,并向
②实验时,根据Ⅲ中的纸花不变色及Ⅳ中
③同学们分析后,认为用该实验装置得出“氯气与水反应有酸性物质生成”的结论不严谨,理由是
(4)
 、氯水中氯离子的浓度、装置中氧气的体积分数这三者随时间的变化,实验结果如下图所示:
、氯水中氯离子的浓度、装置中氧气的体积分数这三者随时间的变化,实验结果如下图所示:
支持“氯气与水反应有酸性物质生成”的实验证据是
②结合此实验,氯气溶于水发生反应的化学方程式是
③分析上述三条曲线的变化趋势,得出的结论是
您最近一年使用:0次
10 . 实验小组研究Na与CO2的反应,装置、步骤和现象如下:

实验步骤和现象:
i. 通入CO2至澄清石灰水浑浊后,点燃酒精灯。
ii. 一段时间后,硬质玻璃管中有白色物质产生,管壁上有黑色物质出现。检验CO的试剂未见明显变化。
iii. 将硬质玻璃管中的固体溶于水,未见气泡产生;过滤,向滤液中加入过量BaCl2溶液,产生白色沉淀;再次过滤,滤液呈碱性;取白色沉淀加入盐酸,产生气体。
iv. 将管壁上的黑色物质与浓硫酸混合加热,生成能使品红溶液褪色的气体。
下列说法不正确 的是

实验步骤和现象:
i. 通入CO2至澄清石灰水浑浊后,点燃酒精灯。
ii. 一段时间后,硬质玻璃管中有白色物质产生,管壁上有黑色物质出现。检验CO的试剂未见明显变化。
iii. 将硬质玻璃管中的固体溶于水,未见气泡产生;过滤,向滤液中加入过量BaCl2溶液,产生白色沉淀;再次过滤,滤液呈碱性;取白色沉淀加入盐酸,产生气体。
iv. 将管壁上的黑色物质与浓硫酸混合加热,生成能使品红溶液褪色的气体。
下列说法
| A.步骤i的目的是排除O2的干扰 |
| B.步骤iii证明白色物质是Na2CO3 与 NaOH |
C.步骤iv发生反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+ 2H2O CO2↑+2SO2↑+ 2H2O |
| D.根据以上实验推测:CO2与金属Mg也可能反应并被还原;CO2与金属K也可以发生反应并被还原 |
您最近一年使用:0次



