1 . 某实验小组探究KMnO4溶液与NH3以及铵盐溶液的反应。
已知: 的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
下列说法不正确 的是
已知:
 的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。| 实验 | 序号 | 试剂a | 实验现象 |
| Ⅰ | 8mol·L-1氨水(pH≈13) | 紫色变浅,底部有棕黑色沉淀 |
| Ⅱ | 0.1mol·L-1NaOH溶液 | 无明显变化 | |
| Ⅲ | 4mol·L-1(NH4)2SO4溶液(pH≈6) | 紫色略变浅,底部有少量棕黑色沉淀 | |
| Ⅳ | 硫酸酸化的4mol·L-1(NH4)2SO4溶液(pH≈1) | 紫色变浅 | |
| Ⅴ | 硫酸酸化的4mol·L-1NH4Cl溶液(pH≈1) | 紫色褪去 |
A.由Ⅱ可知,pH=13时,OH-不能还原 |
B.由Ⅰ、Ⅱ、Ⅲ可知,与 相比,NH3更易还原 相比,NH3更易还原 |
C.由Ⅲ、Ⅳ可探究溶液pH对 与 与 反应的影响 反应的影响 |
D.由Ⅳ、Ⅴ可知, 浓度降低,其还原性增强 浓度降低,其还原性增强 |
您最近一年使用:0次
2024-04-13更新
|
397次组卷
|
4卷引用:北京市海淀区2023-2024学年高三下学期期中练习化学试题
名校
2 . 某化学小组对卤代烷在不同条件下发生反应的情况进行实验探究。
[实验1]取一支试管,滴入15滴溴乙烷,加入1mL5%的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有___________的试管中,再加入2滴AgNO3溶液。溶液出现浑浊。
[实验2]向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌,再加入5mL1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过盛有___________试管A后,再通入盛有酸性KMnO4溶液的B试管。紫红色逐渐褪去。
请回答:
(1)补全试剂:实验1中___________ ,实验2中___________ 。溴乙烷发生水解反应的化学方程式是___________ 。
(2)已知:溴乙烷的沸点:38.4℃,1-溴丁烷的沸点:101.6℃
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是___________ 。
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性KMnO4溶液不褪色。由已知沸点差异分析实验失败的可能原因:___________ 。
(3)对比实验1和实验2所用试剂,有利于卤代烃消去反应发生的外部条件,除了弱极性溶剂外,还需要相对较___________ (填“高”或“低”)的温度。
(4)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是___________ (填序号)。
a.使反应混合物与金属钠反应
b.对产物进行质谱分析
c.对产物进行核磁共振氢谱分析
(5)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷(R-CH2-X)优先发生取代反应,叔卤代烷(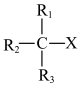 )优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
)优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:___________ 。
[实验1]取一支试管,滴入15滴溴乙烷,加入1mL5%的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有___________的试管中,再加入2滴AgNO3溶液。溶液出现浑浊。
[实验2]向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌,再加入5mL1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过盛有___________试管A后,再通入盛有酸性KMnO4溶液的B试管。紫红色逐渐褪去。
请回答:
(1)补全试剂:实验1中
(2)已知:溴乙烷的沸点:38.4℃,1-溴丁烷的沸点:101.6℃
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性KMnO4溶液不褪色。由已知沸点差异分析实验失败的可能原因:
(3)对比实验1和实验2所用试剂,有利于卤代烃消去反应发生的外部条件,除了弱极性溶剂外,还需要相对较
(4)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是
a.使反应混合物与金属钠反应
b.对产物进行质谱分析
c.对产物进行核磁共振氢谱分析
(5)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷(R-CH2-X)优先发生取代反应,叔卤代烷(
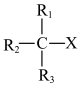 )优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
)优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
您最近一年使用:0次
3 . I.有机物种类繁多,性质多种多样。下列十种物质:①C2H5OH ②CH3CHO ③CH3COOH ④HOCH2CH2OH ⑤HOCH2(CHOH)4CHO⑥蛋白质 ⑦淀粉 ⑧油脂 ⑨酚醛树脂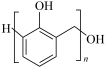 ⑩塑料
⑩塑料
(1)①~③中,沸点最高的是
(2)①~④中能发生缩合聚合反应的是
(3)①~⑤中含有手性碳原子的是
(4)属于天然高分子的是
(5)⑨单体为
II.某同学为验证酸性:醋酸>碳酸>苯酚,经仔细考虑,设计如下实验装置,请回答下列问题:
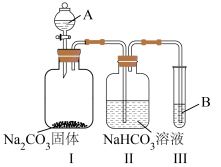
①醋酸溶液 ②CH3COONa溶液 ③苯酚溶液 ④苯酚钠溶液
(7)装置II中饱和NaHCO3溶液的作用
(8)能证明三种酸的酸性强弱的现象
(9)写出装置Ⅲ中发生反应的离子方程式
您最近一年使用:0次
名校
4 . I.某小组对Cu与浓HNO3的反应进行研究。记录如下:
(1)Cu与浓HNO3反应的化学方程式是___________ 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(2)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是___________ 。
(3)乙认为溶液呈绿色是由溶解的NO2引起的。
进行实验2:先将NO2通入B中,再鼓入N2,结果证实假设成立。
则以上两步操作对应的现象分别是___________ 、___________ 。
(4)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O= HNO3+HNO2;
HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii. 能与Cu2+反应:Cu2+(蓝色)+4
能与Cu2+反应:Cu2+(蓝色)+4

 (绿色)
(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了 使溶液呈绿色。
使溶液呈绿色。
丙进行如下实验:
①亚硝酸分解的化学方程式是___________ 。
②请用平衡原理解释加入H2SO4后绿色溶液变蓝的原因:___________ 。
(5)根据实验得出结论:实验1中溶液A呈绿色的主要原因是___________ 。请依据实验现象阐述理由:___________ 。
| 装置 | 药品 | 现象 | |
| 实验1 |  | 0.64gCu片(0.01mol) Cu片和20.0 mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶 液B,…… |
(1)Cu与浓HNO3反应的化学方程式是
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(2)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是
(3)乙认为溶液呈绿色是由溶解的NO2引起的。
进行实验2:先将NO2通入B中,再鼓入N2,结果证实假设成立。
则以上两步操作对应的现象分别是
(4)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O= HNO3+HNO2;
HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.
 能与Cu2+反应:Cu2+(蓝色)+4
能与Cu2+反应:Cu2+(蓝色)+4

 (绿色)
(绿色)据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了
 使溶液呈绿色。
使溶液呈绿色。丙进行如下实验:
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01molCu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| iii.加水稀释 | 溶液立即变蓝 | |
| 实验4 | i.向20.0mL0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
②请用平衡原理解释加入H2SO4后绿色溶液变蓝的原因:
(5)根据实验得出结论:实验1中溶液A呈绿色的主要原因是
您最近一年使用:0次
名校
5 . 某课外小组探究二氧化碳与过氧化钠反应是否需要接触水,装置如下图。
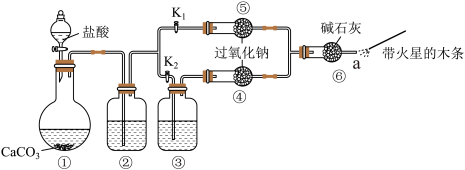
【装置分析】
(1)装置①中反应的离子方程式是___________ 。
(2)装置②中的试剂是___________ 。
(3)装置③中的试剂是___________ 。
【实验步骤】
步骤1:打开弹簧夹 。关闭
。关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
沙骤2:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是___________ ,甲同学因此得出了结论:二氧化碳与过氧化钠反应需要接触水。
(5)过氧化钠跟二氧化碳反应的化学方程式是___________ 。
【实验反思】
(6)乙同学不同意甲同学的结论,其理由是___________ 。
(7)乙同学认为可补充一个实验、实验方案是:取⑤中反应后的少量固体,___________ 。

【装置分析】
(1)装置①中反应的离子方程式是
(2)装置②中的试剂是
(3)装置③中的试剂是
【实验步骤】
步骤1:打开弹簧夹
 。关闭
。关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。沙骤2:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
(5)过氧化钠跟二氧化碳反应的化学方程式是
【实验反思】
(6)乙同学不同意甲同学的结论,其理由是
(7)乙同学认为可补充一个实验、实验方案是:取⑤中反应后的少量固体,
您最近一年使用:0次
名校
解题方法
6 . 为检验某加碘食盐中是否含有 ,取相同食盐样品进行下表所示实验:
,取相同食盐样品进行下表所示实验:
已知:
下列说法中正确的是
 ,取相同食盐样品进行下表所示实验:
,取相同食盐样品进行下表所示实验:已知:

| 实验① | 实验② | 实验③ |
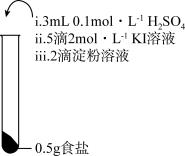 | 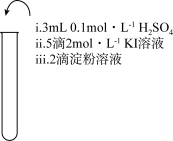 | 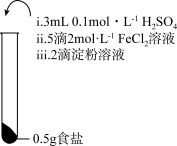 |
| 振荡,溶液迅速变为蓝色 | 振荡,一段时间后溶液变为浅蓝色 | 振荡,溶液变为浅黄色 |
A.仅由实验①就能证明食盐样品中存在 |
B.以上实验说明离子的还原性: |
C.实验③能证明食盐样品中不存在 |
D.实验②中发生反应的离子方程式为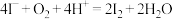 |
您最近一年使用:0次
2023-11-04更新
|
301次组卷
|
2卷引用:北京交通大学附属中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
7 . 某小组欲探究Cl2、Br2、I2氧化性的强弱。设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色;NaBr、KI、KCl溶液均无色。
(1)i中反应的离子方程式是___________ 。
(2)实验I可以得出三者的氧化性强弱关系是___________ 。
(3)①甲同学认为:实验Ⅱ观察到___________ 现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ,证明了氧化性Br2>I2。
补做实验Ⅲ的目的是___________ 。
(4)综合实验I和Ⅲ,得出氧化性强弱关系为:___________ 。
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色;NaBr、KI、KCl溶液均无色。
| 实验I | 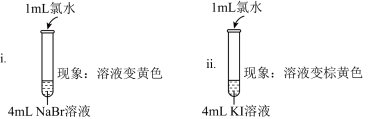 |
| 实验II | 取i中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(2)实验I可以得出三者的氧化性强弱关系是
(3)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ,证明了氧化性Br2>I2。
| 实验Ⅲ | 另取i中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
(4)综合实验I和Ⅲ,得出氧化性强弱关系为:
您最近一年使用:0次
2023-10-17更新
|
93次组卷
|
2卷引用:北京市第一○一中学(温泉校区)2023-2024学年高一上学期10月月考化学试题
名校
解题方法
8 . 为探究化学平衡移动原理与氧化还原反应规律的联系,某同学对 溶液和铬(VI)盐溶液的反应规律进行研究,并进行如下实验:
溶液和铬(VI)盐溶液的反应规律进行研究,并进行如下实验:
已知:①
②铬(VI)盐即六价的铬盐,被还原生成 (绿色)
(绿色)
(1)进行实验ⅰ和ⅱ:
用离子方程式解释ⅰ中现象:___________ 。
(2)继续进行实验ⅲ:
为了说明产生上述现象的原因,补充实验:向2mL蒸馏水中滴加 的
的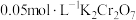 橙色溶液3滴,溶液变成浅橙色。
橙色溶液3滴,溶液变成浅橙色。
①补充实验的目的是___________ 。
②用化学平衡移动原理解释ⅲ中现象:___________ 。
③根据实验ⅰ~ⅲ,可推测: 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下, 溶液和铬(VI)盐溶液不发生氧化还原反应;
溶液和铬(VI)盐溶液不发生氧化还原反应;
b.___________ 。
④向实验ⅲ所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是___________ 。
(3)为探究溶液酸性增强对 溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,电压为 。
。
b.向U型管左侧溶液中滴加硫酸至 后,电压增大了
后,电压增大了 。
。
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
①上述实验说明:___________ 。
②有同学认为该实验不够严谨,理由是:___________ 也会使电压增大,于是补做了一个实验:U型管左管中盛放 的
的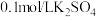 溶液,右管盛放饱和
溶液,右管盛放饱和 溶液,闭合K记录电压;先向左管溶液中滴加硫酸至
溶液,闭合K记录电压;先向左管溶液中滴加硫酸至 后,记录电压,测得电压增大了z,
后,记录电压,测得电压增大了z, 证明实验结论不受影响。
证明实验结论不受影响。
 溶液和铬(VI)盐溶液的反应规律进行研究,并进行如下实验:
溶液和铬(VI)盐溶液的反应规律进行研究,并进行如下实验:已知:①

②铬(VI)盐即六价的铬盐,被还原生成
 (绿色)
(绿色)(1)进行实验ⅰ和ⅱ:
| 序号 | 操作 | 现象 |
| ⅰ | 向2mL 的 的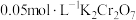 橙色溶液中滴加饱和 橙色溶液中滴加饱和 溶液(pH约为9)3滴 溶液(pH约为9)3滴 | 溶液变绿色(含 ) ) |
| ⅱ | 向2mL 的 的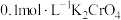 黄色溶液中滴加饱和 黄色溶液中滴加饱和 溶液3滴 溶液3滴 | 溶液没有明显变化 |
(2)继续进行实验ⅲ:
| 序号 | 操作 | 现象 |
| ⅲ | 向2mL饱和 溶液中滴加 溶液中滴加 的 的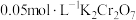 橙色溶液3滴 橙色溶液3滴 | 溶液变黄色 |
 的
的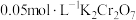 橙色溶液3滴,溶液变成浅橙色。
橙色溶液3滴,溶液变成浅橙色。①补充实验的目的是
②用化学平衡移动原理解释ⅲ中现象:
③根据实验ⅰ~ⅲ,可推测:
 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。a.碱性条件下,
 溶液和铬(VI)盐溶液不发生氧化还原反应;
溶液和铬(VI)盐溶液不发生氧化还原反应;b.
④向实验ⅲ所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是
(3)为探究溶液酸性增强对
 溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
a.K闭合时,电压为
 。
。b.向U型管左侧溶液中滴加硫酸至
 后,电压增大了
后,电压增大了 。
。c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
①上述实验说明:
②有同学认为该实验不够严谨,理由是:
 的
的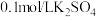 溶液,右管盛放饱和
溶液,右管盛放饱和 溶液,闭合K记录电压;先向左管溶液中滴加硫酸至
溶液,闭合K记录电压;先向左管溶液中滴加硫酸至 后,记录电压,测得电压增大了z,
后,记录电压,测得电压增大了z, 证明实验结论不受影响。
证明实验结论不受影响。
您最近一年使用:0次
9 . 某小组根据 SO2既有还原性又有氧化性,探究其能否实现 Cu2+→Cu 或 Cu→Cu2+的转化。
已知:i.水合 Cu+既易被氧化也易被还原,因此水溶液中无法生成水合 Cu+;
ii.CuCl 为白色固体,难溶于水,可溶于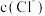 较大的溶液生成
较大的溶液生成  ,也可溶于氨水生成
,也可溶于氨水生成 (无色)。
(无色)。
Ⅰ.SO2与 Cu2+的反应:向试管中通入足量 SO2(尾气处理装置已略),记录如下。
(1)CuCl2溶液呈酸性的原因___________ (用离子方程式解释)。
(2)将 b 所得沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为 CuCl。

①证明白色沉淀中有 Cu+,推理过程是___________ 。
②iii 排除了干扰 Cl‒检验的因素。
写出 iii 中反应的离子方程式___________ ;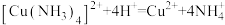
(3)进一步证实 b 中 SO2作还原剂,补全实验方案和预期现象:取 b 中反应后的上层清液于试管中,___________ 。
(4)由实验Ⅰ可推知,该条件下:①a 中 SO2不能将 Cu2+还原为 Cu+或 Cu;②SO2、CuCl、Cu 的还原性由强到弱的顺序为___________ 。
综上所述,改变还原产物的价态或形态可以影响氧化还原反应能否发生。
Ⅱ.SO2与 Cu 的反应:向试管中通入足量 SO2(尾气处理装置已略),记录如下。
(5)证明 d 所得棕色溶液中含有[CuCl3]2‒:用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因:___________ 。
(6)经进一步检验,铜表面黑色沉淀为 Cu2S。补全 d 中反应的离子方程式:___________ 。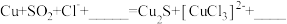
(7)与 c 对比,d 能够发生反应的原因是___________ 。
已知:i.水合 Cu+既易被氧化也易被还原,因此水溶液中无法生成水合 Cu+;
ii.CuCl 为白色固体,难溶于水,可溶于
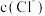 较大的溶液生成
较大的溶液生成  ,也可溶于氨水生成
,也可溶于氨水生成 (无色)。
(无色)。Ⅰ.SO2与 Cu2+的反应:向试管中通入足量 SO2(尾气处理装置已略),记录如下。
| 装置 | 编号 | 试剂 | 实验现象 |
 | a | 1 mol·L‒1 CuSO4溶液 | 始终无明显变化 |
b | 1 mol·L‒1 CuCl2溶液 | 溶液变绿,进而变棕黄色,一段时间后出现白色沉淀 |
(1)CuCl2溶液呈酸性的原因
(2)将 b 所得沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为 CuCl。

①证明白色沉淀中有 Cu+,推理过程是
②iii 排除了干扰 Cl‒检验的因素。
写出 iii 中反应的离子方程式
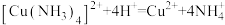
(3)进一步证实 b 中 SO2作还原剂,补全实验方案和预期现象:取 b 中反应后的上层清液于试管中,
(4)由实验Ⅰ可推知,该条件下:①a 中 SO2不能将 Cu2+还原为 Cu+或 Cu;②SO2、CuCl、Cu 的还原性由强到弱的顺序为
综上所述,改变还原产物的价态或形态可以影响氧化还原反应能否发生。
Ⅱ.SO2与 Cu 的反应:向试管中通入足量 SO2(尾气处理装置已略),记录如下。
| 装置 | 编号 | 试剂 | 实验现象 |
 | c | 3 mol·L‒1 稀硫酸 | 始终无明显变化 |
| d | 3 mol·L‒1 稀盐酸 | 铜片表面变黑,溶液变为棕色 |
(5)证明 d 所得棕色溶液中含有[CuCl3]2‒:用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因:
(6)经进一步检验,铜表面黑色沉淀为 Cu2S。补全 d 中反应的离子方程式:
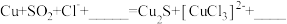
(7)与 c 对比,d 能够发生反应的原因是
您最近一年使用:0次
名校
解题方法
10 . 某小组同学探究 固体受热分解的产物,利用下图装置进行实验。
固体受热分解的产物,利用下图装置进行实验。

已知: 熔点-72℃,沸点-10℃;
熔点-72℃,沸点-10℃; 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。
下列关于 分解产物的判断及依据
分解产物的判断及依据不正确 的是
 固体受热分解的产物,利用下图装置进行实验。
固体受热分解的产物,利用下图装置进行实验。
| 实验过程 | 实验现象 | |
| Ⅰ | 通入一段时间 ,加热 ,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| Ⅱ | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| Ⅲ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| Ⅳ | 将Ⅲ所得溶液滴入D试管中 | 最终溶液变为浅绿色 |
 熔点-72℃,沸点-10℃;
熔点-72℃,沸点-10℃; 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。下列关于
 分解产物的判断及依据
分解产物的判断及依据A.由实验ⅠA中与实验Ⅲ中现象推断产物中有 |
B.由实验ⅠB中白色沉淀推断产物中一定含 |
C.由实验Ⅱ中现象推断产物中有 |
D.除实验Ⅳ中现象外,仅由实验ⅠA中固体颜色变化也可推断产物中可能含 |
您最近一年使用:0次




