13-14高三·全国·课后作业
名校
1 . 鉴别CH4、C2H4、C2H2三种气体可采用的方法是( )
| A.通入溴水中,观察溴水是否褪色 | B.通入酸化的KMnO4溶液中,观察颜色变化 |
| C.点燃,检验燃烧产物 | D.点燃,观察火焰明亮程度及产生黑烟的量多少 |
您最近一年使用:0次
2018-07-24更新
|
1019次组卷
|
14卷引用:2017-2018学年上海杨浦高级中学高二上期末考化学试卷
2017-2018学年上海杨浦高级中学高二上期末考化学试卷(已下线)2014年高二人教化学选修五2-1-2脂肪烃炔烃脂肪烃来源及应用练习卷2016-2017学年吉林省毓文中学高二上期中化学卷福建省南安市侨光中学2019-2020学年高一下学期第一次阶段考化学试题高二选择性必修3(人教版2019)第二章 烃 第二节 烯烃 炔烃 课时2 炔烃宁夏中宁县中宁中学2020-2021学年高二下学期第一次月考化学(B卷)试题宁夏中宁县中宁中学2020-2021学年高二下学期第一次月考化学(A卷)试题陕西省咸阳百灵学校2020-2021学年高二下学期期中考试化学试题课中-2.2.2 炔烃-人教2019选择性必修3青海省海南州中学、海南州贵德中学2021-2022学年高二上学期期中考试化学试题(已下线)7.2.2 烃及有机高分子材料——同步学习必备知识(已下线)2.2 烯烃、炔烃-同步学习必备知识第2课时 烃 有机高分子材料1四川省自贡市旭川中学2023-2024学年高二下学期期中考试化学试题
2 . 打印机墨粉中Fe3O4的含量是衡量墨粉质量优劣的重要指标之一,为测定某墨粉Fe3O4的含量,同学们在化学实验室中进行了如下实验。

已知:①墨粉中除Fe3O4外,其余成分既不含铁元素,也不溶于水、不与酸反应
②酸性高锰酸钾溶液呈紫红色,Mn2+溶液无色
(1)列举两个生成磁性氧化铁反应的化学方程式:___________ 、___________ 。
(2)检验Fe2+:
i.[实验原理]_______Fe2++______ +______H+=______Fe3++______Mn2++______H2O
+______H+=______Fe3++______Mn2++______H2O
配平上述离子方程式,并标出电子的转移方向和数目___________ 。
ii.[实验操作]取第一份溶液少许,向其中滴加酸性KMnO4溶液,振荡,观察到溶液紫色______ 。
iii.【实验结论】溶液中含Fe2+,同时证明Fe2+具有___________ 性。
(3)测定Fe3O4的含量:

i.加入足量氯水的目的是___________ ,有关反应的离子方程式是___________ 。
ii.加入足量NaOH溶液后观察到的现象是___________ 。
iii.沉淀加热时发生反应的化学方程式是___________ 。

已知:①墨粉中除Fe3O4外,其余成分既不含铁元素,也不溶于水、不与酸反应
②酸性高锰酸钾溶液呈紫红色,Mn2+溶液无色
(1)列举两个生成磁性氧化铁反应的化学方程式:
(2)检验Fe2+:
i.[实验原理]_______Fe2++______
 +______H+=______Fe3++______Mn2++______H2O
+______H+=______Fe3++______Mn2++______H2O配平上述离子方程式,并标出电子的转移方向和数目
ii.[实验操作]取第一份溶液少许,向其中滴加酸性KMnO4溶液,振荡,观察到溶液紫色
iii.【实验结论】溶液中含Fe2+,同时证明Fe2+具有
(3)测定Fe3O4的含量:

i.加入足量氯水的目的是
ii.加入足量NaOH溶液后观察到的现象是
iii.沉淀加热时发生反应的化学方程式是
您最近一年使用:0次
3 . 如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白:___ 。A中反应的离子方程式是___ 。
(2)实验开始时先将止水夹a___ (填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程____ 。
(4)实验完毕,打开b处止水夹,放入一部分空气,此时B瓶中发生反应的化学方程式 为___ 。
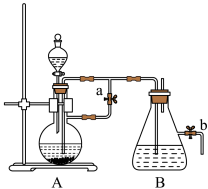
(2)实验开始时先将止水夹a
(3)简述生成Fe(OH)2的操作过程
(4)实验完毕,打开b处止水夹,放入一部分空气,此时B瓶中发生反应的化学方程式 为
您最近一年使用:0次
2019-10-23更新
|
934次组卷
|
20卷引用:上海市回民中学2023-2024学年高二上学期期中考试化学试题
上海市回民中学2023-2024学年高二上学期期中考试化学试题【全国百强校】内蒙古自治区集宁第一中学(西校区)2018-2019学年高一上学期期末考试化学试题(已下线)2019年8月6日 《每日一题》2020年高考一轮复习—— Fe(OH)2的性质及制备江西省上饶中学2019-2020学年高一上学期第一次月考(特零班)化学试题(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)第三章 章末检测(1)——《高中新教材同步备课》(人教版 必修第一册)(已下线)3.1.2 铁及其化合物之间的转化关系练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)安徽省池州市第一中学2020-2021学年高一12月月考化学试题黑龙江省伊春市伊美区第二中学2020-2021学年高一上学期期末考试化学试题(已下线)9.2 探究铁及其化合物的转化 练习-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)(已下线)第09讲 铁及其重要化合物(精讲)-2022年一轮复习讲练测(已下线)微专题14 氢氧化亚铁、高铁酸盐的制备实验探究-备战2022年高考化学考点微专题(已下线)第7讲 铁及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题37 有关铁及其化合物的综合实验探究-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)第07讲 铁及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第2讲 铁、铁的氧化物、铁的氢氧化物(已下线)第6讲 铁及其重要化合物(已下线)考点巩固卷03 金属及其化合物-2025年高考化学一轮复习考点通关卷(江苏专用)
4 . 甲同学计划探究+2价铁的化合物的性质。
(1)实验前甲同学预测:Fe2+肯定既有还原性又有氧化性。你认为甲同学预测的依据是_____ 。
(2)甲同学取少量FeSO4溶液,并滴入几滴酸性 溶液,观察到
溶液,观察到_______ 的现象;若加入活泼金属锌,则溶液颜色会_____ 。
(3)实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。保存FeCl2溶液的方法是加入_______ 。
(4)乙同学对+2价的 很感兴趣,他查阅到
很感兴趣,他查阅到 应为
应为_____ 色沉淀,但是他将FeSO4溶液与NaOH溶液混合后,该颜色的沉淀现象转瞬即逝,分析原因是(用化学方程式表示)_____ 。
(5)乙同学为了长时间观察到 的生成现象,设计了如图的电解装置。有关该装置说法不正确的是_______。
的生成现象,设计了如图的电解装置。有关该装置说法不正确的是_______。
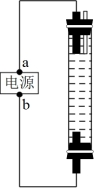
(1)实验前甲同学预测:Fe2+肯定既有还原性又有氧化性。你认为甲同学预测的依据是
(2)甲同学取少量FeSO4溶液,并滴入几滴酸性
 溶液,观察到
溶液,观察到(3)实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。保存FeCl2溶液的方法是加入
(4)乙同学对+2价的
 很感兴趣,他查阅到
很感兴趣,他查阅到 应为
应为(5)乙同学为了长时间观察到
 的生成现象,设计了如图的电解装置。有关该装置说法不正确的是_______。
的生成现象,设计了如图的电解装置。有关该装置说法不正确的是_______。
| A.a为电源正极,b为电源负极 | B.电解液一定是NaOH溶液 |
| C.两个电极都必须使用铁作电极 | D.阳极发生的电极反应为Fe-2e-=Fe2+ |
您最近一年使用:0次
解题方法
5 . 实验室里研究不同价态硫元素之间的转化。
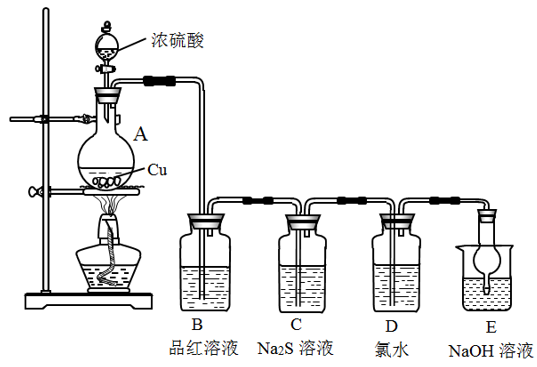
(1)盛装浓硫酸仪器的名称是___________ 。
(2)A装置中发生反应的化学方程式为___________ 。
(3)写出D装置中发生反应的离子方程式___________ 。
(4)C装置中观察到的现象是___________ ;上述实验体现SO2的性质有漂白性、氧化性和___________ 。
(5)下列有关硫及其化合物的叙述正确的是___________ 。
A.食品中添加适量二氧化硫可以起到防腐和抗氧化等作用
B.硫在足量空气中燃烧生成SO3
C.向SO2水溶液中滴加BaCl2溶液,会生成BaSO3白色沉淀
D.浓硫酸与蔗糖反应的实验体现了浓硫酸的脱水性和强氧化性
E.除去SO2中含有的少量HCl气体,可以使气体通过饱和Na2SO3溶液

(1)盛装浓硫酸仪器的名称是
(2)A装置中发生反应的化学方程式为
(3)写出D装置中发生反应的离子方程式
(4)C装置中观察到的现象是
(5)下列有关硫及其化合物的叙述正确的是
A.食品中添加适量二氧化硫可以起到防腐和抗氧化等作用
B.硫在足量空气中燃烧生成SO3
C.向SO2水溶液中滴加BaCl2溶液,会生成BaSO3白色沉淀
D.浓硫酸与蔗糖反应的实验体现了浓硫酸的脱水性和强氧化性
E.除去SO2中含有的少量HCl气体,可以使气体通过饱和Na2SO3溶液
您最近一年使用:0次
名校
6 . 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气(不收集),并试验氯气的某些性质,所用仪器如图所示。
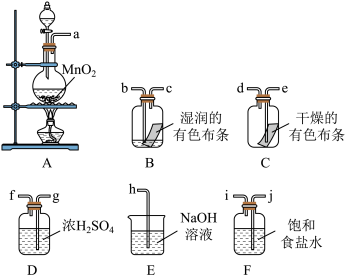
(1)按气流从左向右流向将各装置依次连接起来(填各接口处字母): _____a_______接_______;_______接_______;_______接_______;_______接_______;_______接____。____
(2)烧瓶中发生反应的化学方程式是:____ 。
(3)写出指定装置的作用,D:_______ ,E:_______ ,F:_______ 。
(4)C瓶中的现象是:_______ ,B瓶中的现象是:_______ ;以上事实说明起漂白作用的物质是_______ 。
(5)一定量的氢气在氯气中燃烧,所得混合物用100mL3.00mol/LNaOH溶液恰好完全吸收,测得溶液中NaClO的物质的量浓度为0.6mol/L(忽略溶液体积的变化),则:
①所得溶液中Cl-的物质的量浓度为_______ ;
②氯气和参加反应的氢气的物质的量之比为_______ 。

(1)按气流从左向右流向将各装置依次连接起来(填各接口处字母): _____a_______接_______;_______接_______;_______接_______;_______接_______;_______接____。
(2)烧瓶中发生反应的化学方程式是:
(3)写出指定装置的作用,D:
(4)C瓶中的现象是:
(5)一定量的氢气在氯气中燃烧,所得混合物用100mL3.00mol/LNaOH溶液恰好完全吸收,测得溶液中NaClO的物质的量浓度为0.6mol/L(忽略溶液体积的变化),则:
①所得溶液中Cl-的物质的量浓度为
②氯气和参加反应的氢气的物质的量之比为
您最近一年使用:0次
2022-10-31更新
|
179次组卷
|
2卷引用:上海市格致中学2020-2021学年高一上学期期中考试化学试题
7 . 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验,点滴板上描述的现象正确的是
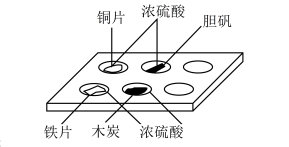
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅黄色
④装有木炭的孔穴中无明显现象

①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅黄色
④装有木炭的孔穴中无明显现象
| A.①③ | B.②③ | C.①④ | D.②④ |
您最近一年使用:0次
名校
解题方法
8 . 为研究氯水性质,某同学将新制氯水逐滴加入下列溶液中,现象描述错误的是
| 选项 | 溶液 | 现象 |
| A | 紫色石蕊试液 | 溶液先变红后褪色 |
| B |  溶液 溶液 | 产生气泡 |
| C | 溴水 | 溶液褪色 |
| D |  溶液 溶液 | 有白色沉淀生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-07-10更新
|
204次组卷
|
2卷引用:上海市洋泾中学 2023-2024学年第一学期高一化学期末考试试卷
9 . 某实验小组同学为了探究铜与浓硫酸的反应,进行了一系列实验。在反应过程中会发生一些副反应,生成不溶于水和酸的CuS、Cu2S。
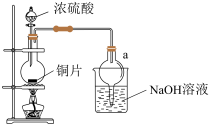
(1)处于安全和绿色化学考虑,在制取硫酸铜时,可选用下列的物质是____ 。
a.Cu b.CuO c.CuS d.CuSO4·Cu(OH)2∙H2O
(2)装置a的作用是___ 。反应过程中,因为浓硫酸的吸水作用,烧瓶中出现白色固体物质,如何简便检验反应后圆底烧瓶里有Cu2+存在?___ 。在实际反应中,由于条件控制不好,容易产生CuS和Cu2S固体:2CuS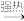 Cu2S+S。
Cu2S+S。
(3)已知样品质量为ag,得到Cu2S是bg,则样品中CuS质量分数是___ 。如果Cu2S高温下转化为Cu,则实验测得的值会___ (填“偏大”、“偏小”或“不变”)
(4)根据以上信息,说明铜与浓硫酸反应需要控制哪些条件?___

(1)处于安全和绿色化学考虑,在制取硫酸铜时,可选用下列的物质是
a.Cu b.CuO c.CuS d.CuSO4·Cu(OH)2∙H2O
(2)装置a的作用是
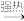 Cu2S+S。
Cu2S+S。(3)已知样品质量为ag,得到Cu2S是bg,则样品中CuS质量分数是
(4)根据以上信息,说明铜与浓硫酸反应需要控制哪些条件?
您最近一年使用:0次
2019-10-28更新
|
858次组卷
|
3卷引用:2019年上海市普通高中学业水平等级性考试(高考)化学试卷
22-23高二下·上海浦东新·阶段练习
名校
解题方法
10 . 下列实验操作及现象能得到相应结论的是
| 选项 | 实验操作及现象 | 结论 |
| A | 将电石与水反应产生的气体通入溴水,溴水褪色 | 生成的气体中含有H2S |
| B | 取1.5g苯酚溶于适量乙醇中,在加入绿豆大小的吸干煤油的金属钠,有连续气泡产生 | 钠与苯酚反应生成氢气 |
| C | 将在空气中灼烧过的螺旋状铜丝趁热插入乙醇,有刺激性气味气体产生,铜丝冷却后呈红色 | 乙醇发生了氧化反应 |
| D | 向淀粉溶液中加入稀硫酸并加热,再加入碘水,溶液变蓝 | 淀粉未发生水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



