名校
1 . 探究 与
与 对
对 分解的催化效率。
分解的催化效率。
(1)甲同学进行了如下的实验。
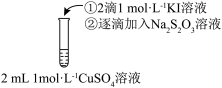
在两支试管中分别加入 溶液,然后各滴加5滴
溶液,然后各滴加5滴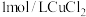 溶液和5滴
溶液和5滴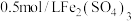 溶液。观察到两支试管中均只有极微量的气泡。
溶液。观察到两支试管中均只有极微量的气泡。
甲由此得出了结论: 与
与 对
对 分解的催化效率相似,且均不高。
分解的催化效率相似,且均不高。
乙同学认为甲的方案不太合理,做了如下的改进:
①乙认为甲方案不合理的理由有___________ (填选项符号)。
a. 溶液和
溶液和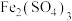 溶液的浓度不同
溶液的浓度不同
b.两种催化剂溶液中的阴离子不同
c. 溶液浓度过低
溶液浓度过低
②两支试管中产生气泡的速率先加快后又减慢的合理解释是:___________ 。
③根据实验结果,乙得出是结论是:___________ 。
(2)研究试管2中出现“溶液变为棕褐色,最后变为浅黄色”的原因。
乙同学查阅文献,发现是因为 会与
会与 发生如下反应生成棕褐色的
发生如下反应生成棕褐色的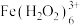 :
: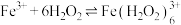 。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:
。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:___________ 。
(3)乙同学在翻阅资料时还发现 与
与 能发生反应生成无色的
能发生反应生成无色的

他又做了如下的实验:
在一支试管中加入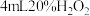 溶液,滴加几滴
溶液,滴加几滴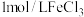 溶液,待出现大量气泡时,立即加入
溶液,待出现大量气泡时,立即加入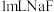 溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
由此判断,下列说法正确的是___________ (填选项符号)。
a. 对
对 的分解几乎无催化作用
的分解几乎无催化作用
b.温度相同时,含相同浓度的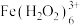 和
和 的溶液中
的溶液中 浓度后者的大
浓度后者的大
c.颜色由棕褐色褪为无色时反应的离子方程式是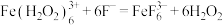
 与
与 对
对 分解的催化效率。
分解的催化效率。(1)甲同学进行了如下的实验。
在两支试管中分别加入
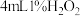 溶液,然后各滴加5滴
溶液,然后各滴加5滴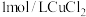 溶液和5滴
溶液和5滴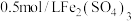 溶液。观察到两支试管中均只有极微量的气泡。
溶液。观察到两支试管中均只有极微量的气泡。甲由此得出了结论:
 与
与 对
对 分解的催化效率相似,且均不高。
分解的催化效率相似,且均不高。乙同学认为甲的方案不太合理,做了如下的改进:
| 试管1 | 试管2 | |
| 实验 | 在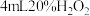 溶液中滴加5滴 溶液中滴加5滴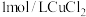 溶液 溶液 | 在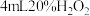 溶液中滴加5滴 溶液中滴加5滴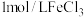 溶液 溶液 |
| 现象 | ⅰ.加入溶液后,产生气泡 ⅱ.生成气泡速率先加快后又减慢 ⅲ.整个过程中溶液始终保持浅蓝色。 ⅳ.且整个过程中产生气泡的速率低于试管2中。 | ⅰ.加入溶液后,试管内液体立即变为棕褐色,并产生气泡 ⅱ.生成气泡速率先加快后又减慢。 ⅲ.溶液棕褐色逐渐变浅,反应结束时变为浅黄色。 |
a.
 溶液和
溶液和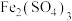 溶液的浓度不同
溶液的浓度不同b.两种催化剂溶液中的阴离子不同
c.
 溶液浓度过低
溶液浓度过低②两支试管中产生气泡的速率先加快后又减慢的合理解释是:
③根据实验结果,乙得出是结论是:
(2)研究试管2中出现“溶液变为棕褐色,最后变为浅黄色”的原因。
乙同学查阅文献,发现是因为
 会与
会与 发生如下反应生成棕褐色的
发生如下反应生成棕褐色的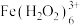 :
: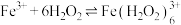 。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:
。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:(3)乙同学在翻阅资料时还发现
 与
与 能发生反应生成无色的
能发生反应生成无色的

他又做了如下的实验:
在一支试管中加入
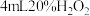 溶液,滴加几滴
溶液,滴加几滴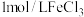 溶液,待出现大量气泡时,立即加入
溶液,待出现大量气泡时,立即加入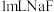 溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。由此判断,下列说法正确的是
a.
 对
对 的分解几乎无催化作用
的分解几乎无催化作用b.温度相同时,含相同浓度的
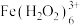 和
和 的溶液中
的溶液中 浓度后者的大
浓度后者的大c.颜色由棕褐色褪为无色时反应的离子方程式是
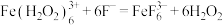
您最近一年使用:0次
名校
2 . 某小组为探究 与
与 之间的反应,进行了如下实验。
之间的反应,进行了如下实验。
已知: ;
; 为白色沉淀,可吸附
为白色沉淀,可吸附 ;
;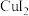 在溶液中不存在;
在溶液中不存在; 呈无色,
呈无色,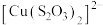 呈黄色。
呈黄色。
下列结论或推断不合理 的是
 与
与 之间的反应,进行了如下实验。
之间的反应,进行了如下实验。| 实验 |
|
|
| 现象 | ①产生土黄色沉淀,溶液为棕黄色 ②变为白色悬浊液,最后得到无色澄清溶液 | ①产生土黄色沉淀,溶液为蓝绿色 ②开始变为浅蓝色悬浊液,逐渐变为黄绿色悬浊液,然后变为黄色溶液,最后得到无色溶液 |
 ;
; 为白色沉淀,可吸附
为白色沉淀,可吸附 ;
;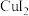 在溶液中不存在;
在溶液中不存在; 呈无色,
呈无色,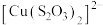 呈黄色。
呈黄色。下列结论或推断
A. 与 与 能发生反应: 能发生反应: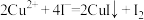 |
B. 与 与 反应的速率快于 反应的速率快于 与 与 反应的速率 反应的速率 |
C.黄绿色悬浊液变为黄色溶液时,有 、 、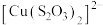 生成 生成 |
D. 与 与 生成配合物反应的限度小于二者发生氧化还原反应的限度 生成配合物反应的限度小于二者发生氧化还原反应的限度 |
您最近一年使用:0次
2024-06-04更新
|
328次组卷
|
2卷引用:北京市海淀区2023-2024学年高三下学期期末练习(二模)化学试题
名校
解题方法
3 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①饱和氨水的浓度约为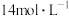
② 为浅青色沉淀
为浅青色沉淀
③ 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)有研究认为蓝色沉淀中还有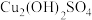 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。___________ ,c=___________ 。
②实验现象是___________ 。
(5)从平衡移动角度,结合化学用语,解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(6)针对实验ii未能成功配制 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:___________ 。
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、___________ 。
| 实验序号 | 操作 | 现象 | |
实验i: 的配制 的配制 | 实验i-a | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的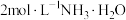 | 产生蓝色沉淀,加入 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的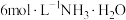 | 产生蓝色沉淀,加入 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的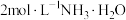 | 产生蓝色沉淀,加入 后沉淀完全溶解,得到澄清的深蓝色溶液。 后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
实验ii: 的配制 的配制 | 实验ii-a | 在试管内混合 溶液和过量 溶液和过量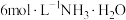 | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合 溶液和过量 溶液和过量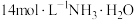 | 得到浅青色沉淀,沉淀未见明显溶解。 | |
实验iii: 的配制 的配制 | 实验iii | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的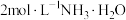 | 产生白色沉淀,加入 后沉淀完全溶解,得到无色溶液。 后沉淀完全溶解,得到无色溶液。 |
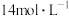
②
 为浅青色沉淀
为浅青色沉淀③
 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)有研究认为蓝色沉淀中还有
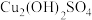 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测
 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。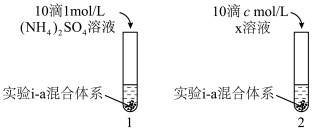
②实验现象是
(5)从平衡移动角度,结合化学用语,解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(6)针对实验ii未能成功配制
 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、
您最近一年使用:0次
2024-05-31更新
|
278次组卷
|
3卷引用:北京市昌平区2023-2024学年高三下学期二模化学试题
解题方法
4 . 某化学小组探究硫酸铁铵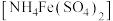 与
与 、
、 的反应。
的反应。
已知: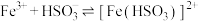 (棕红)
(棕红)
(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为___________ 。
②由实验Ⅰ可得出与 结合的能力:
结合的能力:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(2)资料显示, 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
①实验Ⅲ中 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因___________ 。
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。
①a、b分别是___________ 。
②结合电极反应解释步骤3中电压表示数减小的原因___________ 。
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因___________ 。
(4)综合以上实验,盐溶液间反应的多样性与___________ 有关。
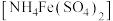 与
与 、
、 的反应。
的反应。| 实验 | 操作 | 现象 |
| Ⅰ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入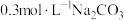 溶液 溶液 | 迅速产生大量红褐色沉淀和大量气泡;继续滴加,当气泡量明显减少时,试管口的湿润红色石蕊试纸开始逐渐变蓝 |
| Ⅱ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入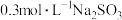 溶液 溶液 | 溶液立即变棕红(无丁达尔现象),继续滴加 溶液至过量,溶液依然为棕红色,放置两天无明显变化 溶液至过量,溶液依然为棕红色,放置两天无明显变化 |
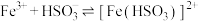 (棕红)
(棕红)(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为
②由实验Ⅰ可得出与
 结合的能力:
结合的能力:
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(2)资料显示,
 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。| 实验 | 操作 | 现象 |
| Ⅲ | 向2mL 溶液(pH=1.78)中加入0.5mL 溶液(pH=1.78)中加入0.5mL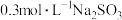 溶液 溶液 | 溶液立即变棕红色,约2小时后,棕红色变为黄色,检测到 |
| Ⅳ | 向2mL 溶液(pH=2.03)中加入0.5mL 溶液(pH=2.03)中加入0.5mL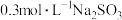 溶液 溶液 | 溶液立即变棕红色,约5小时后,棕红色变为黄色,检测到 |
 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了
 的氧化性或
的氧化性或 的还原性,并实施实验。
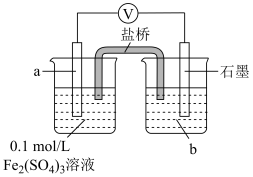
的还原性,并实施实验。| 实验 | 实验装置 | 实验步骤及现象 |
| Ⅴ |
| 1.按如图搭好装置,接通电路,电压表读数为0.6V; 2.向a电极附近滴加3滴10%稀硫酸,电压表读数不变; 3.向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。 |
②结合电极反应解释步骤3中电压表示数减小的原因
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到
 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因(4)综合以上实验,盐溶液间反应的多样性与
您最近一年使用:0次
5 . 某实验小组探究SO2与K2FeO4的反应,实验如下。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;
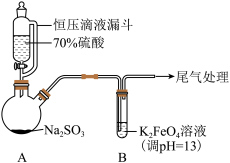
(1)A中产生SO2的化学方程式为___________ 。
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO 、SO
、SO ,检验如下:
,检验如下:
实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在___________ 。另取少量溶液滴加BaCl2溶液,产生白色沉淀,但不能确认含有SO ,原因是
,原因是___________ 。
实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO 。
。
实验三中用H2C2O4溶液溶解沉淀的目的是:___________ 。
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:___________ 。
(3)查阅资料:a.Fe3+、SO 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO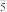
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是___________ 。
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:___________ 。
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O
 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;| 装置 | 操作及现象 |
| 实验一:向B中通入SO2,产生暗红褐色沉淀X和溶液Y(略显红色);继续通入SO2一段时间后,溶液呈红色,继而变为橙色,最终沉淀消失,溶液几乎无色。 |
(1)A中产生SO2的化学方程式为
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO
 、SO
、SO ,检验如下:
,检验如下:实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在
 ,原因是
,原因是实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO
 。
。实验三中用H2C2O4溶液溶解沉淀的目的是:
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:
(3)查阅资料:a.Fe3+、SO
 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。
 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO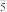
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
您最近一年使用:0次
2024-04-15更新
|
629次组卷
|
3卷引用:北京市朝阳区2023-2024学年高三下学期一模化学试题
北京市朝阳区2023-2024学年高三下学期一模化学试题(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)辽宁省大连市大连第二十四中学2023-2024学年高一下学期期中考试化学试卷
6 . 探究铜与浓硫酸的反应。
加热铜与浓硫酸,在反应过程中,有刺激性气味的气体产生,溶液逐渐变为墨绿色浊液,试管底部有灰白色沉淀;继续加热,试管中出现“白雾”,浊液逐渐变澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多。
资料:ⅰ.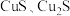 均为黑色固体。
均为黑色固体。
ⅱ.
Ⅰ.沉淀成分探究。
(1)经检验灰白色沉淀中含有无水硫酸铜,结合化学方程式解释原因_______ 。
继续探究沉淀成分:取沉淀,用蒸馏水多次洗涤,干燥,得到沉淀样品,取少量样品于试管中,分别进行如下3个实验。
(2)根据实验①,推测沉淀中含有还原性物质,经检验有 ,反应初期生成
,反应初期生成 可能原因是
可能原因是_______ 。
(3)②中浅蓝色溶液变深的反应原理是(用离子方程式表示)_______ 。
(4)由以上实验推断沉淀成分主要有_______ 。
Ⅱ.溶液颜色探究。
猜测1:查阅资料:若铜丝不纯(含有铁),导致体系中含有 和
和 ,与水合铜离子调和成墨绿色。
,与水合铜离子调和成墨绿色。
猜测2:铜丝表面常常涂一层聚氯乙烯薄膜,聚氯乙烯在加热条件下易分解产生 ,导致反应体系中形成
,导致反应体系中形成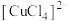 (黄色),与水合铜离子混合溶液呈绿色。
(黄色),与水合铜离子混合溶液呈绿色。
(5)④中加入的试剂是_______ ;⑤中实验现象_______ 。
(6)总结:铜与浓硫酸反应的多样性与_______ 有关。
加热铜与浓硫酸,在反应过程中,有刺激性气味的气体产生,溶液逐渐变为墨绿色浊液,试管底部有灰白色沉淀;继续加热,试管中出现“白雾”,浊液逐渐变澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多。
资料:ⅰ.
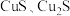 均为黑色固体。
均为黑色固体。
ⅱ.

Ⅰ.沉淀成分探究。
(1)经检验灰白色沉淀中含有无水硫酸铜,结合化学方程式解释原因
继续探究沉淀成分:取沉淀,用蒸馏水多次洗涤,干燥,得到沉淀样品,取少量样品于试管中,分别进行如下3个实验。
| 编号 | 试剂 | 实验操作 | 实验现象 | |
 | ① | 浓硝酸 | 滴加适量浓硝酸 | 沉淀逐渐溶解,产生大量红棕色气体 |
| ② | 氨水 | 滴加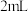 氨水,振荡,在空气中放置一段时间 氨水,振荡,在空气中放置一段时间 | 滴加氨水后,溶液呈极浅蓝色;静置后逐渐变深,呈深蓝色 | |
| ③ | 酒精 | 滴加 酒精,充分振荡,静置、过滤,将滤液移入盛有水的试管中,稍加振荡 酒精,充分振荡,静置、过滤,将滤液移入盛有水的试管中,稍加振荡 | 酒精与水的界面呈现乳白色 |
(2)根据实验①,推测沉淀中含有还原性物质,经检验有
 ,反应初期生成
,反应初期生成 可能原因是
可能原因是(3)②中浅蓝色溶液变深的反应原理是(用离子方程式表示)
(4)由以上实验推断沉淀成分主要有
Ⅱ.溶液颜色探究。
猜测1:查阅资料:若铜丝不纯(含有铁),导致体系中含有
 和
和 ,与水合铜离子调和成墨绿色。
,与水合铜离子调和成墨绿色。猜测2:铜丝表面常常涂一层聚氯乙烯薄膜,聚氯乙烯在加热条件下易分解产生
 ,导致反应体系中形成
,导致反应体系中形成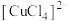 (黄色),与水合铜离子混合溶液呈绿色。
(黄色),与水合铜离子混合溶液呈绿色。| 编号 | 实验操作 | 实验现象 | 实验结论 |
| ④ | 取铜丝与浓硫酸反应后的混合液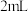 于试管中,滴入2滴 于试管中,滴入2滴 ,再加入____ ,再加入____ | 溶液未变红 | 混合液中不含 |
| ⑤ | 取一段铜丝放入大试管中,加入 浓硫酸,加热 浓硫酸,加热 | _______ | 铜丝表面含有氯元素 |
| ⑥ | 另取一段铜丝,在酒精灯上灼烧除去铜丝表面薄膜;放入大试管中,加入 浓硫酸,加热 浓硫酸,加热 | 溶液慢慢变蓝色、蓝黑色 |
(5)④中加入的试剂是
(6)总结:铜与浓硫酸反应的多样性与
您最近一年使用:0次
解题方法
7 . 化学小组同学探究铜与过量浓硝酸反应后溶液呈绿色的原因。
资料:ⅰ.铜与浓硝酸反应过程中可生成 ,
, 易分解产生无色气体。
易分解产生无色气体。
ⅱ. 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: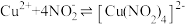 (绿色)
(绿色)
下列说法不正确 的是
资料:ⅰ.铜与浓硝酸反应过程中可生成
 ,
, 易分解产生无色气体。
易分解产生无色气体。ⅱ.
 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: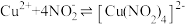 (绿色)
(绿色)| 编号 | 操作 | 现象 |
| ① | 分别向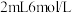  和 和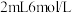  溶液中通入稳定的 溶液中通入稳定的 气流 气流 |  溶液变黄 溶液变黄 溶液不变黄 溶液不变黄 |
| ② | 将实验①的黄色溶液与蓝色 溶液混合 溶液混合 | 溶液呈绿色 |
| ③ | 将  溶液与 溶液与  溶液混合 溶液混合 | 溶液呈绿色 |
| ④ | 向实验③所得溶液中加入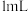 浓硝酸 浓硝酸 | 溶液变蓝 |
A.依据实验①,向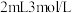  通入稳定的 通入稳定的 气流,溶液可能会变黄 气流,溶液可能会变黄 |
B.实验④加入浓硝酸后可能发生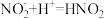 ,使 ,使 浓度下降,绿色消失 浓度下降,绿色消失 |
C.铜与过量浓硝酸反应溶液呈绿色可能原因是:浓硝酸中溶解了生成的 呈黄色,黄色与蓝色叠加呈绿色 呈黄色,黄色与蓝色叠加呈绿色 |
D.铜与过量浓硝酸反应溶液呈绿色可能原因是:铜与浓硝酸反应过程中,生成 使溶液呈绿色 使溶液呈绿色 |
您最近一年使用:0次
解题方法
8 . 某化学兴趣小组探究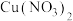 溶液与
溶液与 溶液的反应。向
溶液的反应。向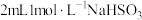 溶液
溶液 中逐滴加入
中逐滴加入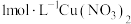 溶液,溶液变为绿色,静置
溶液,溶液变为绿色,静置 后,溶液变蓝,底部产生大量砖红色沉淀。
后,溶液变蓝,底部产生大量砖红色沉淀。
(1)测得 溶液
溶液 ,结合化学原理解释原因
,结合化学原理解释原因________________ 。
(2)甲同学认为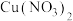 溶液与
溶液与 溶液发生了氧化还原反应。通过检验反应体系中是否含有
溶液发生了氧化还原反应。通过检验反应体系中是否含有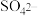 即可证明,检验
即可证明,检验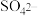 的方法是
的方法是________________ 。
(3)乙同学认为上述方法不能排除空气中 的干扰,应该进一步分析沉淀的成分。对反应产物中的砖红色沉淀提出以下假设:
的干扰,应该进一步分析沉淀的成分。对反应产物中的砖红色沉淀提出以下假设:
假设1:砖红色沉淀为 ;
;
假设2:砖红色沉淀为 ;
;
假设3:________________ ..
(4)查阅资料1: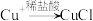 (白色难溶固体)
(白色难溶固体)
将砖红色沉淀过滤洗涤后,滴加 盐酸至过量,
盐酸至过量,________________ (填实验现象),可证明假设1成立,同时溶液变为蓝绿色,并伴有刺激性气味的气体生成。
(5)丙同学做对照实验时,向 中滴加
中滴加 盐酸至过量后,没有观察到溶液变蓝和生成气体的现象。因此,他认为砖红色沉淀中还可能含有其它成分,并设计实验进行证实。
盐酸至过量后,没有观察到溶液变蓝和生成气体的现象。因此,他认为砖红色沉淀中还可能含有其它成分,并设计实验进行证实。
①刺激性气味的气体可能是 或
或 ,在试管口用
,在试管口用蘸有碘水的淀粉试纸 检验,发现蓝色褪去,写出反应的离子方程式________________ 。
②向红色沉淀中加入过量氨水,发现沉淀溶解,溶液立即变蓝。 被空气氧化缓慢变蓝的原理
被空气氧化缓慢变蓝的原理________________ 。
③上述实验现象表明,砖红沉淀中除了含有 外,还含有
外,还含有________ 。(写出离子成分即可)
(6)丁同学通过如图装置证明了此条件下, 也能氧化
也能氧化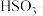 ,图中甲溶液是
,图中甲溶液是________ ,通过对比实验证明了此时空气中的 不是
不是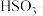 被氧化的主要原因,操作及现象是
被氧化的主要原因,操作及现象是________________ 。
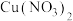 溶液与
溶液与 溶液的反应。向
溶液的反应。向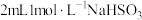 溶液
溶液 中逐滴加入
中逐滴加入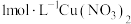 溶液,溶液变为绿色,静置
溶液,溶液变为绿色,静置 后,溶液变蓝,底部产生大量砖红色沉淀。
后,溶液变蓝,底部产生大量砖红色沉淀。(1)测得
 溶液
溶液 ,结合化学原理解释原因
,结合化学原理解释原因(2)甲同学认为
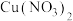 溶液与
溶液与 溶液发生了氧化还原反应。通过检验反应体系中是否含有
溶液发生了氧化还原反应。通过检验反应体系中是否含有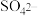 即可证明,检验
即可证明,检验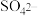 的方法是
的方法是(3)乙同学认为上述方法不能排除空气中
 的干扰,应该进一步分析沉淀的成分。对反应产物中的砖红色沉淀提出以下假设:
的干扰,应该进一步分析沉淀的成分。对反应产物中的砖红色沉淀提出以下假设:假设1:砖红色沉淀为
 ;
;假设2:砖红色沉淀为
 ;
;假设3:
(4)查阅资料1:
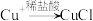 (白色难溶固体)
(白色难溶固体)将砖红色沉淀过滤洗涤后,滴加
 盐酸至过量,
盐酸至过量,(5)丙同学做对照实验时,向
 中滴加
中滴加 盐酸至过量后,没有观察到溶液变蓝和生成气体的现象。因此,他认为砖红色沉淀中还可能含有其它成分,并设计实验进行证实。
盐酸至过量后,没有观察到溶液变蓝和生成气体的现象。因此,他认为砖红色沉淀中还可能含有其它成分,并设计实验进行证实。①刺激性气味的气体可能是
 或
或 ,在试管口用
,在试管口用②向红色沉淀中加入过量氨水,发现沉淀溶解,溶液立即变蓝。
查阅资料2:
 被空气氧化缓慢变蓝的原理
被空气氧化缓慢变蓝的原理③上述实验现象表明,砖红沉淀中除了含有
 外,还含有
外,还含有(6)丁同学通过如图装置证明了此条件下,
 也能氧化
也能氧化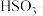 ,图中甲溶液是
,图中甲溶液是 不是
不是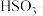 被氧化的主要原因,操作及现象是
被氧化的主要原因,操作及现象是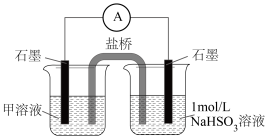
您最近一年使用:0次
9 . 以 溶液和不同金属的盐溶液作为实验对象,探究
溶液和不同金属的盐溶液作为实验对象,探究 的性质和盐溶液间反应的多样性。
的性质和盐溶液间反应的多样性。
【查阅资料】
① 能与多种不同金属离子形成沉淀或配合物:
能与多种不同金属离子形成沉淀或配合物:
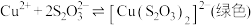 ,
,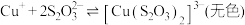
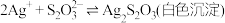 ,
,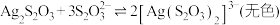
② 易被氧化为
易被氧化为 或者
或者
【进行实验】
Ⅰ.探究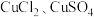 和
和 溶液之间的反应
溶液之间的反应
(1)经检验,实验a绿色变浅后的溶液中含 ,这说明
,这说明 具有
具有_______ (填“氧化”或“还原”)性。
(2)从反应速率和化学平衡两个角度解释实验a的实验现象_______ 。
II.探究 和
和 溶液之间的反应。
溶液之间的反应。
(3)实验c中产生的白色沉淀为 ,用化学用语解释“超过
,用化学用语解释“超过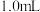 后,产生少量白色沉淀”的原因:
后,产生少量白色沉淀”的原因:_______ 。
(4)为了探究实验c中产生黑色沉淀的原因,甲同学进行了进一步的实验:
ⅰ.取少量滤液B,用广泛pH试纸测定 ;
;
ⅱ.另取少量滤液B于试管中,_______ (填操作和现象),说明滤液中有 。
。
由上述实验现象,进而推测出黑色沉淀A可能为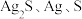 或它们的混合物。运用氧化还原反应规律,做出该推测的理由是
或它们的混合物。运用氧化还原反应规律,做出该推测的理由是_______ 。
【获得结论】
(5)根据上述实验, 和金属盐溶液之间反应的多样性与多种因素有关:①
和金属盐溶液之间反应的多样性与多种因素有关:①_______ :②金属盐中的阴离子是否能够参与反应;③反应时间的长短;④_______ 。
 溶液和不同金属的盐溶液作为实验对象,探究
溶液和不同金属的盐溶液作为实验对象,探究 的性质和盐溶液间反应的多样性。
的性质和盐溶液间反应的多样性。| 实验 试管 | 试剂滴管:逐滴滴加,总体积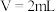 | 现象 |
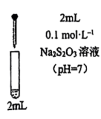 | 实验a: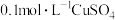 溶液 溶液实验b: 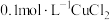 溶液 溶液 | 溶液先变为绿色,静止后缓慢变浅,最终变为浅绿色 溶液先变为绿色,缓慢产生白色浑浊,充分反应后绿色比实验a更浅 |
实验c: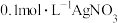 溶液 溶液 | 生成白色沉淀,振荡后迅速溶解,得到无色清液;超过1.0mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色,静置充分反应后,过滤得到黑色沉淀A和滤液B |
①
 能与多种不同金属离子形成沉淀或配合物:
能与多种不同金属离子形成沉淀或配合物: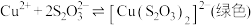 ,
,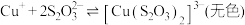
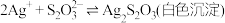 ,
,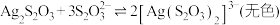
②
 易被氧化为
易被氧化为 或者
或者
【进行实验】
Ⅰ.探究
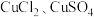 和
和 溶液之间的反应
溶液之间的反应(1)经检验,实验a绿色变浅后的溶液中含
 ,这说明
,这说明 具有
具有(2)从反应速率和化学平衡两个角度解释实验a的实验现象
II.探究
 和
和 溶液之间的反应。
溶液之间的反应。(3)实验c中产生的白色沉淀为
 ,用化学用语解释“超过
,用化学用语解释“超过 后,产生少量白色沉淀”的原因:
后,产生少量白色沉淀”的原因:(4)为了探究实验c中产生黑色沉淀的原因,甲同学进行了进一步的实验:
ⅰ.取少量滤液B,用广泛pH试纸测定
 ;
;ⅱ.另取少量滤液B于试管中,
 。
。由上述实验现象,进而推测出黑色沉淀A可能为
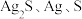 或它们的混合物。运用氧化还原反应规律,做出该推测的理由是
或它们的混合物。运用氧化还原反应规律,做出该推测的理由是【获得结论】
(5)根据上述实验,
 和金属盐溶液之间反应的多样性与多种因素有关:①
和金属盐溶液之间反应的多样性与多种因素有关:①
您最近一年使用:0次
名校
10 . 某研究小组探究酸碱性对 和
和 反应的影响。
反应的影响。
资料: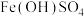 为黄色固体,难溶于水,可溶于酸。
为黄色固体,难溶于水,可溶于酸。
Ⅰ.无外加酸碱时,实验如下。
实验ⅰ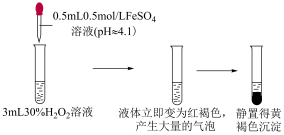
实验ⅱ
(1)根据_____ ,可证实实验ⅰ中红褐色液体为胶体。
(2)已知黄褐色沉淀中有 ,还可能存在
,还可能存在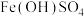 ,设计实验证实
,设计实验证实_____ 。(填操作和现象)
(3)结合化学用语,解释无外加酸碱时反应结束后 降低的原因
降低的原因_____ 。
Ⅱ.外加酸碱条件下,实验如下。
(4)根据实验ⅲ,推测立即产生大量气体的原因。
猜想一: 催化
催化 分解。
分解。
猜想二:_____ 。
设计实验_____ ,证实猜想一不是立即产生大量气体的主要原因。
(5) 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因
是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因_____ 。
主要反应机理:
注: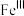 代表
代表 的化合价为+3
的化合价为+3
(6)已知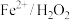 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于
体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 有强氧化性,根据以上实验探究,配制该体系最好控制在
有强氧化性,根据以上实验探究,配制该体系最好控制在_____ 条件下。
 和
和 反应的影响。
反应的影响。资料:
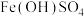 为黄色固体,难溶于水,可溶于酸。
为黄色固体,难溶于水,可溶于酸。Ⅰ.无外加酸碱时,实验如下。
实验ⅰ

实验ⅱ

(1)根据
(2)已知黄褐色沉淀中有
 ,还可能存在
,还可能存在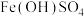 ,设计实验证实
,设计实验证实(3)结合化学用语,解释无外加酸碱时反应结束后
 降低的原因
降低的原因Ⅱ.外加酸碱条件下,实验如下。
| 实验编号 | 实验操作 | 现象 |
| ⅲ | 取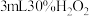 溶液于试管中,滴加 溶液于试管中,滴加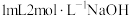 溶液,再滴加 溶液,再滴加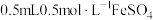 溶液 溶液 | 液体变为红褐色,立即产生大量气体,有液体喷出试管,最终产生大量红褐色沉淀 |
| ⅳ | 取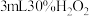 溶液于试管中,滴加 溶液于试管中,滴加 稀硫酸,再滴加 稀硫酸,再滴加 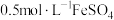 溶液 溶液 | 溶液呈黄色,有少量气泡产生,静置无沉淀产生 |
(4)根据实验ⅲ,推测立即产生大量气体的原因。
猜想一:
 催化
催化 分解。
分解。猜想二:
设计实验
(5)
 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因
是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因主要反应机理:
①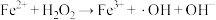 | ② ( ( 的水解) 的水解) |
③ | ④ |
⑤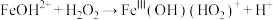 | ⑥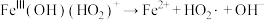 |
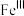 代表
代表 的化合价为+3
的化合价为+3(6)已知
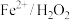 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于
体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 有强氧化性,根据以上实验探究,配制该体系最好控制在
有强氧化性,根据以上实验探究,配制该体系最好控制在
您最近一年使用:0次
2024-01-21更新
|
124次组卷
|
2卷引用:北京市丰台区2023-2024学年高二上学期期末考试化学试题