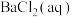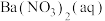真题
解题方法
1 . 学习小组为探究 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。
已知: 为粉红色、
为粉红色、 为蓝色、
为蓝色、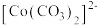 为红色、
为红色、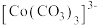 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:
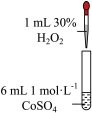
(1)配制 的
的 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的_______ (填标号)。
_______ (填“能”或“不能”)催化 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是_______ 。实验Ⅲ初步表明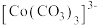 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式_______ 、_______ 。
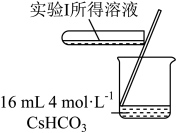
(3)实验I表明,反应 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因_______ 。_______ 、_______ 。
 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。| 实验I | 实验Ⅱ | 实验Ⅲ |
|
|
|
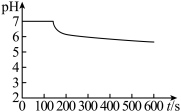
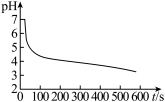
| 无明显变化 | 溶液变为红色,伴有气泡产生 | 溶液变为墨绿色,并持续产生能使带火星木条复燃的气体 |
 为粉红色、
为粉红色、 为蓝色、
为蓝色、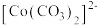 为红色、
为红色、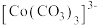 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:(1)配制
 的
的 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的a.  b.
b.  c.
c.  d.
d.

 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是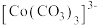 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式(3)实验I表明,反应
 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因实验Ⅳ:
您最近一年使用:0次
名校
2 . 向碘水、淀粉的混合液中加入 溶液,蓝色褪去。为探究褪色原因,设计如下图所示的实验。
溶液,蓝色褪去。为探究褪色原因,设计如下图所示的实验。
 溶液,蓝色褪去。为探究褪色原因,设计如下图所示的实验。
溶液,蓝色褪去。为探究褪色原因,设计如下图所示的实验。
A.①中 氧化了 氧化了 | B.①后溶液pH可能明显变小 |
C.③的目的是除去过量的 溶液 溶液 | D.④可发生 |
您最近一年使用:0次
3 . 某实验小组利用如图装置模拟古法制硫酸并进行 性质探究。
性质探究。
② 熔点
熔点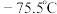 ,沸点
,沸点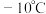 ;熔点
;熔点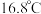 ,沸点
,沸点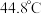 。
。
请回答下列问题:
Ⅰ.制取硫酸:实验开始前打开活塞 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热绿矾。
,用酒精喷灯高温加热绿矾。
(1)绿矾的化学式为_________________ 。
(2)使用石英玻璃管而不使用普通玻璃管的原因是_________________ 。
(3) 装置的作用是
装置的作用是_________________ 和分离出_________________ (填化学式)。
Ⅱ.探究 的性质:在装置
的性质:在装置 中先后加入同浓度同体积不同的钡盐溶液,控制食用油油层厚度一致、通入
中先后加入同浓度同体积不同的钡盐溶液,控制食用油油层厚度一致、通入 流速一致。四次实验分别得到如表
流速一致。四次实验分别得到如表 图:
图:
(4)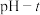 图中,用化学用语解释曲线①缓慢下降的原因
图中,用化学用语解释曲线①缓慢下降的原因_________________________________________ ;对比四组实验分析,④中发生反应_____________________________________________ (写反应的离子方程式)使溶液酸性增强, 化性增强,氧化
化性增强,氧化 的速率加快。
的速率加快。
(5)上述四次实验中有白色沉淀生成的是_________________ (填编号)。
 性质探究。
性质探究。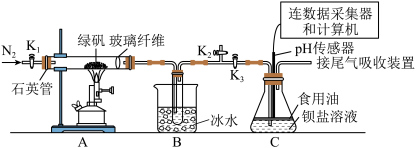
②
 熔点
熔点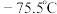 ,沸点
,沸点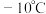 ;熔点
;熔点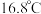 ,沸点
,沸点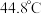 。
。请回答下列问题:
Ⅰ.制取硫酸:实验开始前打开活塞
 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热绿矾。
,用酒精喷灯高温加热绿矾。(1)绿矾的化学式为
(2)使用石英玻璃管而不使用普通玻璃管的原因是
(3)
 装置的作用是
装置的作用是Ⅱ.探究
 的性质:在装置
的性质:在装置 中先后加入同浓度同体积不同的钡盐溶液,控制食用油油层厚度一致、通入
中先后加入同浓度同体积不同的钡盐溶液,控制食用油油层厚度一致、通入 流速一致。四次实验分别得到如表
流速一致。四次实验分别得到如表 图:
图:①已煮沸的 | ②未煮沸的 |
|
|
③已煮沸的 | ④未煮沸的 |
|
|
(4)
 图中,用化学用语解释曲线①缓慢下降的原因
图中,用化学用语解释曲线①缓慢下降的原因 化性增强,氧化
化性增强,氧化 的速率加快。
的速率加快。(5)上述四次实验中有白色沉淀生成的是
您最近一年使用:0次
名校
解题方法
4 . 实验小组探究 溶液与
溶液与 溶液的反应及其速率,实验操作和现象如下。
溶液的反应及其速率,实验操作和现象如下。
已知:i. 能完全电离,且具有强氧化性,
能完全电离,且具有强氧化性, 易被还原为
易被还原为 ;
;
ⅱ.淀粉检测 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝:
即可快速变蓝:
ii. 可与
可与 发生反应:
发生反应: 。
。
(1)实验1-1的目的是_______ 。
(2) 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
为了研究 与
与 反应的速率,小组同学分别向两支试管中加入下列试剂,并记录变色时间,如下表。
反应的速率,小组同学分别向两支试管中加入下列试剂,并记录变色时间,如下表。
(3)加入 溶液后溶液变蓝的时间明显增长,甲同学对此提出猜想:
溶液后溶液变蓝的时间明显增长,甲同学对此提出猜想:
猜想1: 先与
先与 反应,使
反应,使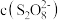 降低;
降低;
猜想2: 先与
先与 反应,_______。
反应,_______。
请回答:
①甲同学提出猜想1的依据:由信息i推测, 的还原性
的还原性_______ (填“强于”或“弱于”) 的。
的。
②乙同学根据实验2-2中数据认为,假定 与
与 反应,溶液中剩余
反应,溶液中剩余 的浓度
的浓度_______ (填“大于”或“小于”)实验2-1中 的起始浓度,由此证明猜想1不成立。
的起始浓度,由此证明猜想1不成立。
③补全 猜想2:_______ 。
(4)查阅文献表明猜想2成立。
①实验2-2中, 内未检测到
内未检测到 与
与 反应,从反应机理角度分析可能的原因是
反应,从反应机理角度分析可能的原因是_______ 。
②根据实验2-2的数据,计算30s内的平均反应速率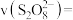
_______  (写出计算式)。
(写出计算式)。
 溶液与
溶液与 溶液的反应及其速率,实验操作和现象如下。
溶液的反应及其速率,实验操作和现象如下。已知:i.
 能完全电离,且具有强氧化性,
能完全电离,且具有强氧化性, 易被还原为
易被还原为 ;
;ⅱ.淀粉检测
 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝:
即可快速变蓝:ii.
 可与
可与 发生反应:
发生反应: 。
。| 编号 | 1-1 | 1-2 |
| 实验操作 |  |  |
| 现象 | 无明显现象 | 溶液立即变蓝 |
(1)实验1-1的目的是
(2)
 与
与 反应的离子方程式为
反应的离子方程式为为了研究
 与
与 反应的速率,小组同学分别向两支试管中加入下列试剂,并记录变色时间,如下表。
反应的速率,小组同学分别向两支试管中加入下列试剂,并记录变色时间,如下表。| 编号 | 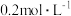  溶液 溶液 |   溶液 溶液 | 蒸馏水 | 淀粉溶液/滴 | 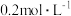  溶液 溶液 | 变色时间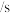 |
| 2-1 | 2 | 0 | 2.8 | 2 | 0.2 | 立即 |
| 2-2 | 2 | 0.8 | 0.2 | 2 | 2 | 30 |
(3)加入
 溶液后溶液变蓝的时间明显增长,甲同学对此提出猜想:
溶液后溶液变蓝的时间明显增长,甲同学对此提出猜想:猜想1:
 先与
先与 反应,使
反应,使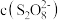 降低;
降低;猜想2:
 先与
先与 反应,_______。
反应,_______。请回答:
①甲同学提出猜想1的依据:由信息i推测,
 的还原性
的还原性 的。
的。②乙同学根据实验2-2中数据认为,假定
 与
与 反应,溶液中剩余
反应,溶液中剩余 的浓度
的浓度 的起始浓度,由此证明猜想1不成立。
的起始浓度,由此证明猜想1不成立。③
(4)查阅文献表明猜想2成立。
①实验2-2中,
 内未检测到
内未检测到 与
与 反应,从反应机理角度分析可能的原因是
反应,从反应机理角度分析可能的原因是②根据实验2-2的数据,计算30s内的平均反应速率
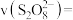
 (写出计算式)。
(写出计算式)。
您最近一年使用:0次
名校
5 . 某化学兴趣小组利用铜跟浓硫酸反应,探究 的部分性质,实验装置如图所示。
的部分性质,实验装置如图所示。___________ (填序号);
①水 ②饱和的 溶液 ③NaOH溶液 ④酸性
溶液 ③NaOH溶液 ④酸性
(2)装置C和D中产生的现象相同,但原因却不同。C中是由于 与溶液中的NaOH反应使碱性减弱,而D中则是由于
与溶液中的NaOH反应使碱性减弱,而D中则是由于 具有
具有___________ 性。
(3)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是___________ 。
(4)若实验中用一定质量的铜片和100.0mL 18.0mol/L的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为2mol/L,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾___________ mol。
(5) 为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究
为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究 气体还原
气体还原 、
、 ,可以使用的药品和装置如图所示:
,可以使用的药品和装置如图所示: ,为了验证A中
,为了验证A中 与
与 发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性 溶液,紫红色褪去。
溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是___________ (填①或②),不合理的原因是___________ 。
(6)在上述装置中能表明 的还原性强于
的还原性强于 的现象是
的现象是___________ 。
 的部分性质,实验装置如图所示。
的部分性质,实验装置如图所示。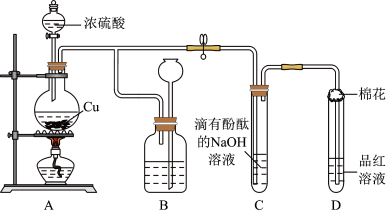
①水 ②饱和的
 溶液 ③NaOH溶液 ④酸性
溶液 ③NaOH溶液 ④酸性
(2)装置C和D中产生的现象相同,但原因却不同。C中是由于
 与溶液中的NaOH反应使碱性减弱,而D中则是由于
与溶液中的NaOH反应使碱性减弱,而D中则是由于 具有
具有(3)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是
(4)若实验中用一定质量的铜片和100.0mL 18.0mol/L的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为2mol/L,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
(5)
 为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究
为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究 气体还原
气体还原 、
、 ,可以使用的药品和装置如图所示:
,可以使用的药品和装置如图所示: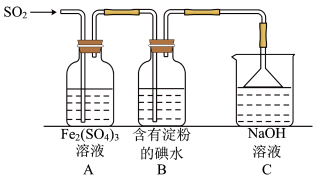
 ,为了验证A中
,为了验证A中 与
与 发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:方案①:往第一份试液中加入少量酸性
 溶液,紫红色褪去。
溶液,紫红色褪去。方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是
(6)在上述装置中能表明
 的还原性强于
的还原性强于 的现象是
的现象是
您最近一年使用:0次
2023-04-17更新
|
577次组卷
|
2卷引用:湖北省武汉市第十一中学2023-2024学年高一下学期3月月考化学试卷
6 . 某化学兴趣小组利用铜跟浓硫酸反应,探究SO2的部分性质,实验装置如图所示。

(1)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是_____ (填序号);
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(2)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有_____ 性。
(3)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是_____ 。
(4)若实验中用一定质量的铜片和25.0mL18.0mol•L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为dmol•L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾_____ mol(用含d的代数式表示)。
(5)SO2为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:

在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是_____ ,(填①或②)不合理的原因是_____ 。
(6)在上述装置中能表明SO2的还原性强于I2的现象是_____ 。

(1)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(2)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有
(3)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是
(4)若实验中用一定质量的铜片和25.0mL18.0mol•L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为dmol•L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
(5)SO2为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:

在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是
(6)在上述装置中能表明SO2的还原性强于I2的现象是
您最近一年使用:0次
7 . 向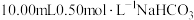 溶液中滴加不同浓度的
溶液中滴加不同浓度的 溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
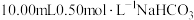 溶液中滴加不同浓度的
溶液中滴加不同浓度的 溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是| 实验 | 序号 | 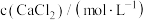 | 滴加 溶液时的实验现象 溶液时的实验现象 | 加热浑浊液时的实验现象 |
 溶液 溶液 | ① | 0.05 | 至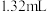 时产生明显浑浊,但无气泡产生 时产生明显浑浊,但无气泡产生 | 有较多气泡生成 |
| ② | 0.005 | 至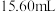 时产生明显浑浊,但无气泡产生 时产生明显浑浊,但无气泡产生 | 有少量气泡生成 | |
| ③ | 0.0005 | 至 未见浑浊 未见浑浊 | — |
A.①中产生浑浊的原因是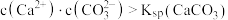 |
B.未加热前①和②中发生了反应: |
C.加热浊液产生气泡主要是因为 受热分解产生了更多的 受热分解产生了更多的 |
D.向上述 溶液中加入足量 溶液中加入足量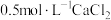 溶液,可能同时产生浑浊和气泡 溶液,可能同时产生浑浊和气泡 |
您最近一年使用:0次
2023-02-03更新
|
354次组卷
|
14卷引用:湖北省武汉市蔡甸区汉阳一中2020届高三全国高等学校仿真模拟(一)考试理综化学试题
湖北省武汉市蔡甸区汉阳一中2020届高三全国高等学校仿真模拟(一)考试理综化学试题北京市海淀区2020届高三上学期期末考试化学试题北京市八一学校2019-2020学年高二下学期期末考试化学试题江苏省常熟市2021-2022学年高三上学期阶段性抽测一化学试题江苏省盐城市阜宁中学2021-2022学年高三下学期第三次综合测试化学试题北京市第八中学2021-2022学年高二上学期期末考试化学试题北京十中2022-2023学年高三上学期期末统练3化学试题浙江省衢州五校联盟2022-2023学年高二上学期期末联考(普通班)化学试题(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(8-14)(已下线)第一部分 二轮专题突破 专题14 溶液中的三大平衡及应用(已下线)T13-实验方案的设计与评价浙江省衢温“5+1”联盟2022-2023学年高二上学期期末联考化学试题北京市第十五中学2023-2024学年高二上学期期中考试化学试题2024届吉林省长春市高三下学期质量监测(四)化学试题
名校
解题方法
8 .  与
与 的氧化性相近。
的氧化性相近。 在自来水消毒和果蔬保鲜等方面应用广泛。某化学兴趣小组通过如图所示装置(夹持装置已略去)对其制备、吸收、释放和应用进行了研究。
在自来水消毒和果蔬保鲜等方面应用广泛。某化学兴趣小组通过如图所示装置(夹持装置已略去)对其制备、吸收、释放和应用进行了研究。

已知:①仪器a中发生的反应为 (未配平);
(未配平);
②仪器b中盛装的粉末的作用是除去生成的 ;
;
③ 被稳定剂完全吸收生成
被稳定剂完全吸收生成 ;
;
④酸性条件下, 可发生反应生成
可发生反应生成 并释放出
并释放出 ;
;
⑤淀粉遇碘会变蓝。
回答下列问题:
(1)仪器a的名称为_______ 。
(2)打开 、关闭
、关闭 ,仪器a中发生反应的离子方程式为
,仪器a中发生反应的离子方程式为_______ 。
(3)一段时间后,关闭 、打开
、打开 ,此时仪器c中释放出的气体为
,此时仪器c中释放出的气体为_______ (填化学名称),仪器d中观察到的现象为_______ 。请写出仪器d中 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
(4)仪器e中可能发生的反应:
ⅰ.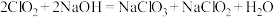 ;
;
ⅱ. 。
。
①反应ⅰ中,氧化产物为_______ (填化学式)。
②若反应ⅰ和ⅱ同时发生,当通入1mol 时,恰好被2L未知浓度的
时,恰好被2L未知浓度的 溶液完全吸收,当此时
溶液完全吸收,当此时 ,则反应后的溶液中
,则反应后的溶液中
_______ (填具体数字) (不考虑气体逸出和溶液体积的变化)。
(不考虑气体逸出和溶液体积的变化)。
 与
与 的氧化性相近。
的氧化性相近。 在自来水消毒和果蔬保鲜等方面应用广泛。某化学兴趣小组通过如图所示装置(夹持装置已略去)对其制备、吸收、释放和应用进行了研究。
在自来水消毒和果蔬保鲜等方面应用广泛。某化学兴趣小组通过如图所示装置(夹持装置已略去)对其制备、吸收、释放和应用进行了研究。
已知:①仪器a中发生的反应为
 (未配平);
(未配平);②仪器b中盛装的粉末的作用是除去生成的
 ;
;③
 被稳定剂完全吸收生成
被稳定剂完全吸收生成 ;
;④酸性条件下,
 可发生反应生成
可发生反应生成 并释放出
并释放出 ;
;⑤淀粉遇碘会变蓝。
回答下列问题:
(1)仪器a的名称为
(2)打开
 、关闭
、关闭 ,仪器a中发生反应的离子方程式为
,仪器a中发生反应的离子方程式为(3)一段时间后,关闭
 、打开
、打开 ,此时仪器c中释放出的气体为
,此时仪器c中释放出的气体为 与
与 发生反应的化学方程式:
发生反应的化学方程式:(4)仪器e中可能发生的反应:
ⅰ.
 ;
;ⅱ.
 。
。①反应ⅰ中,氧化产物为
②若反应ⅰ和ⅱ同时发生,当通入1mol
 时,恰好被2L未知浓度的
时,恰好被2L未知浓度的 溶液完全吸收,当此时
溶液完全吸收,当此时 ,则反应后的溶液中
,则反应后的溶液中
 (不考虑气体逸出和溶液体积的变化)。
(不考虑气体逸出和溶液体积的变化)。
您最近一年使用:0次
2023-01-14更新
|
228次组卷
|
2卷引用:湖北省襄阳市2022-2023学年高一上学期期末统考化学试题
9 . 如下图所示的“化学多米诺实验”装置中分别盛放的物质为①稀硫酸;②锌粒;装置③、④、⑤、⑥中的试剂及反应现象见下表,其中设计合理且实验现象符合预测的是
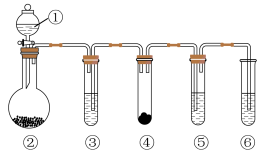

| ③中试剂 | ④中固体逐渐消失 | ⑤中溶液褪色 | ⑥中尾气处理 | |
| A | 浓盐酸 | KMnO4 | 石蕊试液 | NaOH溶液 |
| B | 浓HNO3 | Cu | FeSO4溶液 | 水 |
| C | 浓H2SO4 | 木炭 | 品红溶液 | 饱和NaHSO3溶液 |
| D | 浓NaOH溶液 | NH4Cl固体 | 少量CuSO4溶液 | CCl4和水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-12更新
|
1638次组卷
|
6卷引用:湖北省华中师范大学第一附属中学2023届高三第二次学业质量评价检测化学试题
名校
解题方法
10 . 硫酸亚铁在工农业生产中具有广泛的应用。该物质不稳定,受热易分解产生氧化物,具有较强的还原性。某学习小组利用如下装置来探究FeSO4受热分解的产物。
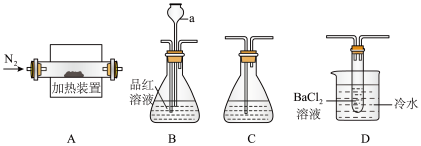
(1)甲组同学利用“A接B接C”的装置来验证产物中含有SO2气体。
①连接好装置后,接下来的操作是_______ 。
②仪器a的名称是_______ ;其作用是_______ 。
(2)乙组同学查阅资料得:硫酸亚铁分解的气体产物中除SO2外还有SO3;SO3的熔点为16.8℃,沸点是46.8℃,溶于水放出大量的热,易形成酸雾。为此设计了“A接D接C”的装置验证产物中含有SO3。
①装置D中的现象是_______ ,BaCl2溶液不能用Ba(NO3)2溶液代替的原因是_______ 。
②装置A中固体变为红棕色,结合两组同学的实验,写出硫酸亚铁分解的化学方程式_______ ;

(1)甲组同学利用“A接B接C”的装置来验证产物中含有SO2气体。
①连接好装置后,接下来的操作是
②仪器a的名称是
(2)乙组同学查阅资料得:硫酸亚铁分解的气体产物中除SO2外还有SO3;SO3的熔点为16.8℃,沸点是46.8℃,溶于水放出大量的热,易形成酸雾。为此设计了“A接D接C”的装置验证产物中含有SO3。
①装置D中的现象是
②装置A中固体变为红棕色,结合两组同学的实验,写出硫酸亚铁分解的化学方程式
您最近一年使用:0次