1 . 应用分类的方法可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。某小同学通过实验探究Na2CO3和NaHCO3的性质,请你与他们一起完成实验探究过程,并回答问题。
[观察]
(1)Na2CO3和 NaHCO3均为_______ 色的固体,
(2)从物质的类别来看, Na2CO3和NaHCO3均属于化合物中的_______ 类,能溶于水,可与部分_______ 、_______ 、盐等类别的物质发生反应。
[实验过程]
(3)实验II试管B中的现象为_______ 。
[分析与解释]
(4)实验I所得实验数据证明,溶解时吸收热量的物质是_______ 。
(5)实验II中的现象证明,Na2CO3的热稳定性_______ (填“强”或“弱”)于NaHCO3
(6)实验III中的现象证明,Na2CO3盐酸反应是分步进行的,发生反应的离子方程式为:
第一步:CO + H+=HCO
+ H+=HCO ;第二步:
;第二步:_______ 。
[观察]
(1)Na2CO3和 NaHCO3均为
(2)从物质的类别来看, Na2CO3和NaHCO3均属于化合物中的
[实验过程]
| 编号 | 实验内容 | 实验数据或者现象 |
| 实验I | 利用传感器探究两种物质分别溶水时的温度变化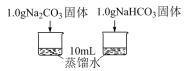 |  |
| 实验II | 探究两种物质得到热稳定性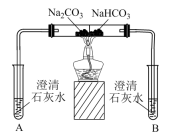 | 一段时间后,A中无明显现象,B中… |
| 实验III | 探究两种物质分别与盐酸反应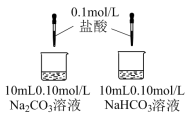 | A中开始无大量气泡,一段时间后产生大量气泡;B中立即产生大量气泡。 |
[分析与解释]
(4)实验I所得实验数据证明,溶解时吸收热量的物质是
(5)实验II中的现象证明,Na2CO3的热稳定性
(6)实验III中的现象证明,Na2CO3盐酸反应是分步进行的,发生反应的离子方程式为:
第一步:CO
 + H+=HCO
+ H+=HCO ;第二步:
;第二步:
您最近一年使用:0次
2021-07-11更新
|
661次组卷
|
5卷引用:云南省2020-2021学年高一下学期普通高中学业水平考试化学试题
名校
解题方法
2 . 为了探究淀粉的水解程度,某同学设计了如下实验。

请回答:
(1)步骤①,稀硫酸的作用是_______ 。
(2)步骤②,加入氢氧化钠溶液的原因是_______ 。
(3)步骤③,试剂M为_______ 。
(4)根据实验结果,判断溶液中淀粉_______ (填“ 没有”、“部分”或“完全”)水解成葡萄糖。

请回答:
(1)步骤①,稀硫酸的作用是
(2)步骤②,加入氢氧化钠溶液的原因是
(3)步骤③,试剂M为
(4)根据实验结果,判断溶液中淀粉
您最近一年使用:0次
2021-01-14更新
|
634次组卷
|
2卷引用:2021年1月浙江普通高中学考化学试题
名校
3 . 实验小组探究某补铁口服液中铁元素的价态。
【查阅资料】
KSCN中的硫元素为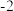 价,易被氧化为
价,易被氧化为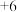 价。
价。
【实验过程】
【分析与解释】
(1)由实验Ⅰ可得出的结论是___________ 。
(2)根据实验Ⅱ中的现象,可以断定该补铁口服液中铁元素的价态为 价,滴加
价,滴加 溶液后
溶液后 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)一段时间后,发现实验Ⅱ中溶液红色褪去,可能的原因是___________ ;小组同学为证实自己的猜想,设计如下对照实验:向1mL 0.1 KSCN溶液中加入足量5%
KSCN溶液中加入足量5%  溶液,再加入
溶液,再加入 溶液,观察到
溶液,观察到___________ ,证实了小组同学的猜想是正确的。
【查阅资料】
KSCN中的硫元素为
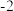 价,易被氧化为
价,易被氧化为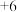 价。
价。【实验过程】
| 编号 | 实验操作 | 实验现象 |
| 实验Ⅰ |  | 无明显变化 |
| 实验Ⅱ |  | 溶液变红 |
(1)由实验Ⅰ可得出的结论是
(2)根据实验Ⅱ中的现象,可以断定该补铁口服液中铁元素的价态为
 价,滴加
价,滴加 溶液后
溶液后 发生反应的离子方程式为
发生反应的离子方程式为(3)一段时间后,发现实验Ⅱ中溶液红色褪去,可能的原因是
 KSCN溶液中加入足量5%
KSCN溶液中加入足量5%  溶液,再加入
溶液,再加入 溶液,观察到
溶液,观察到
您最近一年使用:0次
2021-06-20更新
|
612次组卷
|
5卷引用:北京市海淀区2020-2021学年高一下学期学业水平合格性考试适应练习化学试题
北京市海淀区2020-2021学年高一下学期学业水平合格性考试适应练习化学试题(已下线)周末培优4 金属及其化合物的实验题和工艺流程题-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)易错专题23 Fe2+和Fe3+的检验与转化-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)北京市第十一中学2021-2022学年高一下学期6月月考化学试题(已下线)第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)
解题方法
4 . 已知生石灰与水反应生成 并放出热量,实验室利用此原理向生石灰中滴加浓氨水制取氨气并探究其性质(部分夹持装置已略去)。
并放出热量,实验室利用此原理向生石灰中滴加浓氨水制取氨气并探究其性质(部分夹持装置已略去)。
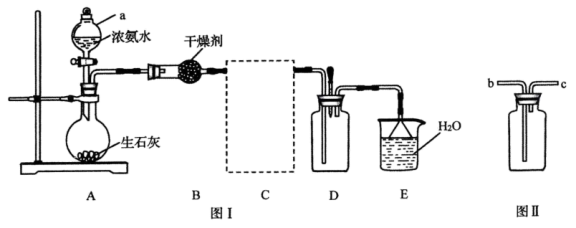
回答下列问题:
(1)仪器 的名称为
的名称为____________ ;装置 中的干燥剂为
中的干燥剂为___________ 。
(2)装置 如图Ⅱ所示,用于收集氨气,装置
如图Ⅱ所示,用于收集氨气,装置 应连接
应连接__________ (填“ ”或“
”或“ ”)。
”)。
(3)装置 中倒置漏斗的作用为
中倒置漏斗的作用为___________ 。
(4)实验进行一段时间后,挤压装置 中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象为
中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象为___________ ;向装置 中滴入1~2滴酚酞溶液,装置
中滴入1~2滴酚酞溶液,装置 中溶液颜色为
中溶液颜色为____________ 。
 并放出热量,实验室利用此原理向生石灰中滴加浓氨水制取氨气并探究其性质(部分夹持装置已略去)。
并放出热量,实验室利用此原理向生石灰中滴加浓氨水制取氨气并探究其性质(部分夹持装置已略去)。
回答下列问题:
(1)仪器
 的名称为
的名称为 中的干燥剂为
中的干燥剂为(2)装置
 如图Ⅱ所示,用于收集氨气,装置
如图Ⅱ所示,用于收集氨气,装置 应连接
应连接 ”或“
”或“ ”)。
”)。(3)装置
 中倒置漏斗的作用为
中倒置漏斗的作用为(4)实验进行一段时间后,挤压装置
 中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象为
中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象为 中滴入1~2滴酚酞溶液,装置
中滴入1~2滴酚酞溶液,装置 中溶液颜色为
中溶液颜色为
您最近一年使用:0次
2021-10-09更新
|
575次组卷
|
3卷引用:山东省2021年普通高中合格考化学试题
解题方法
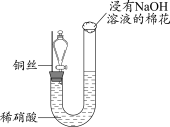
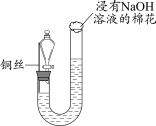
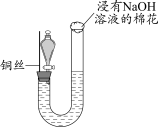
5 . 某同学研究铜与稀硝酸的反应,实验如下(夹持装置已略去,气密性良好)。
(1)HNO3中的氮元素为+5价,是氮元素的最高价态,HNO3具有_______ (填“氧化”或“还原”)性。
(2)步骤III中分液漏斗内的红棕色气体是_______ 。
(3)补全铜与稀硝酸反应的化学方程式:_______ 。_______ (写出一条即可)。
| 步骤I | 步骤II | 步骤III |
|
|
|
| 如图组装仪器并加入药品,分液漏斗旋塞关闭,U型管左侧无气体 | 将铜丝下移,一段时间后,U型管左侧产生无色气体,溶液逐渐变蓝,当液面低于铜丝时,反应逐渐停止 | 将铜丝上移,打开分液漏斗旋塞,U型管内气体进入分液漏斗立即变为红棕色,待气体全部进入分液漏斗后关闭旋塞 |
(2)步骤III中分液漏斗内的红棕色气体是
(3)补全铜与稀硝酸反应的化学方程式:
3Cu+8HNO3(稀)=3Cu(NO3)2+ _______↑+4H2O
_______↑+4H2O
您最近一年使用:0次
2023-01-17更新
|
232次组卷
|
2卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题
名校
6 . 某校研究性学习小组,制取并验证氯气部分化学性质。
反应的方程式: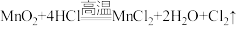 。实验装置如下图所示。
。实验装置如下图所示。
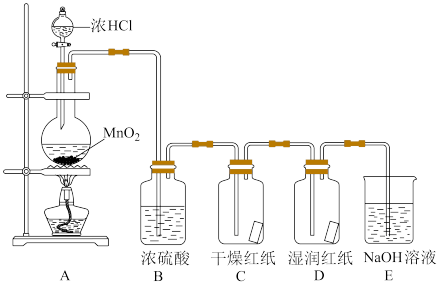
[实验探究]
(1)上述制取氯气的反应中,作氧化剂的物质是________ 。
(2)B装置中物质的作用是______ (填“干燥剂”或“氧化剂”)。
(3)E装置的作用是_______ ,反应的化学方程式为_______ 。
(4)若要制取标准状况下2.24L的 ,需要
,需要 的质量为
的质量为_______ g。
[实验讨论]
(5)有些同学对上述实验装置持有不同看法。
甲同学认为:B装置多余的
乙同学认为:B装置必需的
你认为_______ (填“甲”或“乙”)同学的看法是正确的。
[结论分析]
(6)实验现象表明,C装置中干燥的红纸不褪色,D装置中湿润的红纸褪色,说明起漂白作用的物质是_______ (填“ ”或“HClO”)
”或“HClO”)
[知识应用]
(7)氯气可用来制取很多重要化合物。写出有氯气制取盐酸的化学方程式_______ 。
反应的方程式:
 。实验装置如下图所示。
。实验装置如下图所示。
[实验探究]
(1)上述制取氯气的反应中,作氧化剂的物质是
(2)B装置中物质的作用是
(3)E装置的作用是
(4)若要制取标准状况下2.24L的
 ,需要
,需要 的质量为
的质量为[实验讨论]
(5)有些同学对上述实验装置持有不同看法。
甲同学认为:B装置多余的
乙同学认为:B装置必需的
你认为
[结论分析]
(6)实验现象表明,C装置中干燥的红纸不褪色,D装置中湿润的红纸褪色,说明起漂白作用的物质是
 ”或“HClO”)
”或“HClO”)[知识应用]
(7)氯气可用来制取很多重要化合物。写出有氯气制取盐酸的化学方程式
您最近一年使用:0次
7 . 某小组同学为验证NaHCO3受热分解的产物,设计如图实验(部分夹持装置已略去,气密性已检验)。

(1)实验Ⅰ中,澄清石灰水变浑浊,说明NaHCO3受热分解的产物中含有___ 。
(2)实验Ⅰ中,加热试管a至不再产生气体,观察到内壁有无色液滴生成,有白色固体剩余。为验证剩余白色固体的成分,小组同学设计并完成了实验Ⅱ,观察到有大量无色气体生成,证明白色固体为Na2CO3。试剂X是___ 。
(3)NaHCO3受热分解的化学方程式为__ 。
(4)依据上述实验,除去Na2CO3固体中的少量NaHCO3,可采用的方法是__ 。

(1)实验Ⅰ中,澄清石灰水变浑浊,说明NaHCO3受热分解的产物中含有
(2)实验Ⅰ中,加热试管a至不再产生气体,观察到内壁有无色液滴生成,有白色固体剩余。为验证剩余白色固体的成分,小组同学设计并完成了实验Ⅱ,观察到有大量无色气体生成,证明白色固体为Na2CO3。试剂X是
(3)NaHCO3受热分解的化学方程式为
(4)依据上述实验,除去Na2CO3固体中的少量NaHCO3,可采用的方法是
您最近一年使用:0次
2021-06-28更新
|
787次组卷
|
6卷引用:北京市2021年第一次普通高中合格性考试化学试题
北京市2021年第一次普通高中合格性考试化学试题(已下线)专题2.1.2 碳酸钠和碳酸氢钠(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)必考点07 钠盐及焰色试验-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)北京教育学院附属中学2022-2023学年高一上学期期中练习化学试题北京市第四十三中学2022-2023学年高一上学期期中考试化学试题北京市第三十一中学2023-2024学年高一上学期期中考试化学试题
8 . 集气瓶内装有红棕色气体,加入足量蒸馏水盖上玻璃片振荡,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色,则该气体是
| A.NO | B. | C. | D. |
您最近一年使用:0次
9 . 某兴趣小组用下图所示实验装置(部分夹持仪器已略去)制取并探究Cl2的性质,装置(I)中发生反应的化学方程式为: 。
。
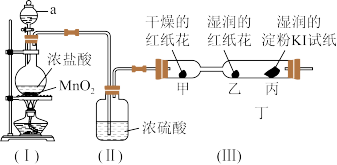
[实验探究]
(1)装置(Ⅰ)中仪器a的名称是_______ 。
(2)装置(Ⅱ)中浓硫酸的作用是_______ 。
(3)实验进行一段时间后,装置(Ⅲ)中的实验现象与分析:
①对甲、乙两处红纸花颜色变化的描述正确的是_______ (填标号)。
A.甲不褪色,乙褪色 B.甲褪色,乙不褪色
②对比甲、乙两处实验现象,可知具有漂白性的物质是_______ (填“Cl2”或“HClO”)。
③丙处淀粉KI试纸变为_______ (填“蓝色”或“红色”),其中Cl2和KI发生反应,补充完整下面的化学方程式: _______。
_______。______
(4)从实验安全和环境保护的角度考虑,该实验存在的一个明显缺陷是_______ 。
(5)用8.7gMnO2固体与足量浓盐酸反应,可生成Cl2气体体积(标准状况下)理论上最多为_______ L。(已知MnO2的摩尔质量为87g/mol)
[知识应用]
Cl2常用于饮用水消毒。Cl2溶于水得到氯水,氯水中HClO的浓度越大杀菌能力越强。
(6)已知25℃时,氯水中Cl2(溶于水的氯气分子)、HClO、 三种微粒所占百分数与pH的关系如图。则用Cl2处理饮用水时,溶液的pH最佳控制范围是
三种微粒所占百分数与pH的关系如图。则用Cl2处理饮用水时,溶液的pH最佳控制范围是_______ (填标号)。

A.3~5.5 B.5.5~7.5
 。
。
[实验探究]
(1)装置(Ⅰ)中仪器a的名称是
(2)装置(Ⅱ)中浓硫酸的作用是
(3)实验进行一段时间后,装置(Ⅲ)中的实验现象与分析:
①对甲、乙两处红纸花颜色变化的描述正确的是
A.甲不褪色,乙褪色 B.甲褪色,乙不褪色
②对比甲、乙两处实验现象,可知具有漂白性的物质是
③丙处淀粉KI试纸变为
 _______。
_______。(4)从实验安全和环境保护的角度考虑,该实验存在的一个明显缺陷是
(5)用8.7gMnO2固体与足量浓盐酸反应,可生成Cl2气体体积(标准状况下)理论上最多为
[知识应用]
Cl2常用于饮用水消毒。Cl2溶于水得到氯水,氯水中HClO的浓度越大杀菌能力越强。
(6)已知25℃时,氯水中Cl2(溶于水的氯气分子)、HClO、
 三种微粒所占百分数与pH的关系如图。则用Cl2处理饮用水时,溶液的pH最佳控制范围是
三种微粒所占百分数与pH的关系如图。则用Cl2处理饮用水时,溶液的pH最佳控制范围是
A.3~5.5 B.5.5~7.5
您最近一年使用:0次
2022-06-11更新
|
211次组卷
|
2卷引用:福建省福州第一中学2021-2022学年高二下学期5月学业模拟考试化学试题
10 . 干燥的氯气不能使有色布条褪色。按下图装置所示操作,观察到有色布条不褪色,则A中的试剂为
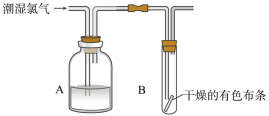

| A.水潮 | B.盐酸 | C.浓硫酸 | D.氯化钠溶液 |
您最近一年使用:0次
2022-05-23更新
|
190次组卷
|
2卷引用:海南省2020年普通高中学业水平合格性考试化学试题